- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Реакции замещения 8 класс
Содержание
- 1. Презентация по химии на тему Реакции замещения 8 класс
- 2. Повторение 2 Тип химической реакции?Расставьте коэффициенты
- 3. Na + Cl2
- 4. Эпиграф к уроку: «Расскажи – и я
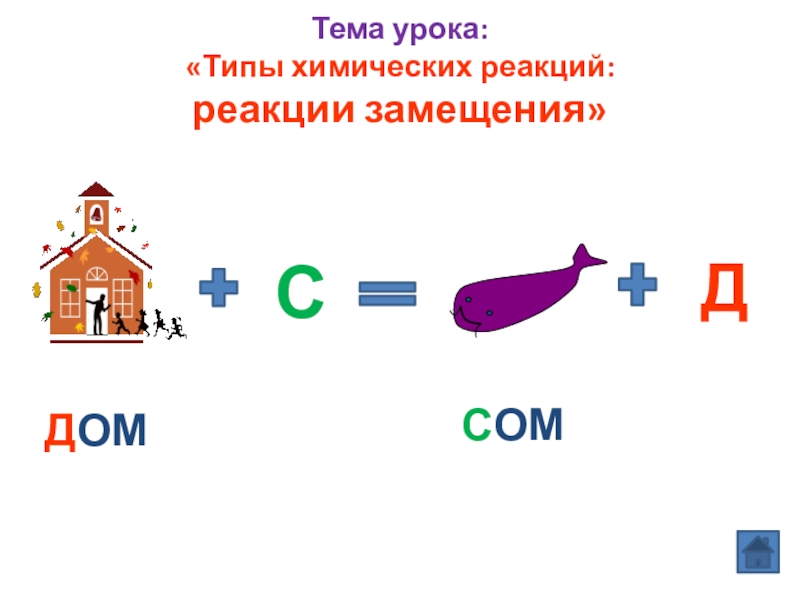
- 5. Тема урока: «Типы химических реакций: реакции замещения» С ДДОМ СОМ
- 6. Сформулируйте определение
- 7. Правила работы с реактивами и оборудованием
- 8. Эксперимент №1: взаимодействие кислот с металлами2.
- 9. Ряд активности металлов (электрохимический ряд напряжений) Li
- 10. Задание № 1продолжите возможные уравнения реакций:Mg +
- 11. Эксперимент № 2 взаимодействие растворов солей с
- 12. Вытеснение металлов из солей.Правило 2: В реакциях
- 13. В двух пробирках находятся металлы Al и
- 14. Укажите тип химической реакции1) CaO + CO2
- 15. Повтори и запомниРеакция замещения -реакции между простым
- 16. Домашнее задание§ 31, стр. 164, №2 (письменно)Из
- 17. Спасибо за урок!
Слайд 1
Повторение 1
Тип химической реакции?
Расставьте коэффициенты в уравнениях
химических реакций:
Ca +
Li + O2 =
S + O2 =
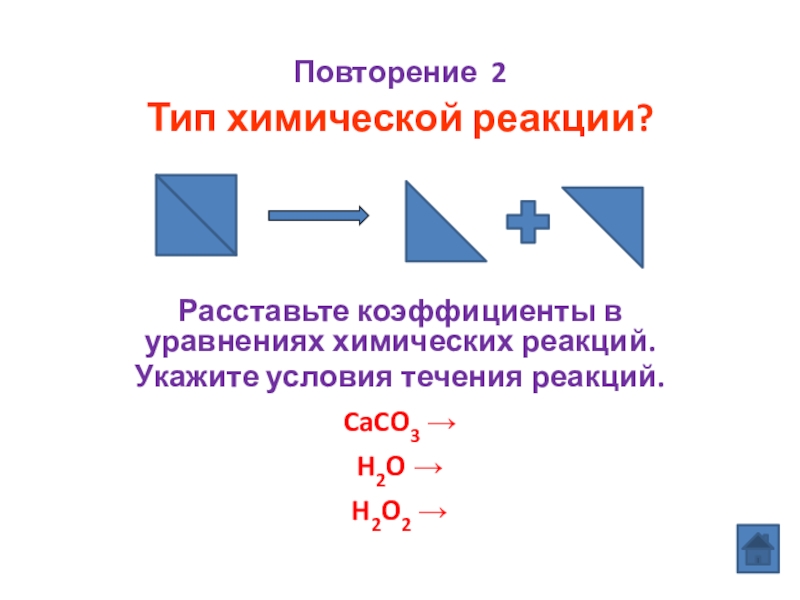
Слайд 2Повторение 2
Тип химической реакции?
Расставьте коэффициенты в уравнениях химических реакций.
Укажите
CaCO3
H2O
H2O2
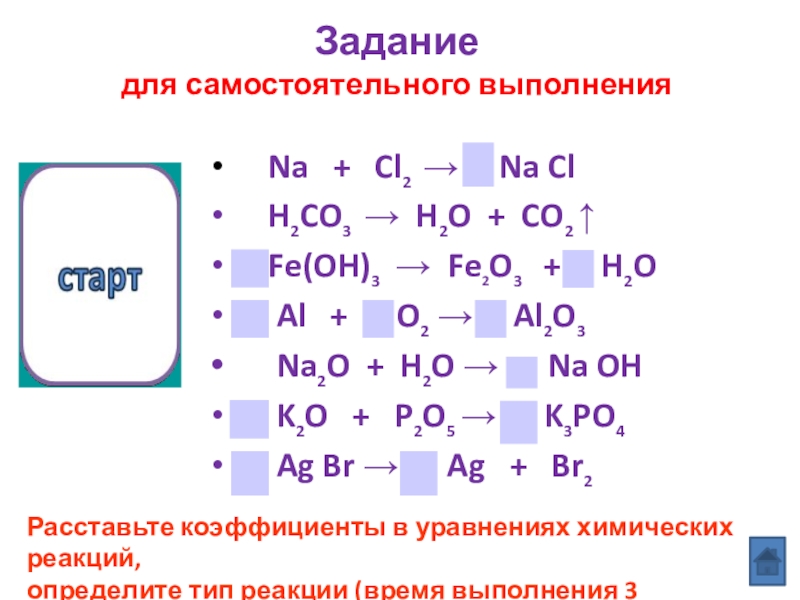
Слайд 3 Na + Cl2 → Na
H2CO3 → H2O + CO2 ↑
Fe(OH)3 → Fe2O3 + H2O
Al + O2 → Al2O3
Na2O + H2O → Na OH
K2O + P2O5 → K3PO4
Ag Br → Ag + Br2
0
1
2
3
4
5
6
7
8
9
10
Задание
для самостоятельного выполнения
Расставьте коэффициенты в уравнениях химических реакций,
определите тип реакции (время выполнения 3 минуты).
Слайд 4Эпиграф к уроку:
«Расскажи – и я забуду,
Покажи – и
Дай попробовать – и я пойму»
(древняя китайская мудрость).
Слайд 6
Сформулируйте определение
Реакции замещения – это…
2 HCl +
сложное + простое = сложное + простое вещество вещество вещество вещество
H Cl + Zn = Zn Cl2 + H2
Какие вещества принимают участие
в химической реакции?
Расставьте коэффициенты в уравнении реакции.
Слайд 7Правила работы с реактивами и оборудованием
Аккуратно, не спешите!
Реактивы брать в
Пробирки должны находиться в штативе!
Строго выполняйте указания учителя
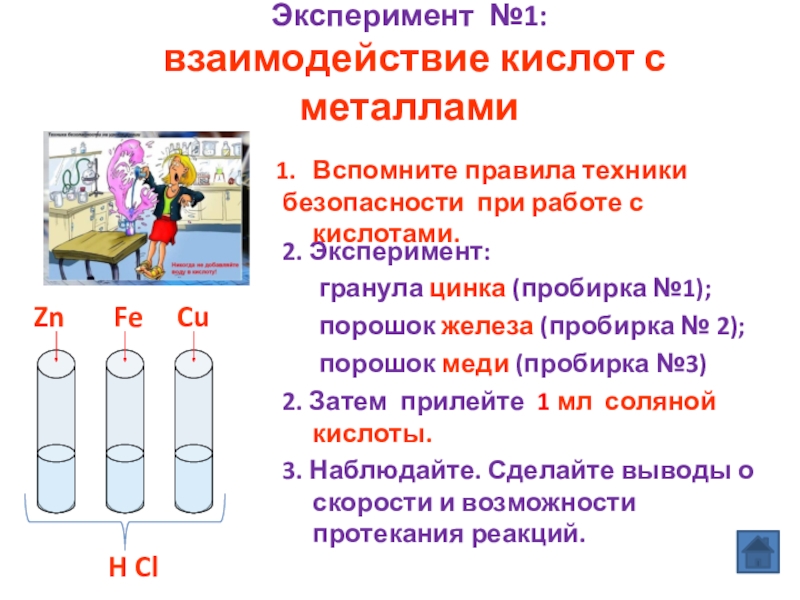
Слайд 8Эксперимент №1:
взаимодействие кислот с металлами
2. Эксперимент:
порошок железа (пробирка № 2);
порошок меди (пробирка №3)
2. Затем прилейте 1 мл соляной кислоты.
3. Наблюдайте. Сделайте выводы о скорости и возможности протекания реакций.
H Cl
Zn
Cu
Fe
Вспомните правила техники
безопасности при работе с кислотами.
Слайд 9Ряд активности металлов (электрохимический ряд напряжений)
Li K Ba Ca Na
металлы, расположенные в ряду активности
до водорода, вступают в реакции замещения с кислотами и водой, вытесняя из них водород.
Н.Н. Бекетов
Чем ближе металл расположен к левому
краю ряда, тем он более активен;
активные металлы (кроме щелочных - Li, Na, K, Rb, Cs и щелочноземельных - Ca, Sr, Ba) вытесняют ионы менее активных металлов из растворов солей;
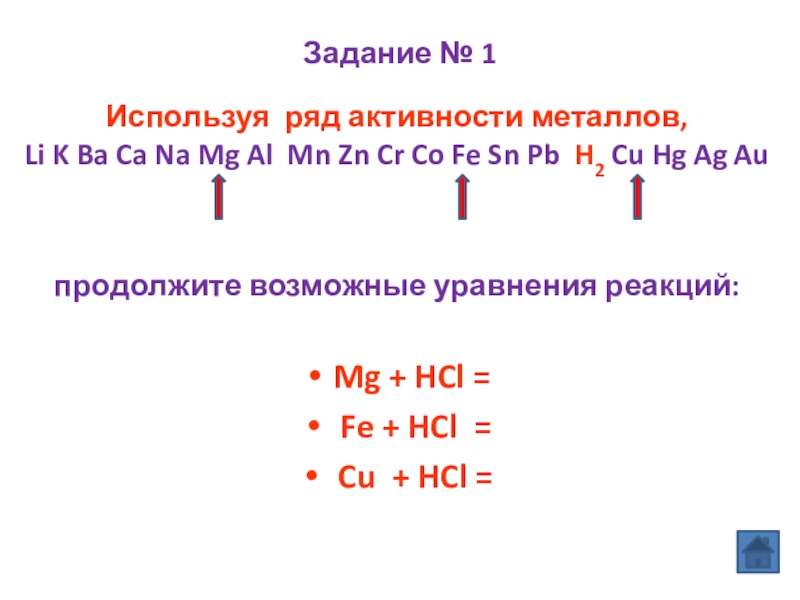
Слайд 10Задание № 1
продолжите возможные уравнения реакций:
Mg + HCl =
Fe +
Cu + HCl =
Используя ряд активности металлов,
Li K Ba Ca Na Mg Al Mn Zn Cr Co Fe Sn Pb H2 Cu Hg Ag Au
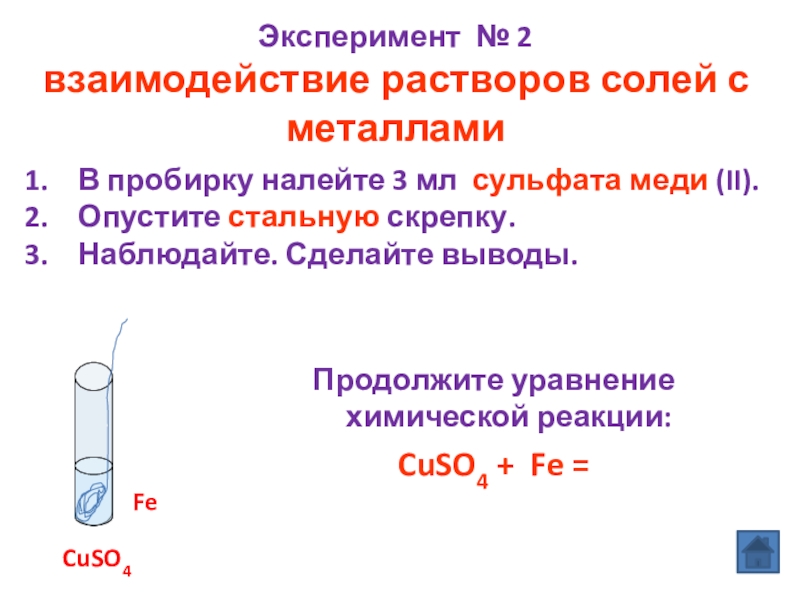
Слайд 11Эксперимент № 2
взаимодействие растворов солей с металлами
Продолжите уравнение химической реакции:
CuSO4 +
В пробирку налейте 3 мл сульфата меди (II).
Опустите стальную скрепку.
Наблюдайте. Сделайте выводы.
CuSO4
Fe
Слайд 12Вытеснение металлов из солей.
Правило 2: В реакциях между металлами и солями:
Каждый
Новая соль должна быть растворима.
Закончить уравнения практически осуществимых реакций:
Fe + CuCl2 = FeCl2 + Cu↓
Fe + AlCl3 =
Fe + HgCl2 =
Al + PbCl2 =
Li, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb, H2, Cu, Hg, Ag.
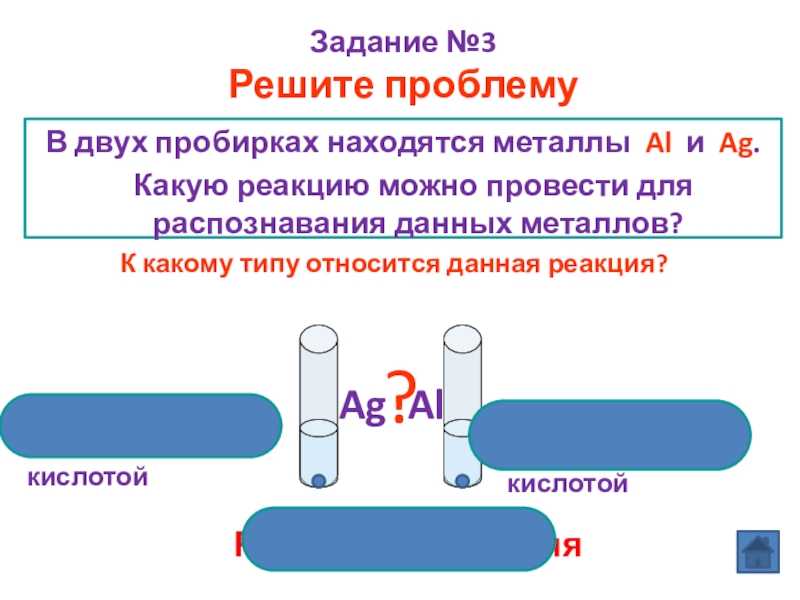
Слайд 13В двух пробирках находятся металлы Al и Ag.
Задание №3
Решите проблему
?
Ag Al
Cu не реагирует с соляной кислотой
Al реагирует с соляной
кислотой
Реакция замещения
К какому типу относится данная реакция?
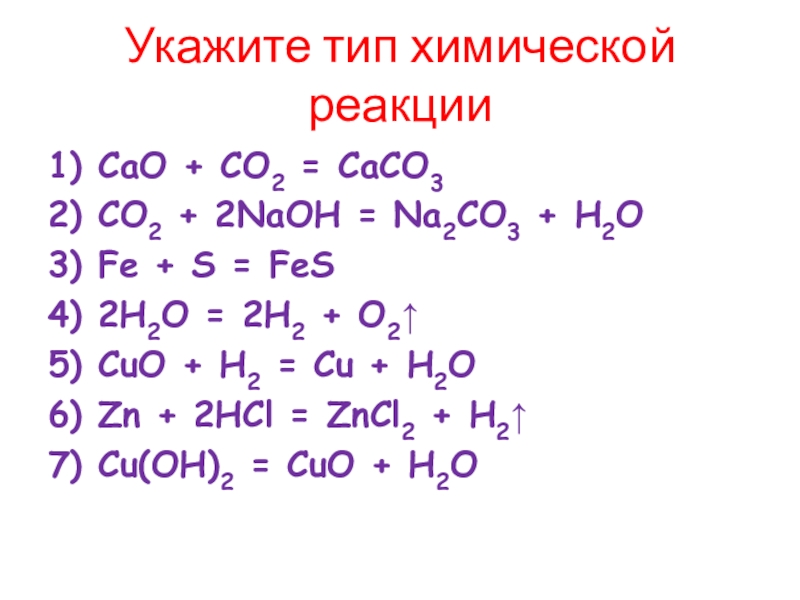
Слайд 14Укажите тип химической реакции
1) CaO + CO2 = CaCO3
2) CO2 +
3) Fe + S = FeS
4) 2H2O = 2H2 + O2↑
5) CuO + H2 = Cu + H2O
6) Zn + 2HCl = ZnCl2 + H2↑
7) Cu(OH)2 = CuO + H2O
Слайд 15Повтори и запомни
Реакция замещения -реакции между простым и сложным веществом, в
Чем ближе металл расположен к левому краю ряда, тем он более активен.
Активные металлы вытесняют ионы менее активных металлов из растворов солей;
Металлы, расположенные до водорода в ряду активности металлов, реагируют и с кислотами, и с водой, вытесняя из них водород. Металлы, расположенные в данном ряду после водорода, с кислотами и с водой не реагируют, то есть не вытесняют из них водород.