- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Равновесие и его смещение
Содержание
- 1. Презентация по химии на тему Равновесие и его смещение
- 2. Классификация химических реакций по признаку обратимости
- 3. Практическая часть 1
- 4. Проверка практической части 1
- 5. Часть 2. Смещение равновесия vпр =
- 6. Метод «стрелочки»: заключается в определении противодействия
- 7. Метод «стрелочки»: заключается в определении противодействия
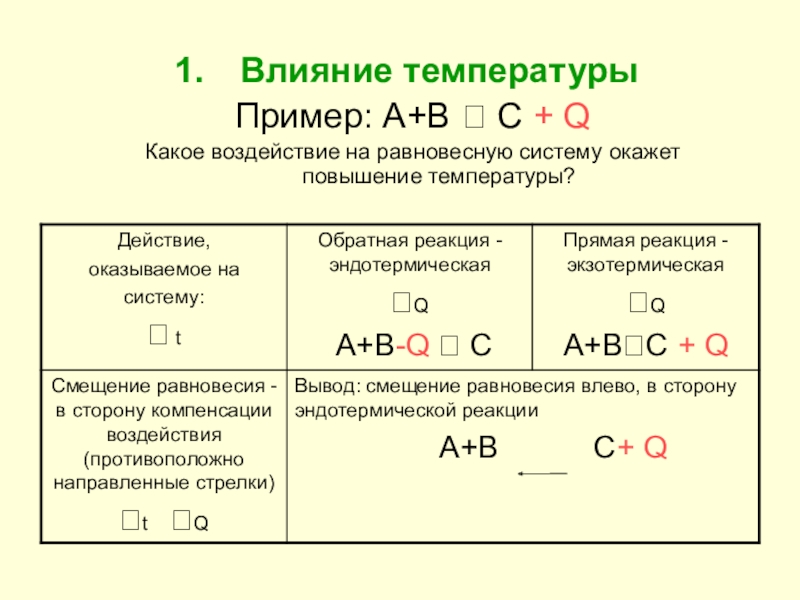
- 8. Влияние температурыПример: А+В С + QКакое воздействие на равновесную систему окажет повышение температуры?
- 9. 1.1 Упражнения «Влияние температуры»
- 10. Ответы к упражнению «Влияние температуры»
- 11. 1.2. Тренинг «Влияние температуры»
- 12. 2. Влияние давления 1. Анализ уравнения в
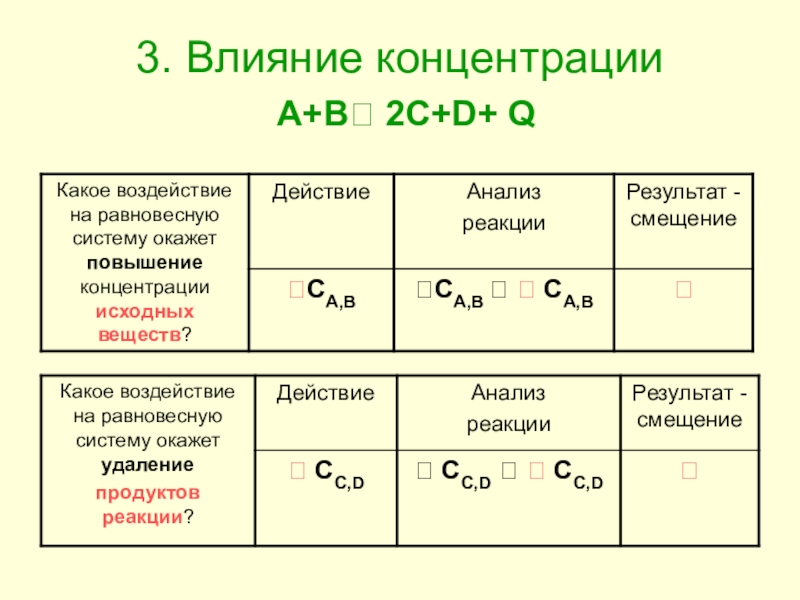
- 13. 3. Влияние концентрации A+B 2C+D+ Q
- 14. Химическое равновесие в системе … сместится
- 15. Алгоритм решения СО (Г) +2Н2 (Г) СН3ОН (Г) +Q
- 16. II. На смещение равновесия системы не оказывает влияния
- 17. Для увеличения скорости химической
- 18. В какой системе
- 19. A25 (2005г, 49%)В системе СН3СООН + СН3ОН
- 20. Правильный ответ: 1. Поскольку реакция этерификации проводится
Слайд 1
«Химическое равновесие и его смещение»
г.Норильск
МБОУ «Гимназия №7»
Вотинцева Татьяна Андреевна
Слайд 5Часть 2. Смещение равновесия vпр = vобр Принцип Ле Шателье -
Если изменить одно из условий, при которых система находится в состоянии равновесия,
то положение равновесия сместится в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия
Слайд 6Метод «стрелочки»: заключается в определении противодействия системы с помощью противоположно направленных
Слайд 7Метод «стрелочки»: заключается в определении противодействия системы с помощью противоположно направленных
Слайд 8Влияние температуры
Пример: А+В С + Q
Какое воздействие на равновесную систему
Слайд 122. Влияние давления 1. Анализ уравнения в отношении объемов: V(тв., ж.)=0, А(тв.)+2В(г.)
Слайд 14Химическое равновесие
в системе … сместится в сторону
продукта реакции при
Понижении температуры
Понижении концентрации СО
Повышении концентрации СН3ОН
Понижении давления
Слайд 17 Для увеличения скорости химической реакции Fe (тв.) + 2H+ = Fe2+
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
Слайд 18 В какой системе при повышении давления химическое равновесие сместится в сторону
1) N2 (г.) + 3H2(г.) = 2NH3 (г.) + Q
2) N2O4 = 2NO2 (г.) -Q
3) CO2 (г.) + H2 (г.) =CO (г.) + H2O (г.) -Q
4) 4HCl(г.) +O2(г.) = 2H2O(г.) + 2Cl2(г.) +Q
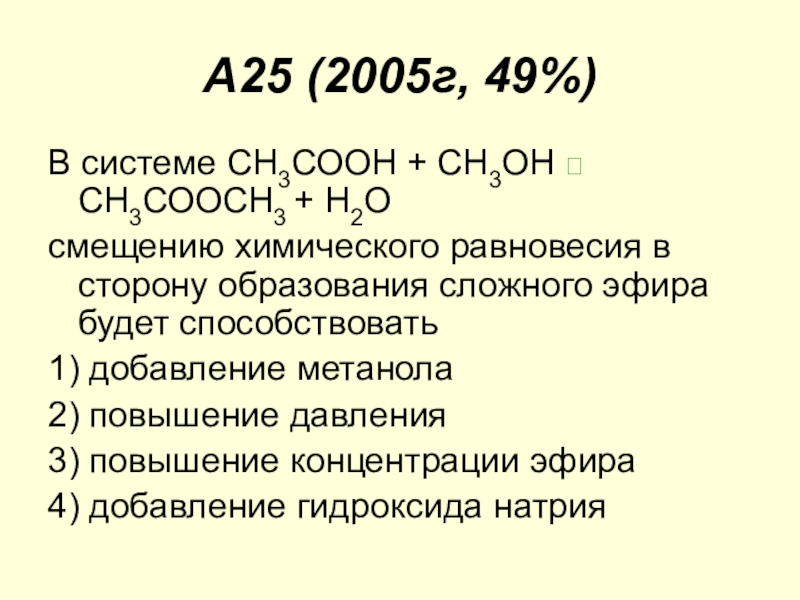
Слайд 19A25 (2005г, 49%)
В системе СН3СООН + СН3ОН СН3СООСН3 + Н2О
смещению
1) добавление метанола
2) повышение давления
3) повышение концентрации эфира
4) добавление гидроксида натрия
Слайд 20Правильный ответ: 1.
Поскольку реакция этерификации проводится в жидком состоянии, давление не
Повышение концентрации эфира, продукта реакции смещает равновесие в сторону исходных веществ.
Действие гидроксида натрия: хотя непосредственно в обратимой реакции он не участвует, но может взаимодействовать с уксусной кислотой, снижать ее концентрацию, смещать равновесие влево.