- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Проектная деятельность учащихся
Содержание
- 1. Презентация по химии на тему Проектная деятельность учащихся
- 2. «Скажи мне - и я забуду, покажи
- 3. Ключевые моментыПРОЕКТроблемаазнообразные способы её решениясновополагающий вопросдинство целей и задачонкретные результаты исследованияворческий подход
- 4. История возникновения и развития метода учебных
- 5. Характеристика технологии «метод проектов»Метод проектов объединяет в
- 6. Э т а п ы р
- 7. Правила и принципы успешной
- 8. Алгоритм проектировочной деятельности учителя
- 9. Слайд 9
- 10. проект“ПРИРОДНЫЕ ИНДИКАТОРЫ- АНТОЦИАНЫ В ЛАБОРАТОРИИ.”2019
- 11. Содержание:ВВЕДЕНИЕИСТОРИЯ ИНДИКАТОРОВПРИРОДНЫЕ И СИНТЕТИЧЕСКИЕ ИНДИКАТОРЫВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH; СРЕДА РАСТВОРАЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬВыводыИНДИКАТОРЫ
- 12. Введение:В стихотворении известного английского поэта Р. Киплинга
- 13. Введение:В цилиндр налить концентрированный нашатырный спирт и
- 14. Гипотеза:Выделенный из природных окрашенных объектов пигмент антоциан является индикатором
- 15. Цель работы:Исследование изменения цвета пигмента антоциана в различных средах
- 16. Задачи работы:Изучить литературу об истории открытии индикаторов;
- 17. Методы исследования:Изучение литературы Химический эксперимент Анализ эксперимента
- 18. Объекты исследования:Растительные объекты, содержащие пигменты: листья краснокочанной капустыБытовые растворы-разные виды шампуней
- 19. История индикаторовВыделенные из растений пигменты – красящие
- 20. История индикаторовВ лаборатории Р. Бойля на основе
- 21. Индикаторы синтетические и природныеИндикаторы (от латинского indicator
- 22. Природные индикаторыЕсли нет настоящих химических индикаторов, то
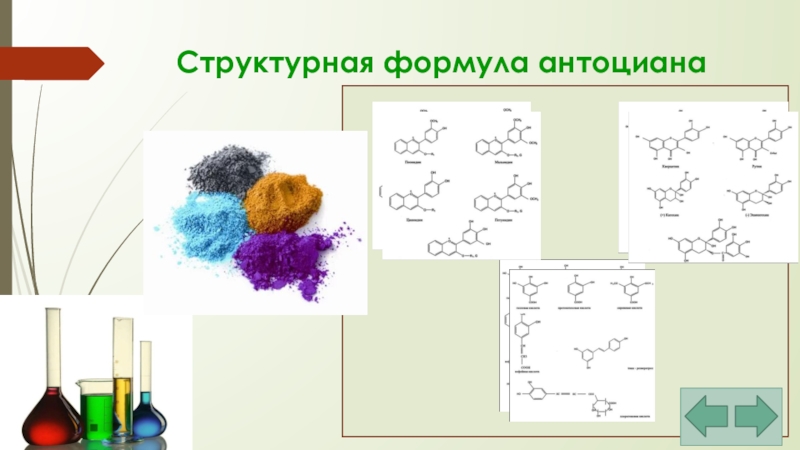
- 23. Структурная формула антоциана
- 24. Водородный показатель pHВодородный показатель, pH (лат. pondus
- 25. Водородный показатель pHpH < 7 – кислая
- 26. Водородный показатель pHВелика роль водородного показателя в
- 27. Экспериментальная часть
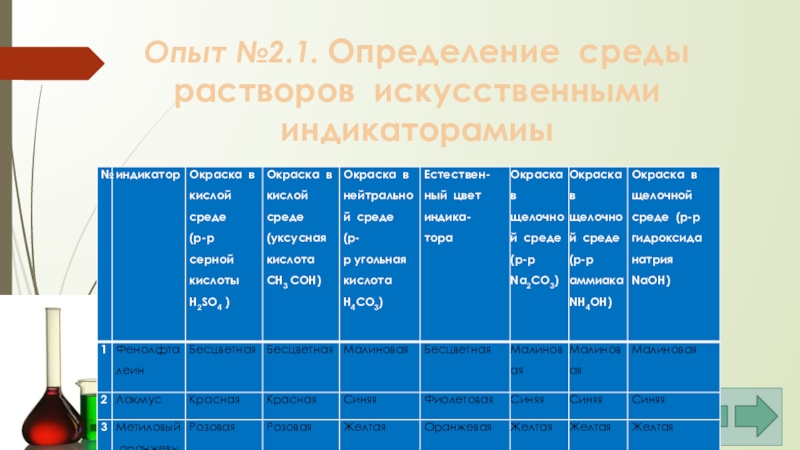
- 28. Опыт №2.1. Определение среды растворов искусственными индикаторамиы
- 29. Опыт №2.2. Методика приготовления природных индикаторов. Выделение
- 30. Опыт №2.3. Изготовление индикаторных антоциановых бумажек.Ход работы:в
- 31. Опыт №2.4. Определение среды растворов природными
- 32. Опыт №2.4. Определение среды растворов природными
- 33. Опыт №2.5. Определение среды моющих средств-шампуней. Ход
- 34. Опыт №5. Определение среды
- 35. Краткие выводыИз окрашенных растительных объектов можно выделить
- 36. Заключение 1. Гипотеза о том, что растительный
Слайд 3Ключевые моменты
ПРОЕКТ
роблема
азнообразные способы её решения
сновополагающий вопрос
динство целей и задач
онкретные результаты исследования
ворческий
Слайд 4История возникновения и развития метода учебных
проектов
Метод
сельскохозяйственных школах США и основывался на
теоретических концепциях «прагматической
педагогики», основоположником которой был
американский философ Джон Дьюи.
Слайд 5Характеристика технологии «метод проектов»
Метод проектов объединяет в себе несколько технологий:
1. Исследовательская (проблемно - поисковая) – характерной чертой технологии является реализация педагогом модели «обучение через открытие».
2. Коммуникативная (дискуссионная) – особенностью технологии является наличие
дискуссий, характеризующихся различными точками зрения по изучаемым вопросам, сопоставлением их, поиском, за счет обсуждения, истинной точки зрения.
3. Имитационного моделирования (игровая) - характерной чертой является моделирование жизненно важных профессиональных затруднений в образовательном пространстве и поиск путей их решения.
4. Психологическая (самоопределенческая) – характерной чертой технологии является самоопределение обучаемого к выполнению той или иной образовательной деятельности.
5. Деятельностная – характерная черта технологии проектирование учеником предстоящей деятельности, участие в ней в роли субъекта.
6. Рефлексивная – предусматривает осознание учеником своей деятельности: того как, каким способом получен результат, какие при этом встречались затруднения, как они были устранены, и что чувствовал ученик при этом.
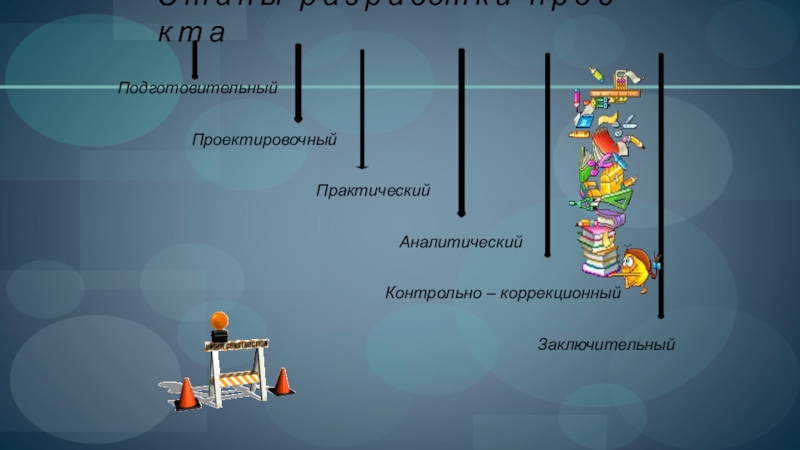
Слайд 6Э т а п ы р а з р а
Подготовительный
Проектировочный
Практический
Аналитический
Контрольно – коррекционный
Заключительный
Слайд 10
проект
“ПРИРОДНЫЕ ИНДИКАТОРЫ- АНТОЦИАНЫ
В ЛАБОРАТОРИИ.”
2019 г.
Государственное бюджетное общеобразовательное учреждение
школа №93
Выполнила Бредис Анна
ученица 5.3 класса
Руководитель Максимова Н.Е.
Консультант Долганов Сергей
ученик 11.1 класса
Слайд 11Содержание:
ВВЕДЕНИЕ
ИСТОРИЯ ИНДИКАТОРОВ
ПРИРОДНЫЕ И СИНТЕТИЧЕСКИЕ ИНДИКАТОРЫ
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH; СРЕДА РАСТВОРА
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выводы
ИНДИКАТОРЫ
Слайд 12Введение:
В стихотворении известного английского поэта Р. Киплинга – “Синие розы”, есть
Как-то милой я принес
Целый ворох красных роз
Не взяла она – и в слезы
Синие найди ей розы
Зря изъездил я весь свет –
Синих роз под солнцем нет.
Слайд 13Введение:
В цилиндр налить концентрированный нашатырный спирт и поместить красный цветок. Через
Почему это произошло?
Как объяснить такие изменения у растений?
При взаимодействии с парами нашатырного спирта окраска красной розы становится фиолетовой. Следовательно, произошла химическая реакция.
Возможности науки необычайно широки, но свои первые шаги она начинала с изучением природных веществ.
Слайд 16Задачи работы:
Изучить литературу об истории открытии индикаторов;
Познакомиться с методикой выделения
Провести экспериментальную работу по выделению пигмента антоциана из листьев краснокочанной капусты и ягод чёрной смородины;
Проверить экспериментально работу природного индикатора антоциана в разных средах;
Приготовить индикаторные антоциановые бумажки;
Определить среду некоторых бытовых растворов для природного индикатора антоциана.
Слайд 18Объекты исследования:
Растительные объекты, содержащие пигменты: листья краснокочанной капусты
Бытовые растворы-разные виды
Слайд 19История индикаторов
Выделенные из растений пигменты – красящие вещества – были известны
Слайд 20История индикаторов
В лаборатории Р. Бойля на основе этого раствора была впервые
Слайд 21Индикаторы синтетические и природные
Индикаторы (от латинского indicator – указатель) – это
Слайд 22Природные индикаторы
Если нет настоящих химических индикаторов, то для определения среды растворов
Главными отличиями растительных от синтетических индикаторов является то, что они не имеют чётких границ перехода, цвет меняется постепенно.
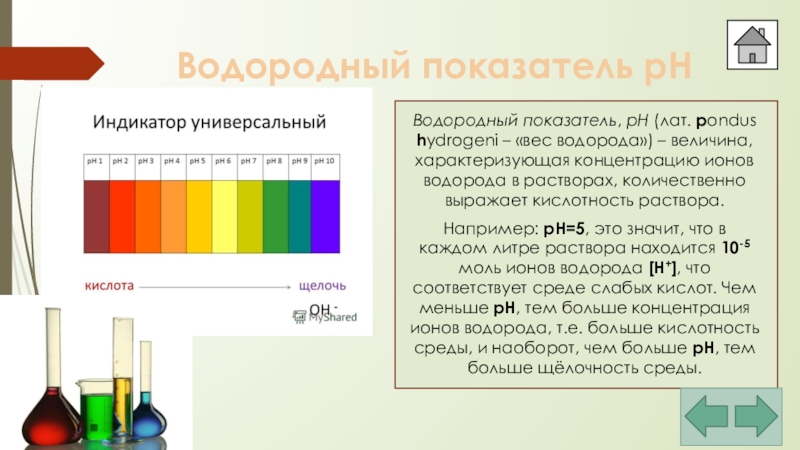
Слайд 24Водородный показатель pH
Водородный показатель, pH (лат. pondus hydrogeni – «вес водорода»)
Например: pH=5, это значит, что в каждом литре раствора находится 10-5 моль ионов водорода [H+], что соответствует среде слабых кислот. Чем меньше pH, тем больше концентрация ионов водорода, т.е. больше кислотность среды, и наоборот, чем больше pH, тем больше щёлочность среды.
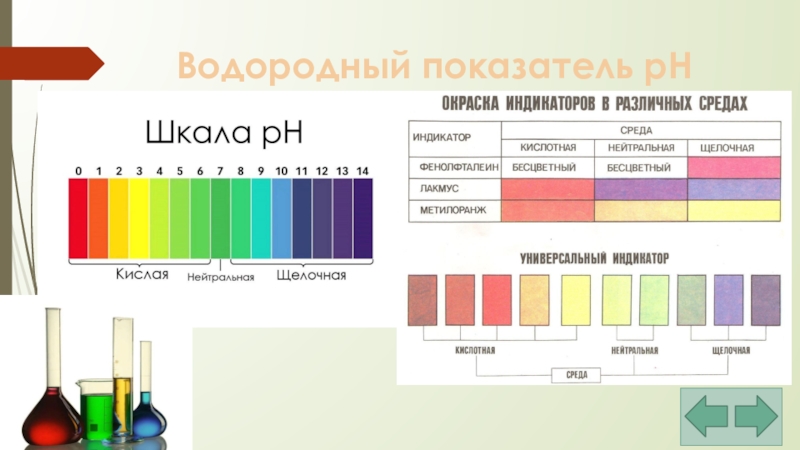
Слайд 25Водородный показатель pH
pH < 7 – кислая среда;
pH = 7 –
pH > 7 – щелочная среда.
Слайд 26Водородный показатель pH
Велика роль водородного показателя в самых различных явлениях и
Слайд 29Опыт №2.2. Методика приготовления природных индикаторов. Выделение антоциана из краснокочанной капусты.
Ход
разрезать кочан на маленькие кусочки;
залить кипятком на 5-8 минут;
профильтровать.
Наблюдения:
получили раствор фиолетового цвета (среда нейтральная).
Слайд 30Опыт №2.3. Изготовление индикаторных антоциановых бумажек.
Ход работы:
в фарфоровую чашечку налить раствор
пропитать раствором фильтрованную бумагу;
оставить сохнуть на 3 дня в тёмном месте;
нарезать полоски по 5 мм шириной.
Наблюдения:
Получили индикаторные антоциановые полоски светло-сиреневого цвета.
индикаторные полоски
Слайд 31Опыт №2.4. Определение среды растворов природными антоциановыми индикаторами. Проверка работы
Ход работы:
Для изучения изменения окраски природных индикаторов в различных средах брали несколько капель серной кислоты, уксусной кислоты, угольной кислоты, карбоната натрия, раствора аммиака , гидроксида натрия , поочередно добавляли их к природным индикаторам в пробирки
Наблюдения:
При взаимодействии происходило изменение окраски растворов.
кислая среда
нейтральная среда
щелочная среда
Слайд 32Опыт №2.4. Определение среды растворов природными индикаторами антоциановыми бумажками (составление
Ход работы:
все выбранные нами объекты изменяют свою естественную окраску в зависимости от кислотности среды. Наблюдения:
Очень хорошо это наблюдается у краснокочанной капусты, отвар которой в кислой среде становятся розовыми-красными, в нейтральной- фиолетовыми, а в щелочной — жёлтыми- светлозелеными. добавим в вытяжку из краснокочанной капусты раствор щёлочи.
нейтральная среда
щелочная среда
Слайд 33Опыт №2.5. Определение среды моющих средств-шампуней.
Ход работы:
В химических стаканчиках приготовим
Определим pH среды растворов с помощью универсального индикатора и антоцианового индикатора.
Слайд 35Краткие выводы
Из окрашенных растительных объектов можно выделить пигмент, являющийся индикатором;
Изготовленные вытяжки
Пропитанную антоцианом фильтрованную бумагу можно использовать для определения pH среды растворов, как в школьной лаборатории, так и в быту.