и применение.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Предельные углеводороды
Содержание
- 1. Презентация по химии на тему Предельные углеводороды
- 2. Слайд 2
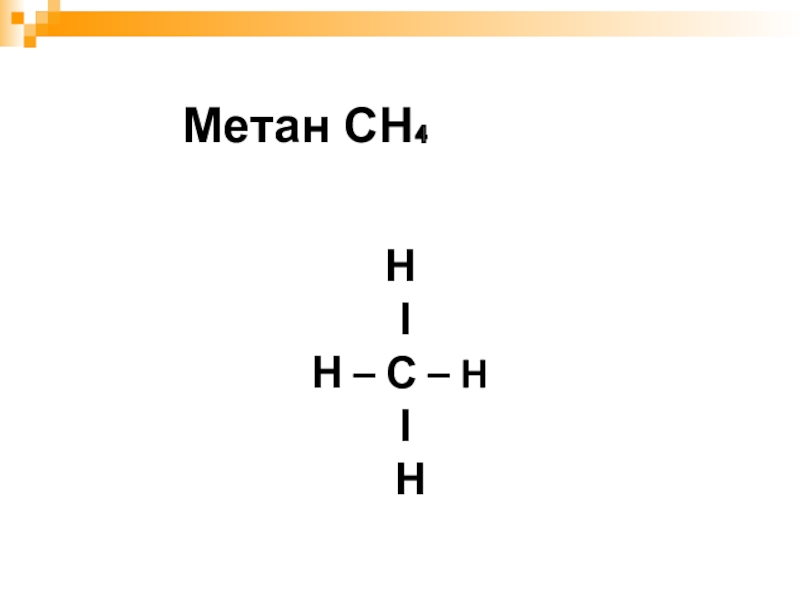
- 3. Н ΙН – С – H Ι НМетан СН₄
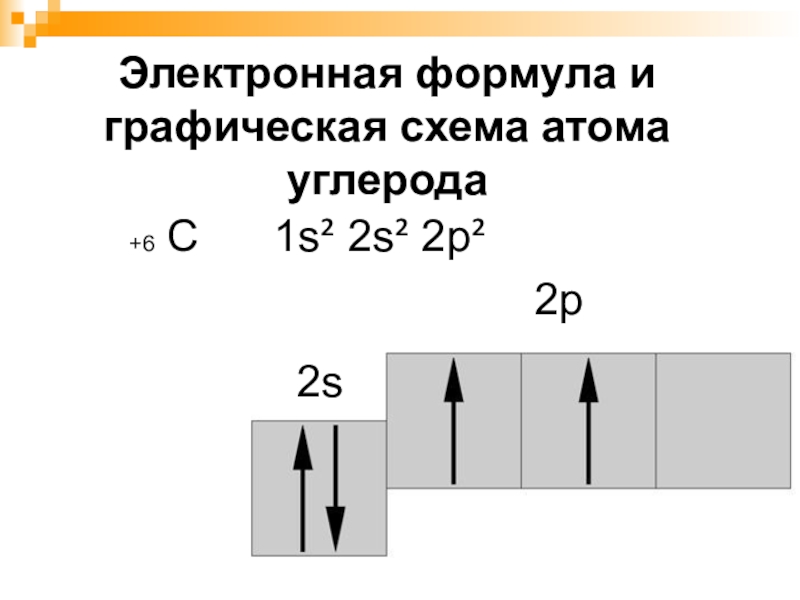
- 4. Электронная формула и графическая схема атома углерода +6 С 1s² 2s² 2p²2s2р
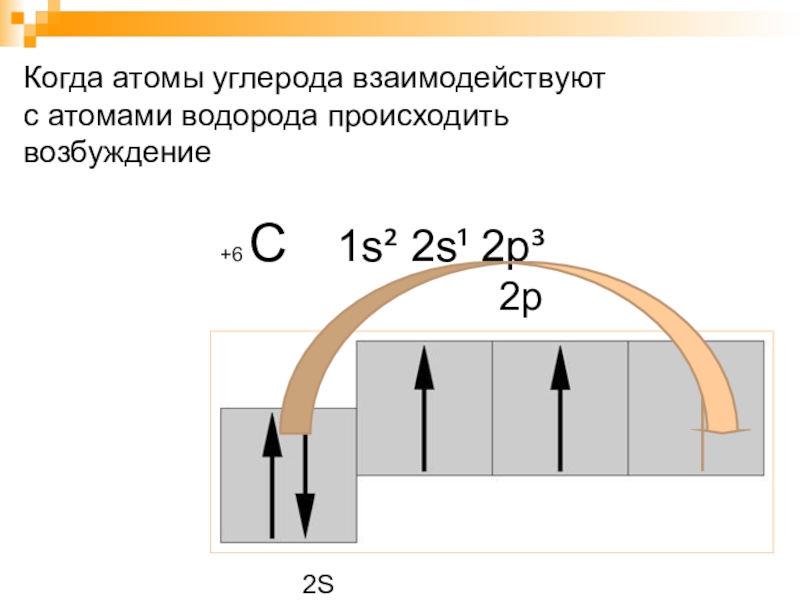
- 5. +6 С 1s² 2s¹ 2p³2s2рКогда атомы углерода взаимодействуютс атомами водорода происходить возбуждение2S
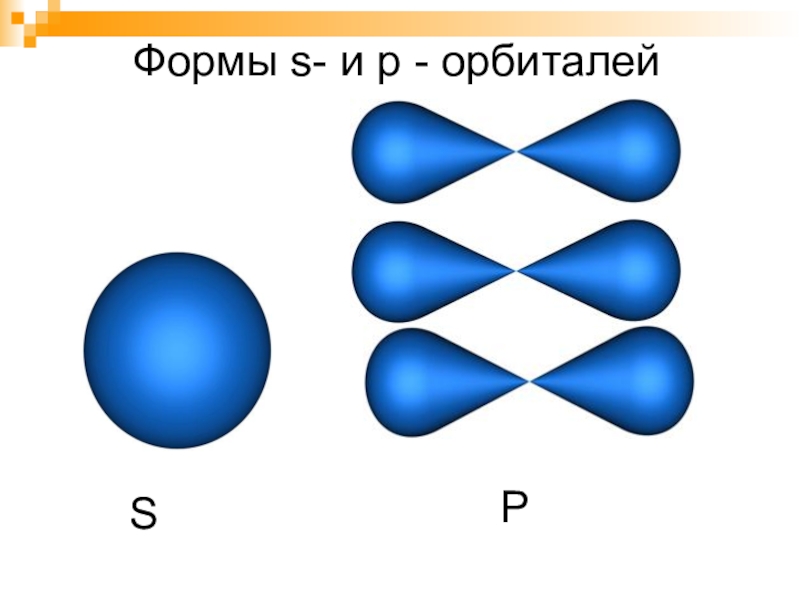
- 6. Формы s- и p - орбиталейSP
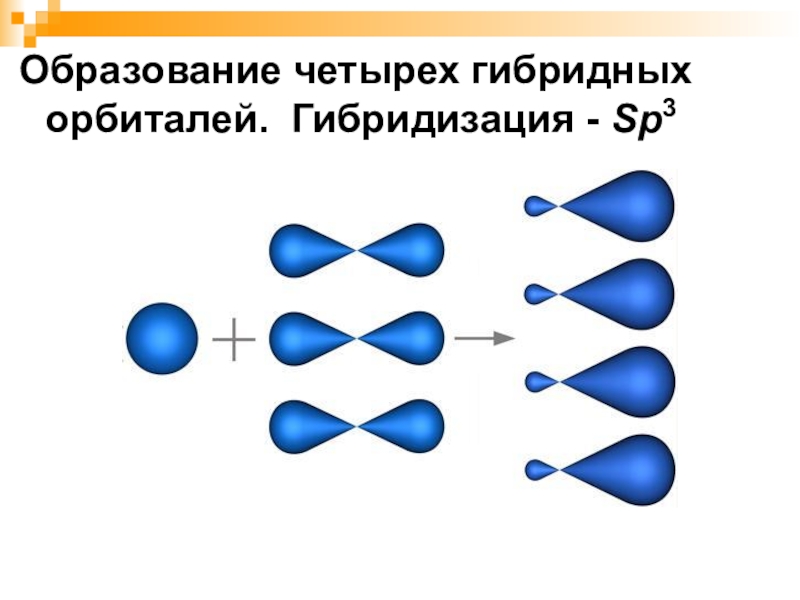
- 7. Образование четырех гибридных орбиталей. Гибридизация - Sp3
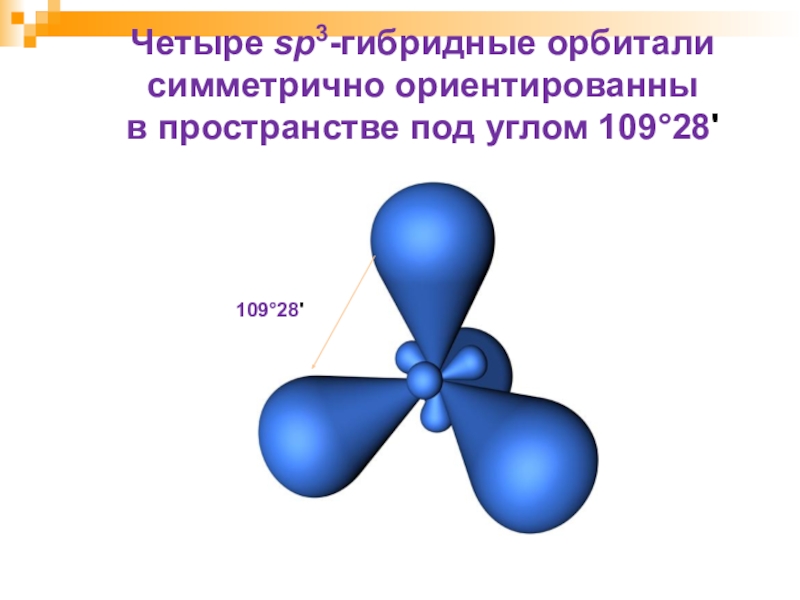
- 8. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'109°28'
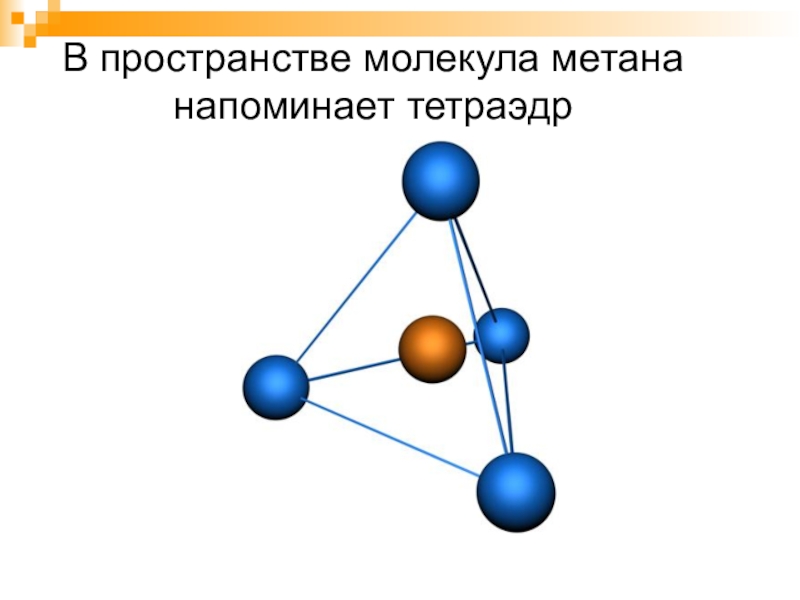
- 9. В пространстве молекула метана напоминает тетраэдр
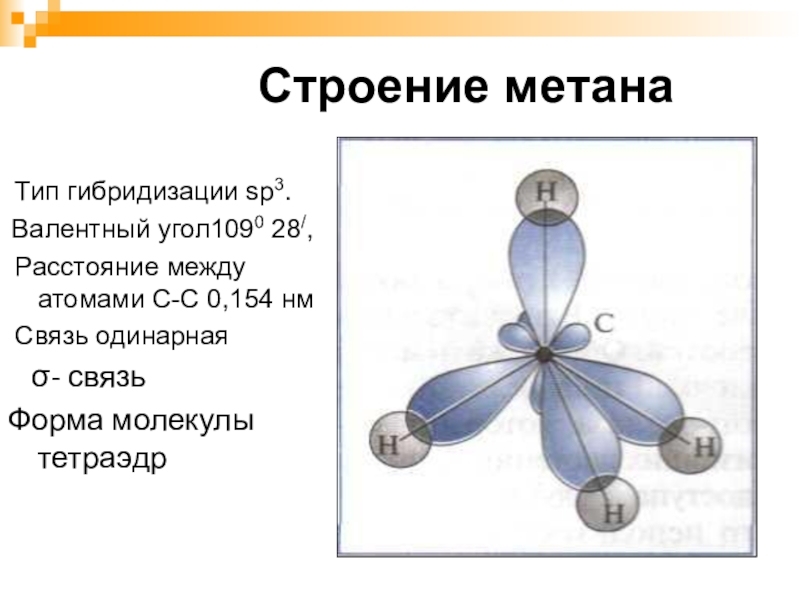
- 10. Строение метана Тип гибридизации sp3.Валентный угол1090 28/,
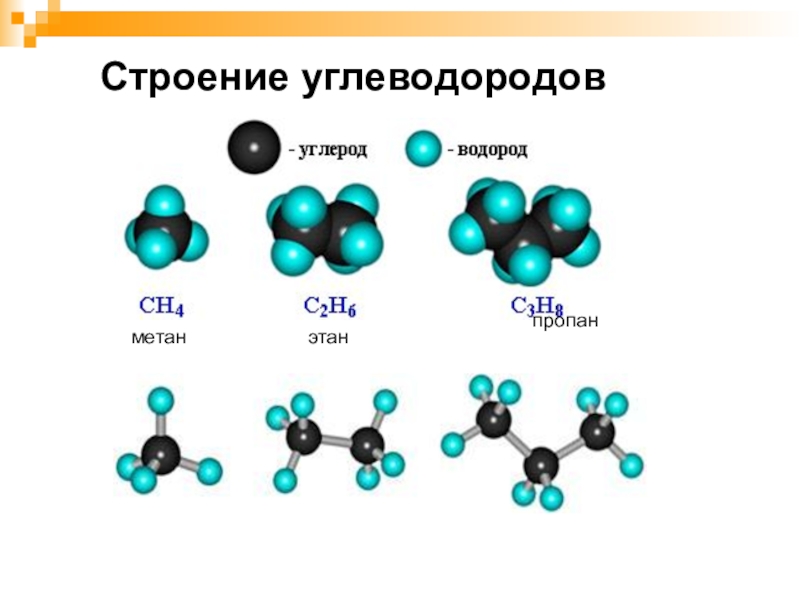
- 11. Строение углеводородов
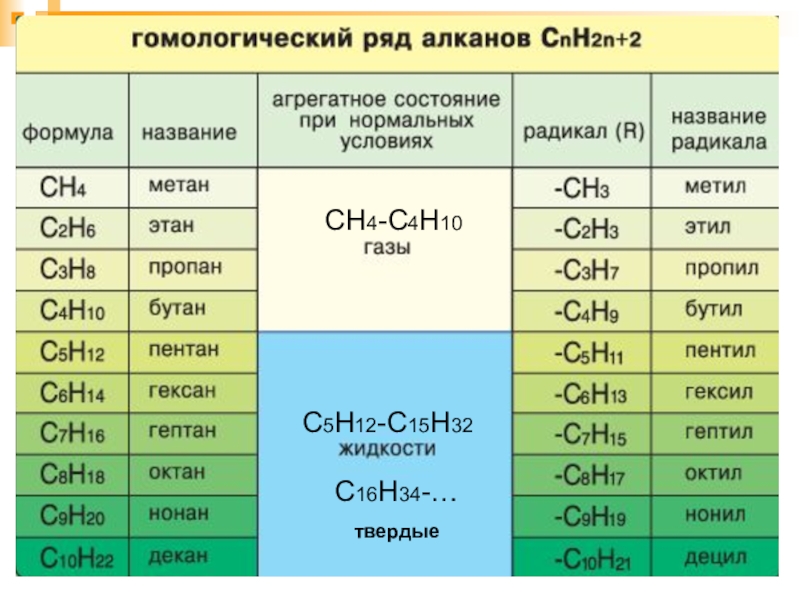
- 12. Предельные углеводороды образуют гомологический ряд.ГОМОЛОГИ – это
- 13. СН4-С4Н10С5Н12-С15Н32С16Н34-…твердые
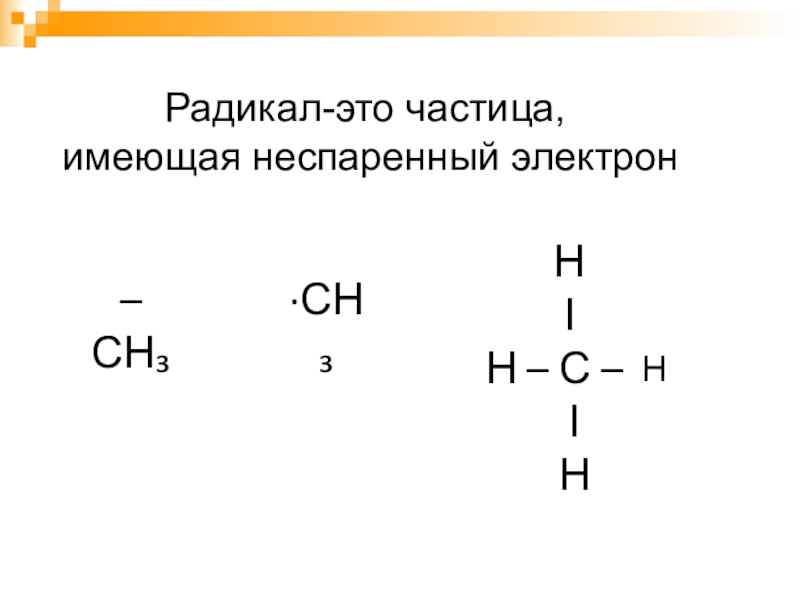
- 14. Радикал-это частица, имеющая неспаренный электрон–СН₃∙СН₃ Н
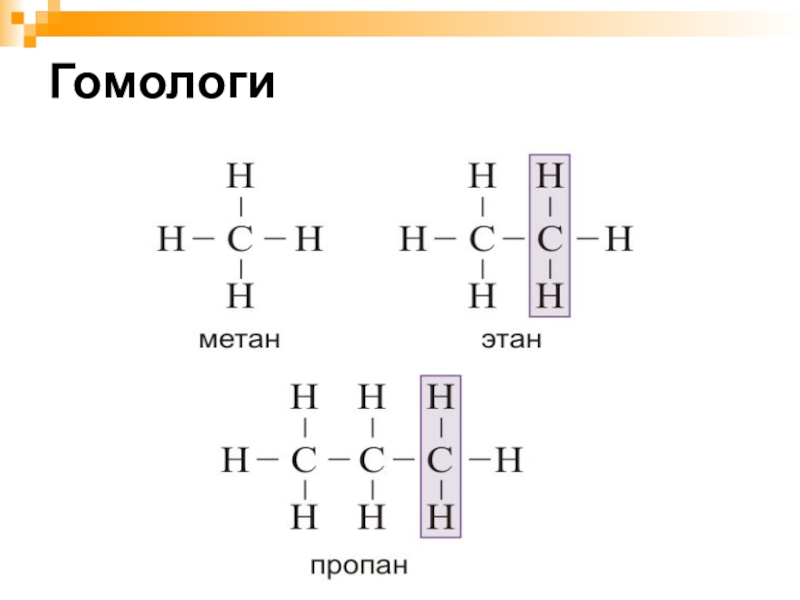
- 15. Гомологи
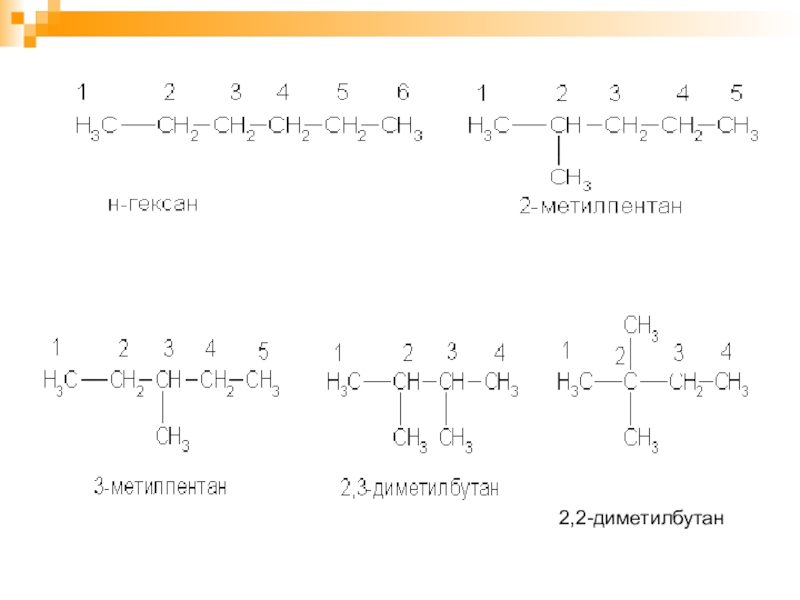
- 16. Номенклатура1.Выбирают в формуле наиболее длинную углеводородную цепь
- 17. 2,2-диметилбутан
- 18. 2. Называют номер углеродного атома, с которым
- 19. 1) СН3–СН–СН–СН2 –СН–СН3
- 20. Нахождение в природе:Природный газ на 75%-85% состоит
- 21. Физические свойства С 1 – С4 –
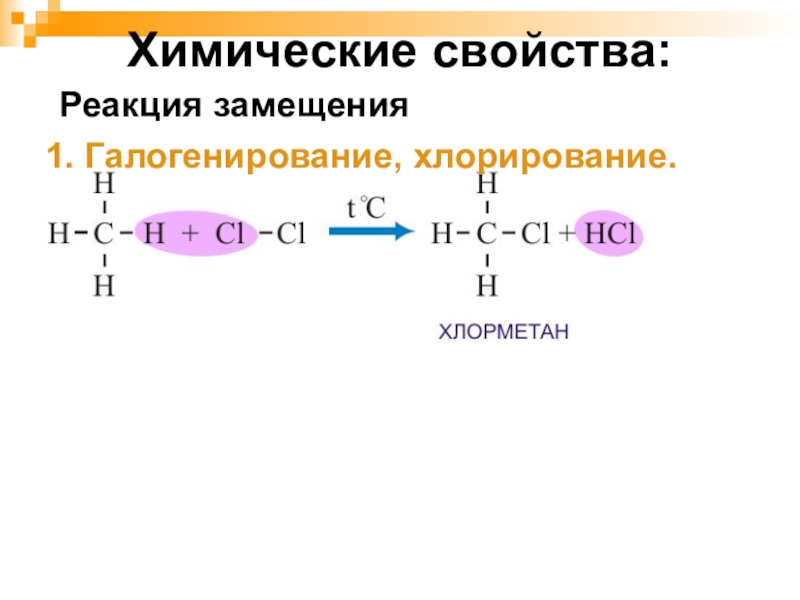
- 22. Химические свойства:1. Галогенирование, хлорирование.Реакция замещения
- 23. Реакция
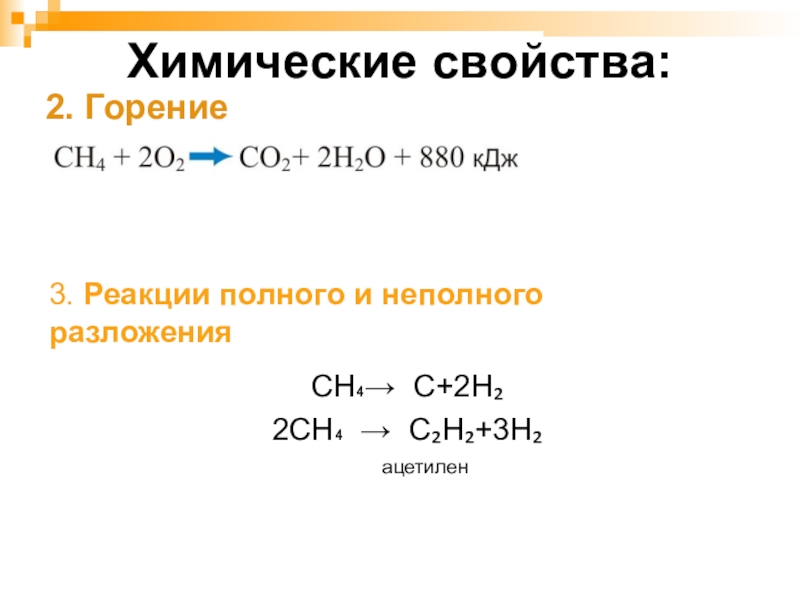
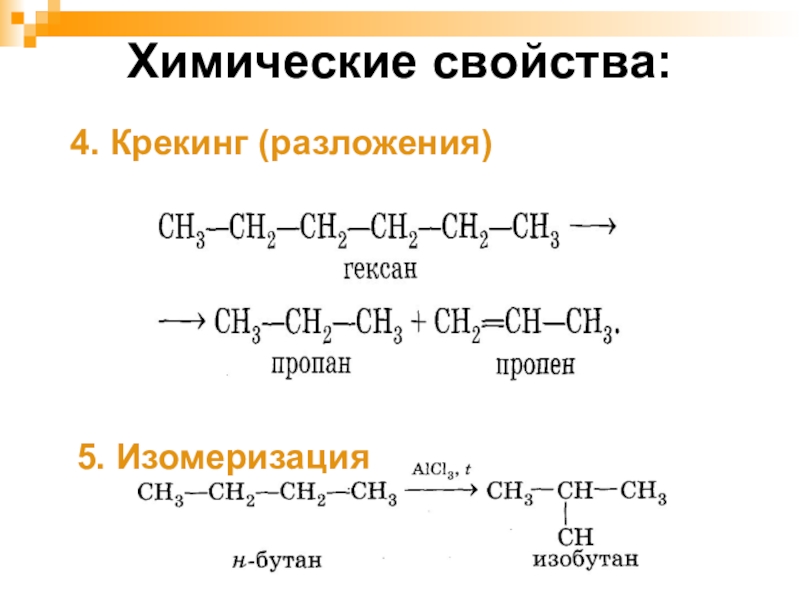
- 24. Химические свойства:2. ГорениеCH₄→ C+2H₂2CH₄ → C₂H₂+3H₂3. Реакции полного и неполного разложенияацетилен
- 25. Химические свойства:4. Крекинг (разложения)5. Изомеризация
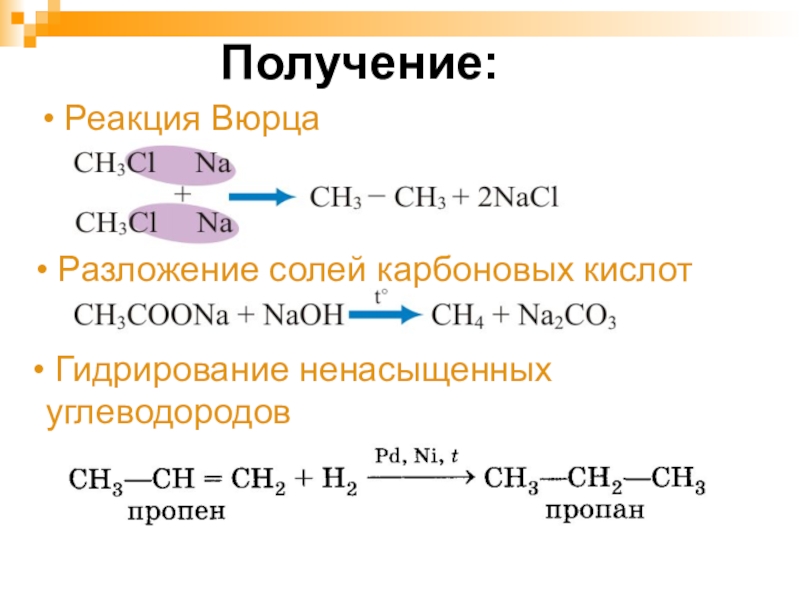
- 26. Получение: Реакция Вюрца Разложение солей карбоновых кислот Гидрирование ненасыщенных углеводородов
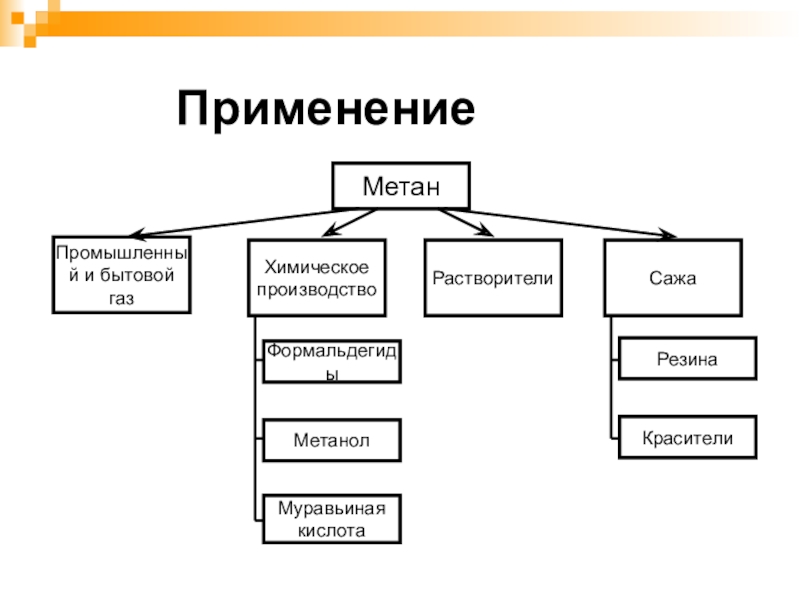
- 27. МетанХимическое производствоРастворителиСажаФормальдегидыМетанолМуравьиная кислотаРезинаКрасителиПромышленный и бытовой газ Применение
Алканы (предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой одинарными σ(сигма) связями.Предельные углеводороды
Слайд 1Предельные углеводороды.
Электронное строение, гомологический ряд, номенклатура, физические и химические свойства, получение
Слайд 2
Алканы
(предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой одинарными σ(сигма) связями.
(предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой одинарными σ(сигма) связями.
Предельные углеводороды
Слайд 5 +6 С 1s² 2s¹ 2p³
2s
2р
Когда атомы углерода взаимодействуют
с атомами
водорода происходить возбуждение
2S
Слайд 8Четыре sp3-гибридные орбитали симметрично ориентированны
в пространстве под углом 109°28'
109°28'
Слайд 10Строение метана
Тип гибридизации sp3.
Валентный угол1090 28/,
Расстояние между атомами С-С
0,154 нм
Связь одинарная
σ- связь
Форма молекулы тетраэдр
Связь одинарная
σ- связь
Форма молекулы тетраэдр
Слайд 12Предельные углеводороды образуют гомологический ряд.
ГОМОЛОГИ – это вещества со схожими строением
и свойствами,
но различающиеся по составу
на одну или несколько
групп –CH₂ – (гомологическая разность).
но различающиеся по составу
на одну или несколько
групп –CH₂ – (гомологическая разность).
Слайд 16Номенклатура
1.Выбирают в формуле наиболее длинную углеводородную цепь и нумеруют атомы углерода
с той стороны, к которому ближе разветвление.
А) Если разветвление начинается при атомах углерода равноудаленных от концов главной цепи, нумерацию ведут с той стороны, к которой ближе радикал, имеющий более простое строение.
Б) Если одинаковые радикалы равноудалены, нумерацию ведут с той стороны, где ближе следующий радикал.
В) Если несколько равноудаленных радикалов, то нумерацию ведут с той стороны, где их больше.
А) Если разветвление начинается при атомах углерода равноудаленных от концов главной цепи, нумерацию ведут с той стороны, к которой ближе радикал, имеющий более простое строение.
Б) Если одинаковые радикалы равноудалены, нумерацию ведут с той стороны, где ближе следующий радикал.
В) Если несколько равноудаленных радикалов, то нумерацию ведут с той стороны, где их больше.
Слайд 182. Называют номер углеродного атома, с которым связан радикал, начиная с
простейшего.
А) Если замещающих групп несколько, цифрами отмечают каждую из них.
Б) Если содержится несколько одинаковых радикалов, то перед их названием указывают число прописью:
ди - 2, три - 3, тетра - 4.
В) заместители (хлор, бром, амино- ) располагают в алфавитном порядке.
3. Называют радикалы в алфавитном порядке и углеводород, которому соответствует длинная цепь.
А) Если замещающих групп несколько, цифрами отмечают каждую из них.
Б) Если содержится несколько одинаковых радикалов, то перед их названием указывают число прописью:
ди - 2, три - 3, тетра - 4.
В) заместители (хлор, бром, амино- ) располагают в алфавитном порядке.
3. Называют радикалы в алфавитном порядке и углеводород, которому соответствует длинная цепь.
Слайд 191) СН3–СН–СН–СН2 –СН–СН3
2) СН3–СН2–СН–СН2–СН3
| | | |
СН3 СН3 СН3 СН3
3) СН3–СН2–СН2–СН–СН2–СН2–СН3 4) СН3–СН–СН2–СН3
| |
С2Н5 СН3 СН3
|
5) СН3–СН2–СН–СН2–СН2–СН3 6) СН3–СН2–СН–С–СН3
| | |
СН3 С2Н5 СН3
| | | |
СН3 СН3 СН3 СН3
3) СН3–СН2–СН2–СН–СН2–СН2–СН3 4) СН3–СН–СН2–СН3
| |
С2Н5 СН3 СН3
|
5) СН3–СН2–СН–СН2–СН2–СН3 6) СН3–СН2–СН–С–СН3
| | |
СН3 С2Н5 СН3
Назвать вещества
Слайд 20Нахождение в природе:
Природный газ на 75%-85% состоит из метана, от 25%-2%
этана, пропана и других соединений.
Нефть и ископаемый уголь (содержат не чистые углеводороды)
Месторождения угля (бурого), нефти, газа на Дальнем Востоке
Нефть и ископаемый уголь (содержат не чистые углеводороды)
Месторождения угля (бурого), нефти, газа на Дальнем Востоке
Слайд 21Физические свойства
С 1 – С4 – газ без цвета и
запаха
С 5 – С 17 – бесцветные жидкости с запахом бензина
С 18 … -твердые вещества, белого цвета, жирные на ощупь
По мере увеличения числа атомов углерода в цепи возрастает температура кипения, плавления и плотность
Молекулы с разветвленным скелетом кипят и плавятся при более низкой температуре, чем молекулы с нормальным строением
Газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом
Алканы практически не растворимы в воде, но растворяются в неполярных органических растворителях (бензол,тетрахлорметан)
Жидкие и твердые алканы смешиваются друг с другом
С 5 – С 17 – бесцветные жидкости с запахом бензина
С 18 … -твердые вещества, белого цвета, жирные на ощупь
По мере увеличения числа атомов углерода в цепи возрастает температура кипения, плавления и плотность
Молекулы с разветвленным скелетом кипят и плавятся при более низкой температуре, чем молекулы с нормальным строением
Газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом
Алканы практически не растворимы в воде, но растворяются в неполярных органических растворителях (бензол,тетрахлорметан)
Жидкие и твердые алканы смешиваются друг с другом
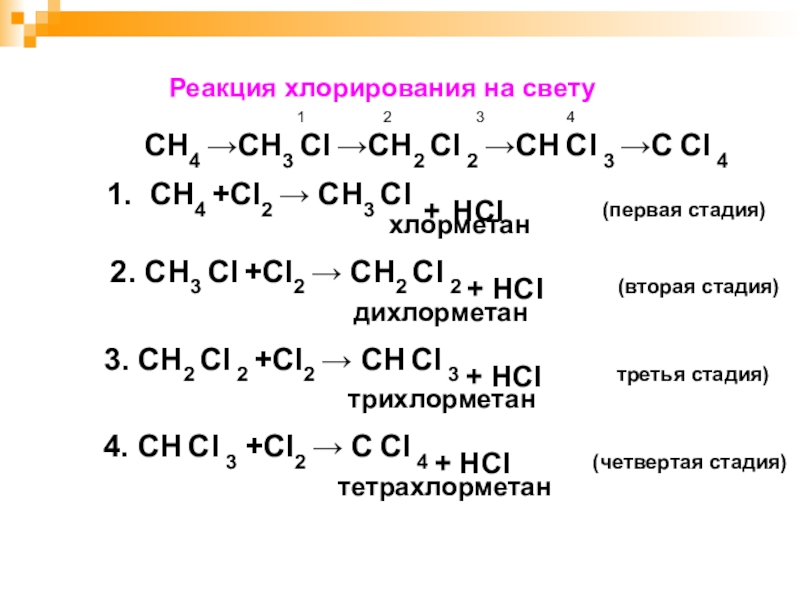
Слайд 23 Реакция хлорирования на свету
1
2 3 4
СН4 →СН3 Сl →СН2 Сl 2 →СН Сl 3 →С Сl 4
1. СН4 +Cl2 → СН3 Сl + HCl (первая стадия) хлорметан
2. СН3 Сl +Cl2 → СН2 Сl 2 + HCl (вторая стадия)
дихлорметан
3. СН2 Сl 2 +Cl2 → СН Сl 3 + HCl третья стадия)
трихлорметан
4. СН Сl 3 +Cl2 → С Сl 4 + HCl (четвертая стадия)
тетрахлорметан
СН4 →СН3 Сl →СН2 Сl 2 →СН Сl 3 →С Сl 4
1. СН4 +Cl2 → СН3 Сl + HCl (первая стадия) хлорметан
2. СН3 Сl +Cl2 → СН2 Сl 2 + HCl (вторая стадия)
дихлорметан
3. СН2 Сl 2 +Cl2 → СН Сl 3 + HCl третья стадия)
трихлорметан
4. СН Сl 3 +Cl2 → С Сl 4 + HCl (четвертая стадия)
тетрахлорметан