- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Поляризация химических связей
Содержание
- 1. Презентация по химии на тему Поляризация химических связей
- 2. Тип и свойства химической связи определяются электроотрицательностью элементов!
- 3. увеличение ОЭО
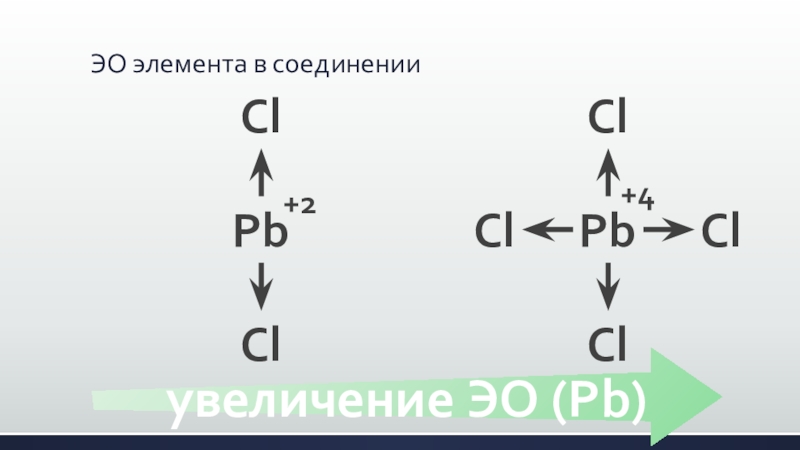
- 4. ЭО элемента – величина не постоянная! Она возрастает с увеличением положительной степени окисления.
- 5. ЭО элемента в соединенииPbClCl+2PbClCl+4ClClувеличение ЭО (Pb)
- 6. ЭО элемента в соединенииC-1CHувеличение ЭО (C)H-1C-2CH-2HHHC-3CH-3HHHHH
- 7. Электроны ковалентной связи могут смещаться под действием
- 8. Связь в СО2 полярная! А полярна ли
- 9. ЛАЙФХАКПолярность молекул - это несимметричное распределение электронной плотности,
- 10. Связь в SО2 полярная! И на первый
- 11. Распредели молекулы на полярные и неполярные:CH4NCl3H2H2OCH3ClCCl4PCl3SF6SF4IF5COCl2C6H6
- 12. Распредели молекулы на полярные и неполярные:CH4NCl3H2H2OCH3ClCCl4PCl3SF6SF4IF5COCl2C6H6ПОЛЯРНЫЕ МОЛЕКУЛЫНЕПОЛЯРНЫЕ МОЛЕКУЛЫ
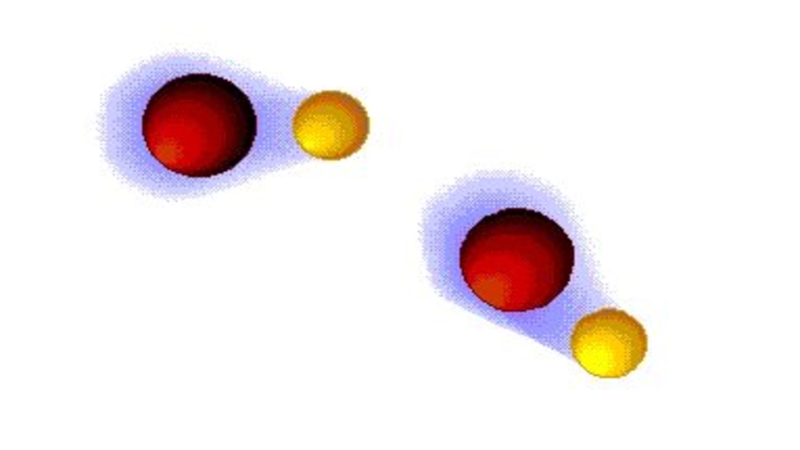
- 13. Между полярными молекулами может возникать притяжение, частный
- 14. Слайд 14
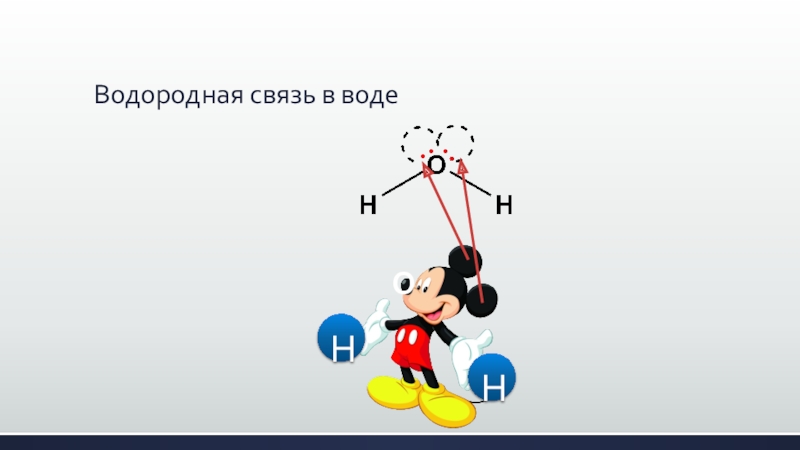
- 15. Водородная связь в водеHHO
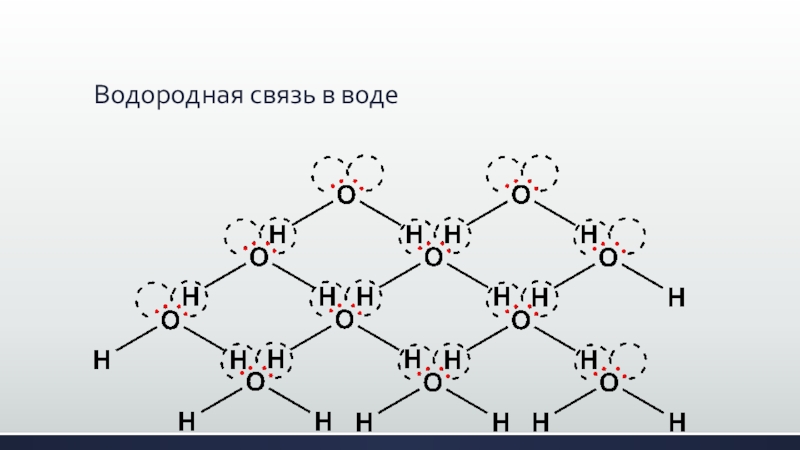
- 16. Водородная связь в воде
- 17. Водородная связь между Микки Маусами
- 18. Водородная связь в воде
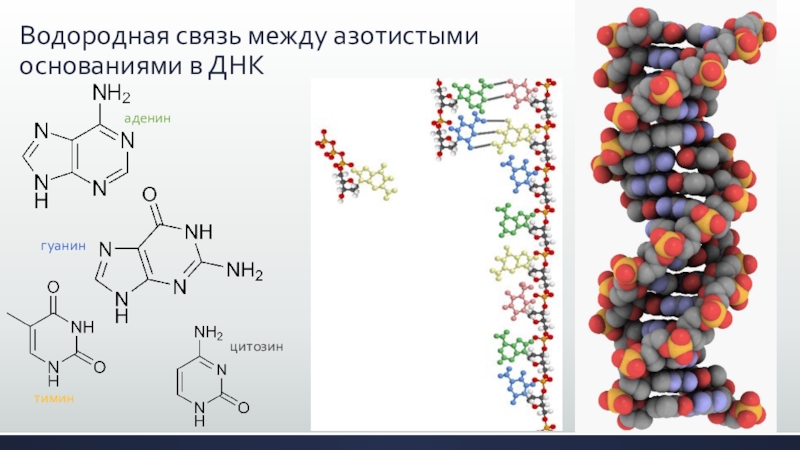
- 19. Водородная связь между азотистыми основаниями в ДНКаденингуанинтиминцитозин
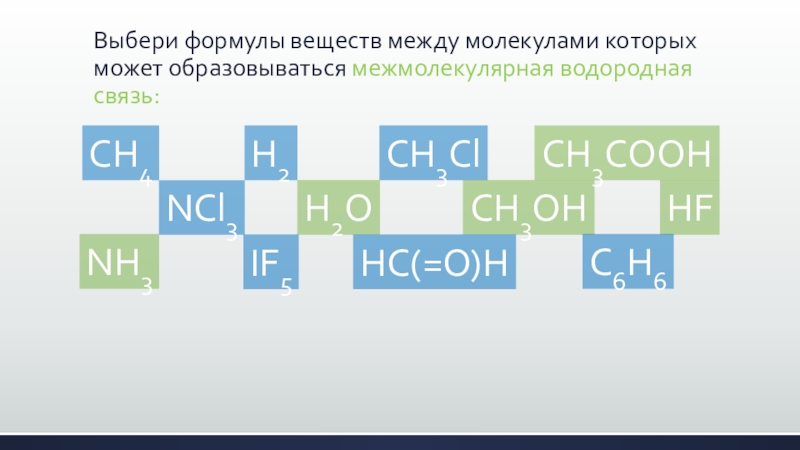
- 20. Выбери формулы веществ между молекулами которых может образовываться межмолекулярная водородная связь:CH4NCl3H2H2OCH3ClCH3OHCH3COOHHFNH3IF5HC(=O)HC6H6
- 21. Выбери формулы веществ между молекулами которых может образовываться межмолекулярная водородная связь:CH4NCl3H2H2OCH3ClCH3OHCH3COOHHFNH3IF5HC(=O)HC6H6
- 22. Образование ковалентной связи может происходить двумя путями (механизмами): 1. обменный 2. донорно-акцепторный
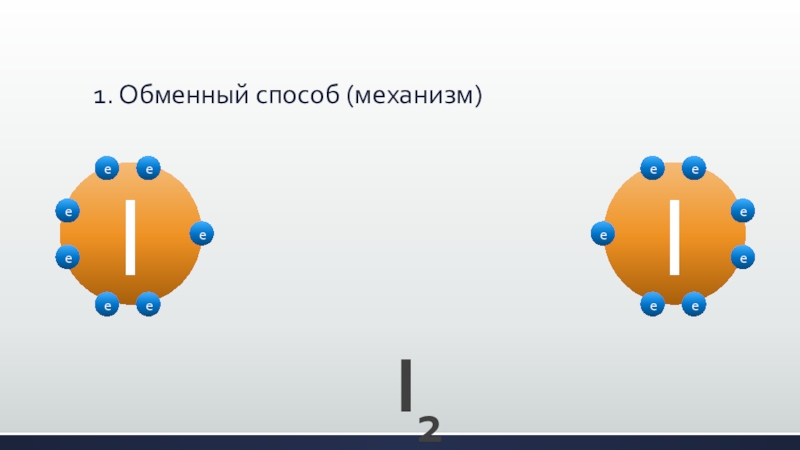
- 23. 1. Обменный способ (механизм)IIeeeeeeeeeeeeeeI2
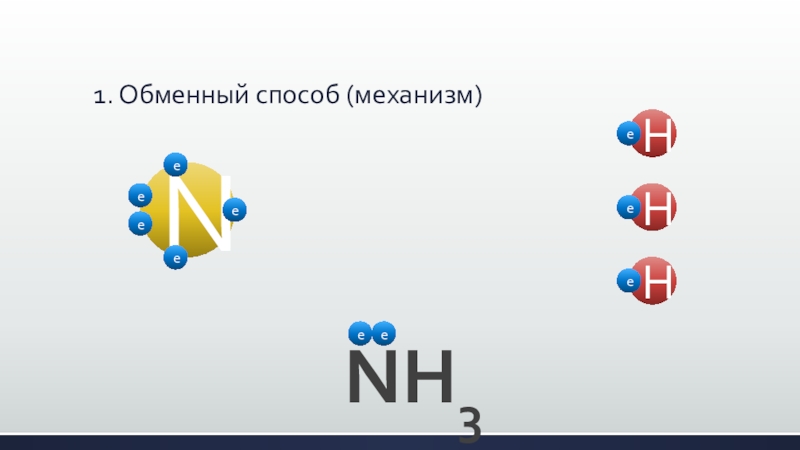
- 24. 1. Обменный способ (механизм)NH3NHHHeeeeeeeeee
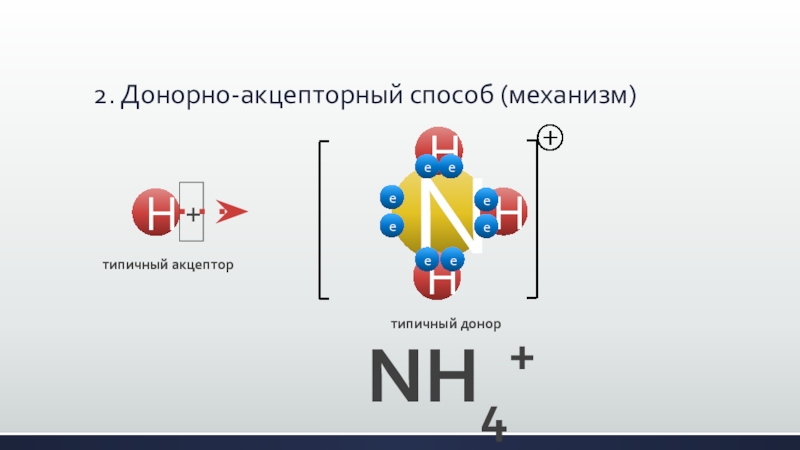
- 25. 2. Донорно-акцепторный способ (механизм)NH4+NHHHeeeeeeeeтипичный донорH+типичный акцептор
- 26. Донорно-акцепторная связь – это не какая-то другая
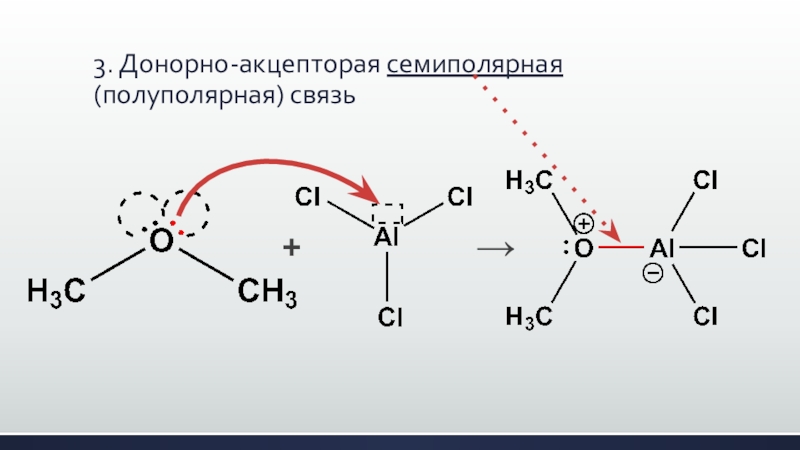
- 27. 3. Донорно-акцепторая семиполярная (полуполярная) связь+→
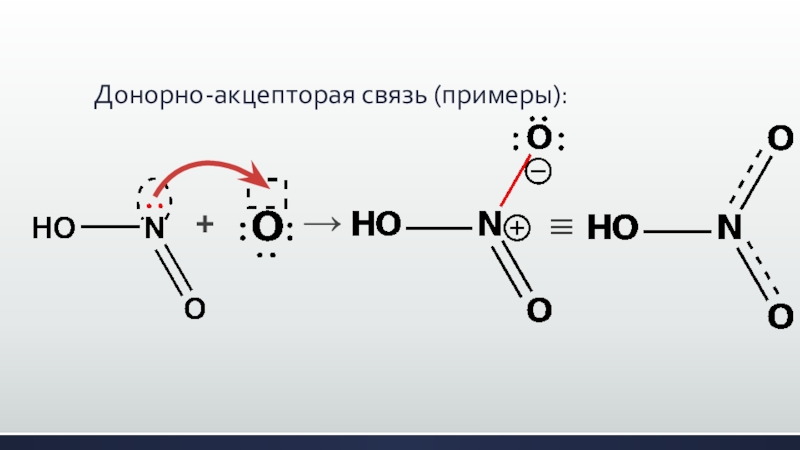
- 28. Донорно-акцепторая связь (примеры):+→≡
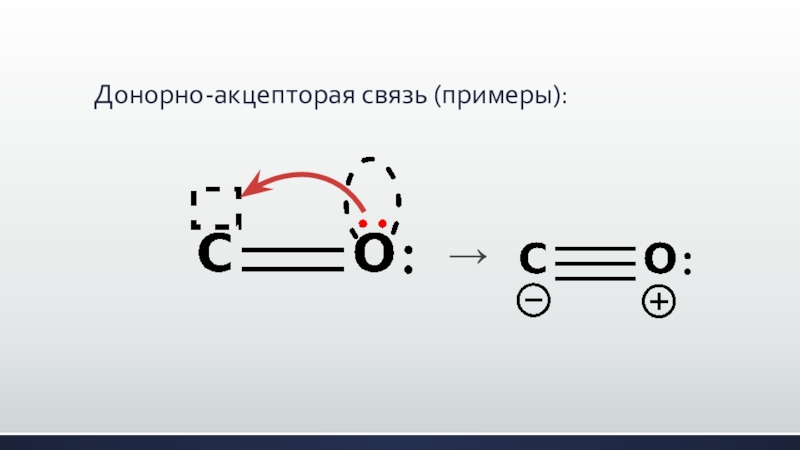
- 29. Донорно-акцепторая связь (примеры):→
- 30. Резонансные структуры
- 31. Слайд 31
Тип и свойства химической связи определяются электроотрицательностью элементов!
Слайд 4ЭО элемента – величина не постоянная!
Она возрастает с увеличением положительной
степени окисления.
Слайд 7Электроны ковалентной связи могут смещаться под действием другой частицы, либо под
влиянием других связей той же молекулы, тогда говорят, что связь ПОЛЯРИЗУЕТСЯ.
Слайд 8Связь в СО2 полярная! А полярна ли молекула?!
НЕПОЛЯРНА!
Молекула СО2 линейна, связи
С=О ковалентные полярные (сигма и пи), но молекула в целом неполярна, поскольку обе эти связи компенсируют друг друга (симметричны!).
sp
Слайд 9ЛАЙФХАК
Полярность молекул - это несимметричное распределение электронной плотности, возникающее из-за различной электроотрицательности
элементов, входящих в состав молекулы.
Прежде всего посмотрите на формулу молекулы. Легко можно понять, что если она образована атомами одного и того же элемента (например, N2, O2, Cl2), то она неполярна, поскольку электроотрицательность одинаковых атомов также одинакова. Поэтому смещения электронной плотности к одному из них в данном случае быть не может.
Если же молекулы состоят из разных атомов, то тут необходимо представить ее структурную форму. Она может быть как симметричной, так и несимметричной.
В том случае, если молекула симметрична (например, СО2, СН4, BF3 и т.п.), молекула является неполярной; если же она несимметрична (из-за наличия неспаренных электронов или неподеленных пар электронов), то такая молекула полярная. Характерные примеры – H2O, NH3, SO2.
Прежде всего посмотрите на формулу молекулы. Легко можно понять, что если она образована атомами одного и того же элемента (например, N2, O2, Cl2), то она неполярна, поскольку электроотрицательность одинаковых атомов также одинакова. Поэтому смещения электронной плотности к одному из них в данном случае быть не может.
Если же молекулы состоят из разных атомов, то тут необходимо представить ее структурную форму. Она может быть как симметричной, так и несимметричной.
В том случае, если молекула симметрична (например, СО2, СН4, BF3 и т.п.), молекула является неполярной; если же она несимметрична (из-за наличия неспаренных электронов или неподеленных пар электронов), то такая молекула полярная. Характерные примеры – H2O, NH3, SO2.
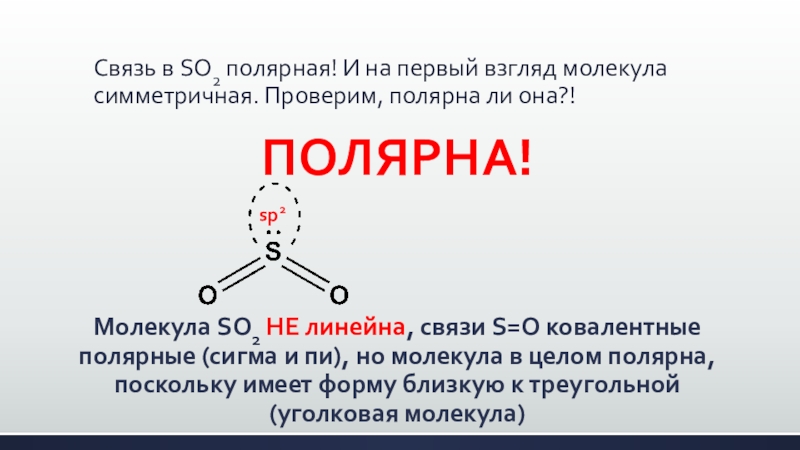
Слайд 10Связь в SО2 полярная! И на первый взгляд молекула симметричная. Проверим,
полярна ли она?!
ПОЛЯРНА!
Молекула SО2 НЕ линейна, связи S=О ковалентные полярные (сигма и пи), но молекула в целом полярна, поскольку имеет форму близкую к треугольной (уголковая молекула)
sp2
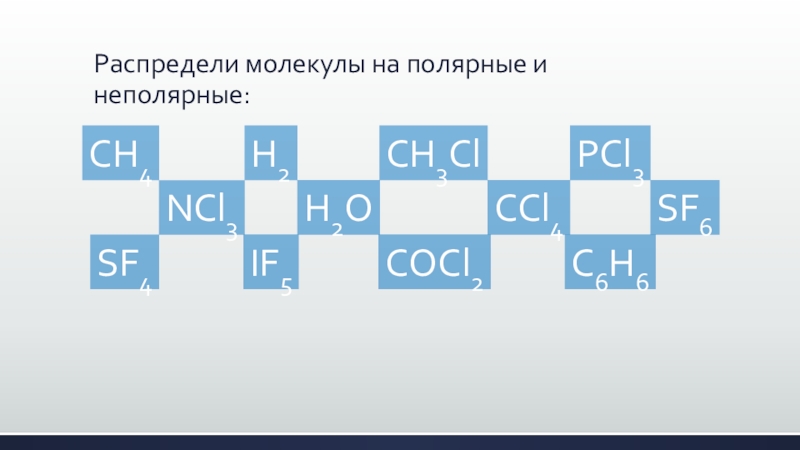
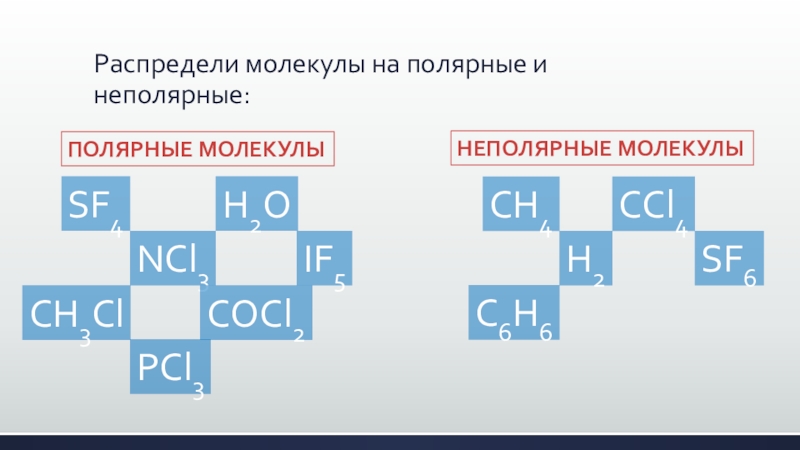
Слайд 12Распредели молекулы на полярные и неполярные:
CH4
NCl3
H2
H2O
CH3Cl
CCl4
PCl3
SF6
SF4
IF5
COCl2
C6H6
ПОЛЯРНЫЕ МОЛЕКУЛЫ
НЕПОЛЯРНЫЕ МОЛЕКУЛЫ
Слайд 13Между полярными молекулами может возникать притяжение, частный случай такого притяжения –
водородная связь (иногда реализуется внутри молекулы)!
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать F, O, N или S.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать F, O, N или S.
Слайд 20Выбери формулы веществ между молекулами которых может образовываться межмолекулярная водородная связь:
CH4
NCl3
H2
H2O
CH3Cl
CH3OH
CH3COOH
HF
NH3
IF5
HC(=O)H
C6H6
Слайд 21Выбери формулы веществ между молекулами которых может образовываться межмолекулярная водородная связь:
CH4
NCl3
H2
H2O
CH3Cl
CH3OH
CH3COOH
HF
NH3
IF5
HC(=O)H
C6H6
Слайд 22Образование ковалентной связи может происходить двумя путями (механизмами):
1. обменный
2. донорно-акцепторный
Слайд 26Донорно-акцепторная связь – это не какая-то другая связь, а та же
самая ковалентная полярная, отличающаяся лишь способом образования!
Такой способ может иметь разновидность –
3. семиполярную связь.