прилагать знания на деле…
Аристотель
Автор: Никитина Наталья Евгеньевна, учитель химии МБОУ СОШ № 1
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Получение кислорода
Содержание
- 1. Презентация по химии на тему Получение кислорода
- 2. Цель урокаИзучить историю открытия кислородаРассмотреть способы получения кислородаПознакомиться с понятием «катализатор»
- 3. Нахождение кислорода в природеКислород – это вещество, вокруг которого вращается земная химия (Я.Берцелиус)
- 4. Он повсюду и везде:
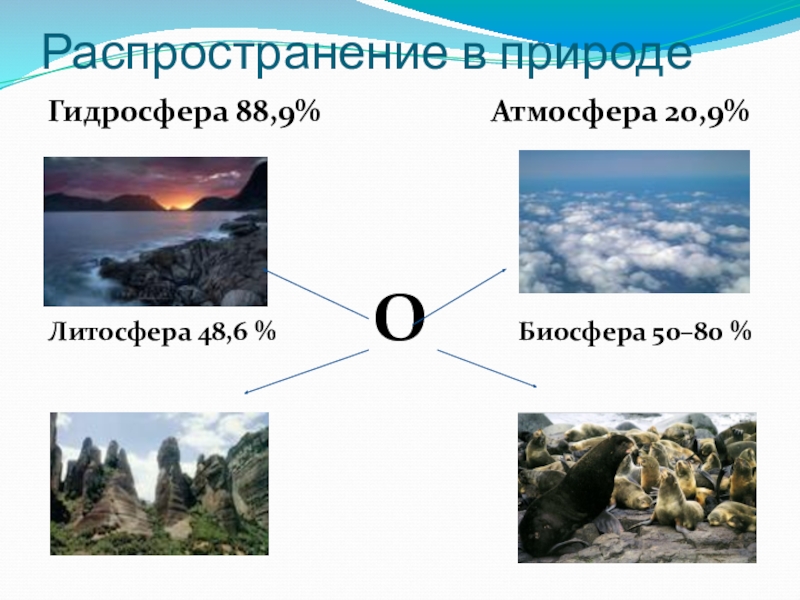
- 5. Распространение в природеГидросфера 88,9%
- 6. 2HgO → 2Hg + O2Открытие кислорода присваивается
- 7. Джозеф Пристли (английский ученый) в 1774 году
- 8. Карл Вильгельм Шееле (шведский химик) в 1772
- 9. Антуан Лавуазье в 1774 году провел эксперимент
- 10. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА В промышленности кислород получают
- 11. В лаборатории кислород получают из кислородсодержащих
- 12. б) разложение хлората калия2KClO3 =
- 13. Лабораторный опытЦель: получить кислород из раствора
- 14. Этапы эксперимента:Возьмите пробирку с черным порошком
- 15. Составь слово
- 16. Домашнее заданиеПараграф 19 Упражнение 2, 3 устноСоставить кроссворд, где ключевое слово будет слово кислород.
Цель урокаИзучить историю открытия кислородаРассмотреть способы получения кислородаПознакомиться с понятием «катализатор»
Слайд 2Цель урока
Изучить историю открытия кислорода
Рассмотреть способы получения кислорода
Познакомиться с понятием «катализатор»
Слайд 3Нахождение кислорода в природе
Кислород – это вещество, вокруг которого вращается земная
химия (Я.Берцелиус)
Слайд 6
2HgO → 2Hg + O2
Открытие кислорода присваивается Джозефу Пристли.
А история простая…
Джозеф
Пристли как-то раз
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нём свеча горит.
Новый газ из колбы вышел – никому он не знаком.
Этим газом дышат мыши под стеклянным колпаком,
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части»
Эта мысль весьма нова
Здесь у химика от счастья
Закружилась голова
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нём свеча горит.
Новый газ из колбы вышел – никому он не знаком.
Этим газом дышат мыши под стеклянным колпаком,
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части»
Эта мысль весьма нова
Здесь у химика от счастья
Закружилась голова
Слайд 7Джозеф Пристли
(английский ученый) в 1774 году разложением оксида ртути (II)
открыл кислород и изучил его свойства.
2 HgO = 2 Hg + O2
Слайд 8Карл Вильгельм Шееле (шведский химик) в 1772 году получил и детально
исследовал «огненный воздух», в котором горит свеча.
2 KNO3 = 2 KNO2 + O2
Слайд 9Антуан Лавуазье в 1774 году провел эксперимент и доказал, что воздух
состоит на 1/5 часть из кислорода и 4/5 части азота. Дал название кислороду.
Слайд 10СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА
В промышленности кислород получают из воздуха. Воздух
представляет собой смесь различных газов, основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196°С) ниже температуры кипения жидкого кислорода (-183°C), то азот испаряется раньше кислорода. Жидкий кислород отделяют от испарившегося азота и хранят в стальных баллонах под давлением 15 МПа.
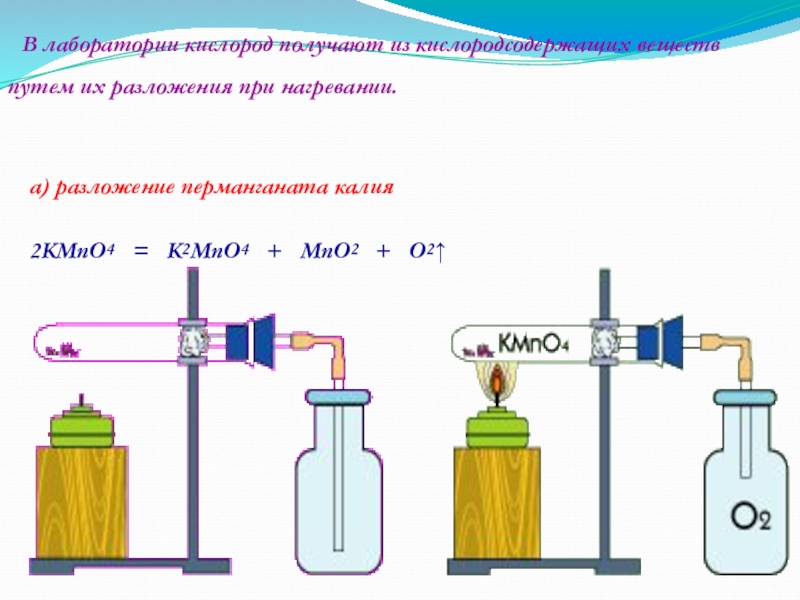
Слайд 11 В лаборатории кислород получают из кислородсодержащих веществ путем их разложения
при нагревании.
а) разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2↑
Слайд 12б) разложение хлората калия
2KClO3 = 2KCl +
3O2↑
в) разложение пероксида водорода
2H2O2 = 2H2O + O2↑
г) электролиз воды
2H2O = 2H2↑ + O2↑
в) разложение пероксида водорода
2H2O2 = 2H2O + O2↑
г) электролиз воды
2H2O = 2H2↑ + O2↑
Kt = MnO2
Слайд 13 Лабораторный опыт
Цель: получить кислород из раствора перекиси водорода, используя в
качестве катализатора оксид марганца (IV), и распознать его.
Оборудование: штатив, пробирки, спиртовка, спички, лучина.
Реактивы: перекись водорода Н2О2, оксид марганца (IV) MnO2
Оборудование: штатив, пробирки, спиртовка, спички, лучина.
Реактивы: перекись водорода Н2О2, оксид марганца (IV) MnO2
Слайд 14
Этапы эксперимента:
Возьмите пробирку с черным порошком оксида марганца (IV) добавьте
пероксид водорода. Что наблюдаете?
Зажгите лучину, дождитесь пока на ее конце не появится тлеющий уголек и потушите её.
Медленно внесите тлеющую лучину в пробирку с предполагаемым кислородом. Что наблюдаете?
Составьте уравнение проделанной реакции.
Напишите вывод.
Зажгите лучину, дождитесь пока на ее конце не появится тлеющий уголек и потушите её.
Медленно внесите тлеющую лучину в пробирку с предполагаемым кислородом. Что наблюдаете?
Составьте уравнение проделанной реакции.
Напишите вывод.
Слайд 15Составь слово
Первая буква слова ответа
1. Химический элемент, имеющий относительную массу 16?
2. Назовите имя Лавуазье?
3.Какой физический параметр необходим для разложения КМnО4?
4.Как называются частицы, образующие молекулу кислорода?
5.Где можно получить кислород, кроме промышленности?
6. Как называется газ, не поддерживающий горения, по теории существовавшей до открытия кислорода?
7. Какое физическое свойство имеет озон, но это же свойство не имеет кислород?
8. Какого газа больше в атмосфере, чем кислород?
9. Какую лучину используют для определения кислорода?
10. Как на латинском языке называется кислород?
11. Какой тип реакции необходим для получения кислорода из бертолетовой соли, перманганата калия и др.?
1. Химический элемент, имеющий относительную массу 16?
2. Назовите имя Лавуазье?
3.Какой физический параметр необходим для разложения КМnО4?
4.Как называются частицы, образующие молекулу кислорода?
5.Где можно получить кислород, кроме промышленности?
6. Как называется газ, не поддерживающий горения, по теории существовавшей до открытия кислорода?
7. Какое физическое свойство имеет озон, но это же свойство не имеет кислород?
8. Какого газа больше в атмосфере, чем кислород?
9. Какую лучину используют для определения кислорода?
10. Как на латинском языке называется кислород?
11. Какой тип реакции необходим для получения кислорода из бертолетовой соли, перманганата калия и др.?
Слайд 16Домашнее задание
Параграф 19
Упражнение 2, 3 устно
Составить кроссворд, где ключевое
слово будет слово кислород.