Мухина Ирина Валентиновна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Подгруппа кислорода
Содержание
- 1. Презентация по химии на тему Подгруппа кислорода
- 2. Положение в Периодической системе химических элементов
- 3. Изменение свойств в группе.От O к Te:
- 4. Соединения: с водородомОбщая формула H2R-2H2O – вода
- 5. Соединения: с кислородомОксиды R+4O2SO2 оксид серы(IV)SeO2 -
- 6. Соединения: с кислородомОксиды R+6O3SO3 оксид серы(VI)SeO3
- 7. Сера16S32 16p, 16n, 16ēVI группа главная подгруппа,
- 8. Нахождение в природеВ свободном виде.Входит в состав
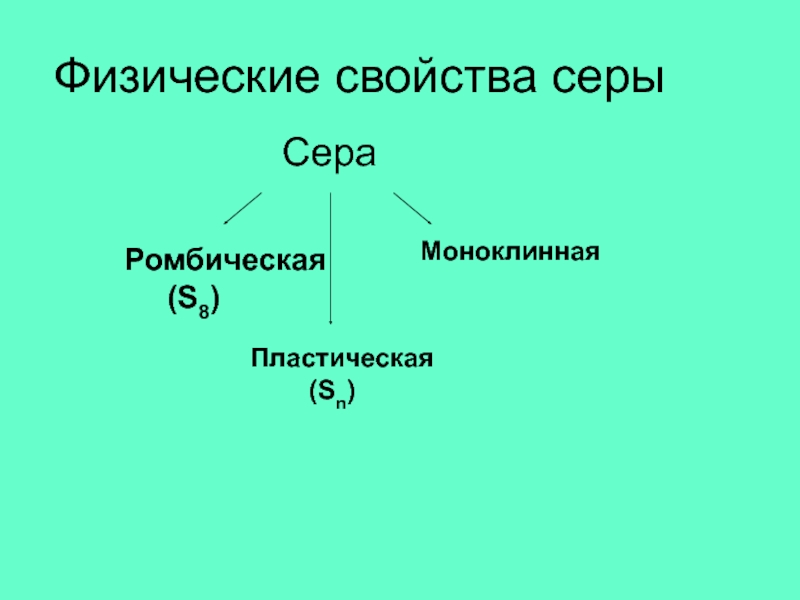
- 9. Физические свойства серыРомбическая (S8)Моноклинная Пластическая (Sn)
- 10. Химические свойства серы (окислительные)Взаимодействует с металлами при
- 11. Химические свойства серы (восстановительные)С кислородом, хлором и
- 12. Взаимодействие со сложными веществамиВ воде сера не
Слайд 1Подгруппа кислорода.
халькогены.
МБОУ «Гимназия № 6 имени академика-кораблестроителя А.Н. Крылова»
города Алатыря
Слайд 2 Положение в Периодической системе химических элементов и строение атомов.
O, S,
На внешнем энергетическом уровне 6 ē
До заполнения внешнего энергетического уровня не хватает 2 ē → степень окисления - -2 (низшая степень окисления)
Могут отдать 6 ē с внешнего энергетического уровня → степень окисления - +6 (высшая степень окисления)
Возможные степени окисления -2, 0, +4, +6
Кислород проявляет следующие степени окисления - -2, -1 (в пероксидах – H2O2), в соединениях с фтором - +1, +2.
Слайд 3Изменение свойств в группе.
От O к Te: заряд ядра ↑,
число
число ē на внешнем энергетическом уровне постоянно,
радиусы атомов ↑ =>
неметаллические свойства (и окислительные) ослабевают, а металлические (и восстановительные) усиливаются
Слайд 4Соединения: с водородом
Общая формула H2R-2
H2O – вода
H2S– сероводород
H2Se – селеноводород
H2Te
Ядовитые газы с неприятным запахом
Водные растворы проявляют кислотные свойства
От H2S к H2Te: кислотные свойства растворов усиливаются
восстановительные свойства соединений усиливаются
стабильность соединений уменьшается
Слайд 5Соединения: с кислородом
Оксиды R+4O2
SO2 оксид серы(IV)
SeO2 -
оксид селена (IV)
TeO2
Кислотные оксиды
Кислоты H2R+4O3
H2SO3 – сернистая кислота
H2SeO3 – селенистая кислота
H2TeO3 – теллуристая кислота
Все – слабые электролиты
От H2SO3 к H2TeO3 3 сила кислот убывает
Проявляют и окислительные, и восстановительные свойства
Слайд 6Соединения: с кислородом
Оксиды R+6O3
SO3 оксид серы(VI)
SeO3 - _
TeO3 - оксид теллура (VI)
Кислотные оксиды
Кислоты H2R+6O4
H2SO4 – серная кислота
H2SeO4 – селеновая кислота
H2TeO4 – теллуровая кислота
H2SO4 – сильный электролит
От H2SO4 к H2TeO4 сила кислот убывает
Проявляют только окислительные свойства.
Слайд 7Сера
16S32 16p, 16n, 16ē
VI группа главная подгруппа, 3 период
3
На внешнем энергетическом уровне 6ē
+16
2ē
8ē
Степени окисления - -2, 0, +4, +6
H2S S SO2 SO3
6ē
Слайд 8Нахождение в природе
В свободном виде.
Входит в состав минералов: пирит (серный колчедан),
Входит в состав нефти, каменного угля.
Входит в состав белков.
Слайд 10Химические свойства серы
(окислительные)
Взаимодействует с металлами при нагревании, образуя сульфиды:
С углеродом,
Mg + S → MgS2-
сульфид магния
C+ 2S → CS22-
2P + 3S → P2S32-
H2 + S → H2S2-
Слайд 11Химические свойства серы
(восстановительные)
С кислородом, хлором и фтором сера проявляет восстановительные свойства:
S
Оксид серы (VI)
S+ Cl2 → SCl2
хлорид серы (II)
S + 3F2 → SF6
фторид серы (VI)
+4
+2
+6
Слайд 12Взаимодействие со сложными веществами
В воде сера не растворяется
Как восстановитель сера взаимодействует
S + 2H2SO4 → 3SO2 + 2H2O
S + 2HNO3(разб) → H2SO4 + 2NO
S + 6HNO3(конц) → H2SO4 + 6NO2 + 2H2O
Как восстановитель и окислитель сера взаимодействует со щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S+ 3H2O