- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
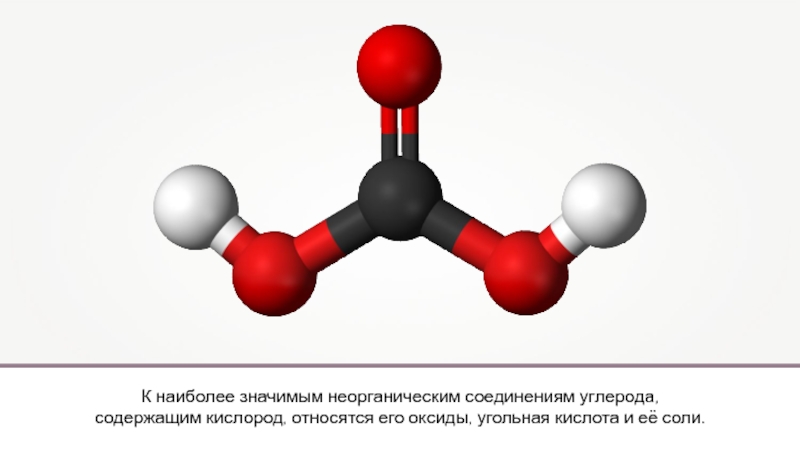
Презентация, доклад на тему 34. Кислородные соединения углерода
Содержание
- 1. 34. Кислородные соединения углерода
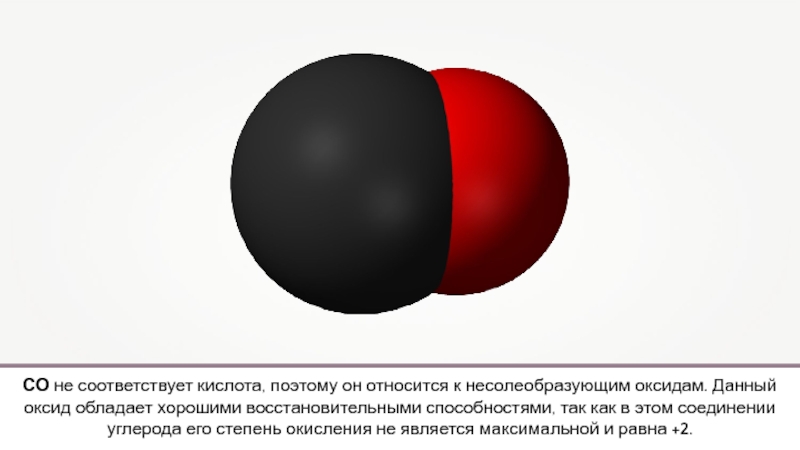
- 2. CO
- 3. Попадая при дыхании в организм человека, угарный
- 4. Угарный газ образуется при неполном сгорании топлива
- 5. Слайд 5
- 6. Слайд 6
- 7. СО взаимодействует с кислородом:2СО + О2 =
- 8. Слайд 8
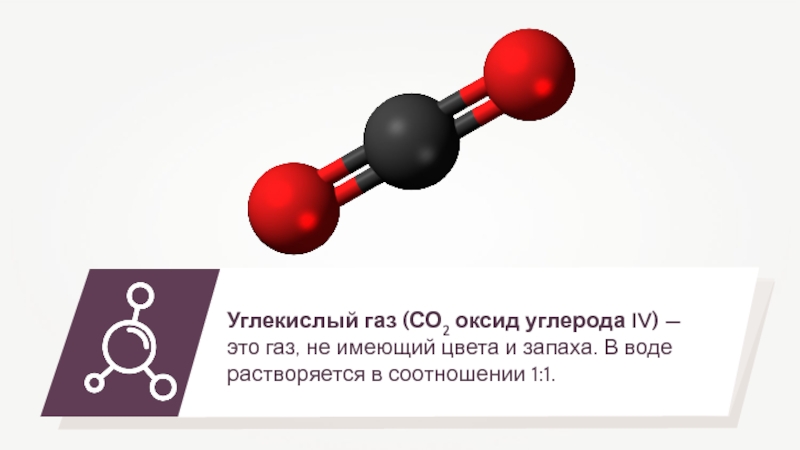
- 9. Из углекислого газа делают «сухой лёд», который используют для хранения пищевых продуктов.
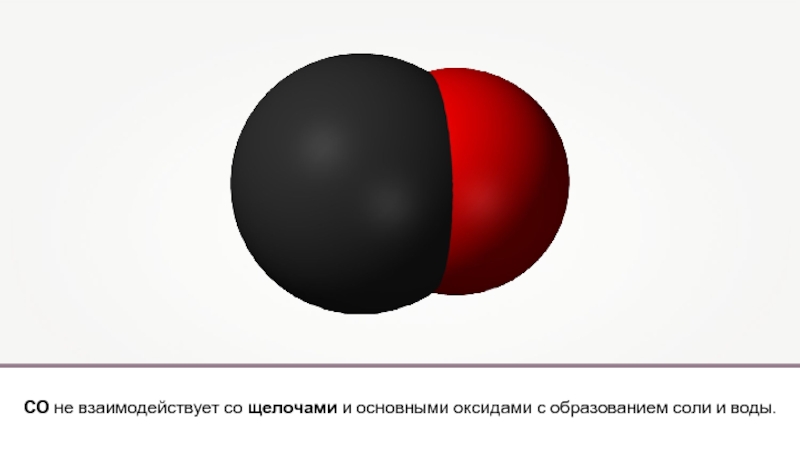
- 10. СО2 является солеобразующим оксидом. Углекислый газ обладает
- 11. Углекислый газ не поддерживает процессы дыхания и
- 12. Получение СО22HCl + CaCO3 = CaCl2 + H2O + CO2↑Лабораторный способ:СаСО3 = СаО + СО2↑Промышленный способ:
- 13. Углекислый газ используют для производства газированных напитков, а также для получения соды.
- 14. При растворении СО2 в воде образуется слабая
- 15. Карбонаты и гидрокарбонаты способны переходить друг в
- 16. Временная жёсткость воды обусловлена наличием в ней
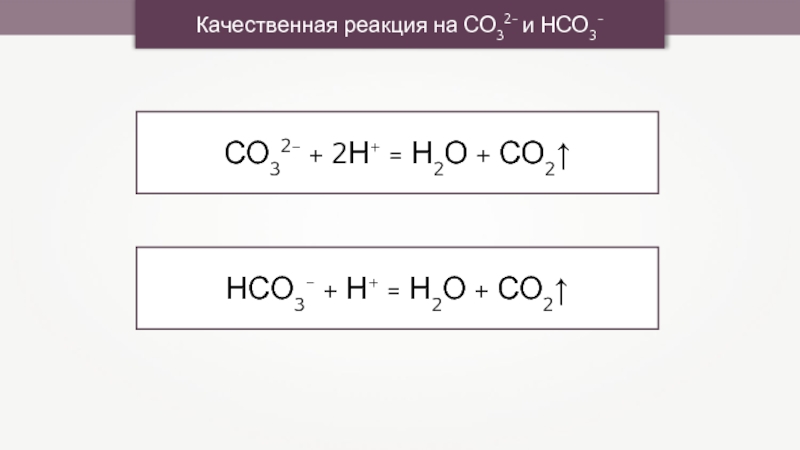
- 17. СО32- + 2Н+ = Н2О + СО2↑Качественная
Слайд 3
Попадая при дыхании в организм человека, угарный газ быстро соединяется с
Слайд 4Угарный газ образуется при неполном сгорании топлива или при недостатке кислорода
2С + О2 = 2СО
Слайд 7СО взаимодействует с кислородом:
2СО + О2 = 2СО2↑
Взаимодействуя с оксидами металлов
Fe2O3 + 3CO = 2Fe + 3CO2↑
Слайд 10
СО2 является солеобразующим оксидом. Углекислый газ обладает свойствами типичными для кислотных
СО2 + 2NaOH = Na2CO3 + H2O
Взаимодействует со щелочами:
СО2 + СаО = СаСО3
Взаимодействует с основными оксидами:
СО2 + Н2О = Н2СО3
Взаимодействует с водой:
Слайд 11Углекислый газ не поддерживает процессы дыхания и горения. По этой причине
В CO2 способен гореть лишь магний, при этом образуются оксид магния и сажа:
СО2 + 2Mg = 2MgO + C
Слайд 12
Получение СО2
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
Лабораторный способ:
СаСО3
Промышленный способ:
Слайд 13Углекислый газ используют для производства газированных напитков,
а также для получения
Слайд 14
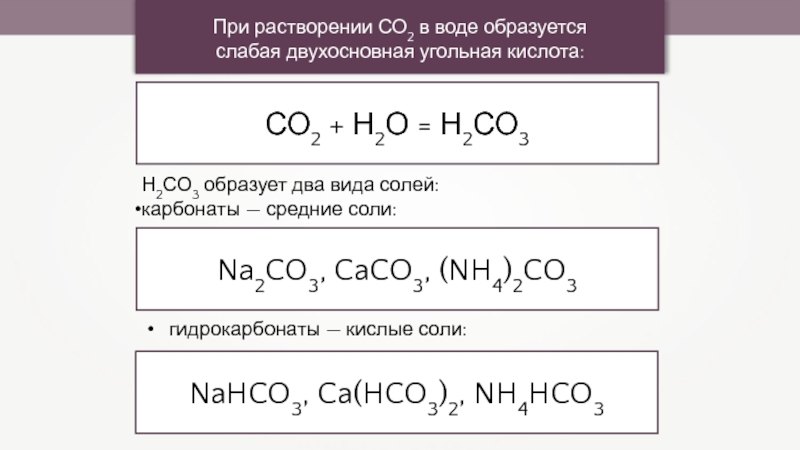
При растворении СО2 в воде образуется
слабая двухосновная угольная кислота:
СО2 +
Na2CO3, CaCO3, (NH4)2CO3
NaHCO3, Ca(HCO3)2, NH4HCO3
гидрокарбонаты — кислые соли:
Н2СО3 образует два вида солей:
карбонаты — средние соли:
Слайд 15
Карбонаты и гидрокарбонаты
способны переходить друг в друга:
СаСО3 + Н2О +
Са(НСО3)2 = СаСО3 + Н2О + СО2
Слайд 16Временная жёсткость воды обусловлена наличием в ней гидрокарбонатов магния и кальция.
Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑
Жёсткость воды
Хлориды и сульфаты кальция и магния обуславливают постоянную жёсткость воды.
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓