Пермского края
Кирьянова Светлана Викторовна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Почему протекают химические реакции, 11 класс
Содержание
- 1. Презентация по химии на тему Почему протекают химические реакции, 11 класс
- 2. Закон сохранения энергии (первый закон термодинамики)
- 3. При химических реакциях разрываются старые
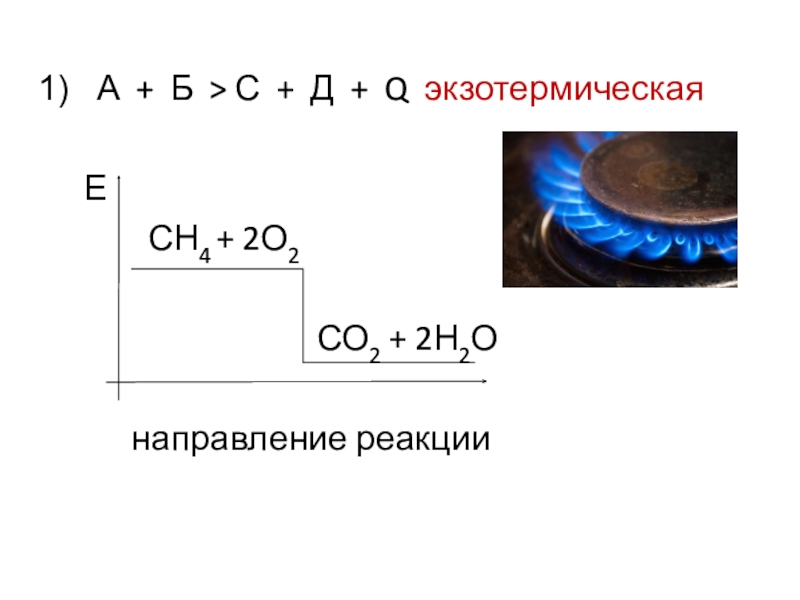
- 4. А + Б > С + Д
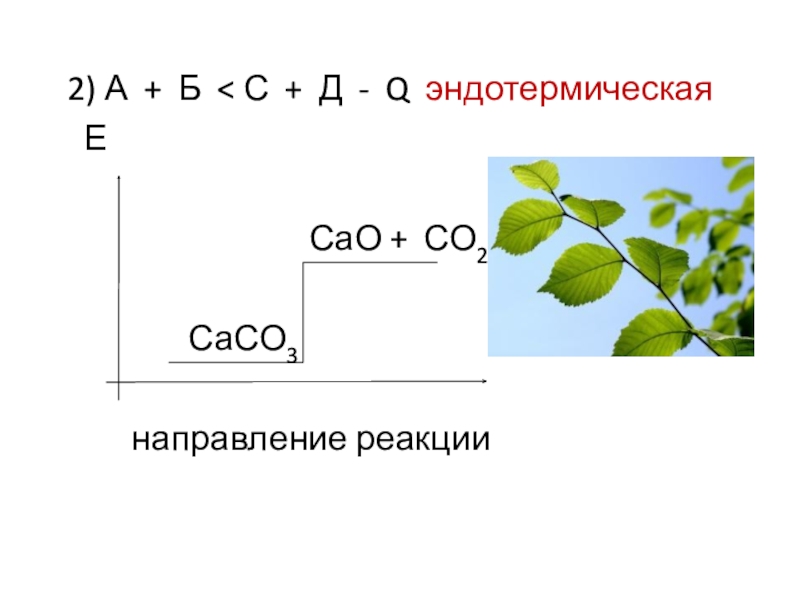
- 5. 2) А + Б < С
- 6. 2Н2 + О2 = 2Н2О + 484
- 7. Закон Гесса (петербургский академик начала 20в.)
- 8. ПримерFe2O3+2Al=2Fe+Al2O3Вычислить Qр, еслиQобр. (Al2O3) =1670кДжQобр. (Fe2O3) =820кДж
Закон сохранения энергии (первый закон термодинамики) Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
Слайд 1Почему идут химические реакции?
Учитель высшей категории МБОУ «Тюшевская СОШ» Октябрьского района
Слайд 2Закон сохранения энергии
(первый закон термодинамики)
Энергия не возникает
из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
Слайд 3 При химических реакциях разрываются старые связи реагентов и образуются
новые химические связи – продуктов.
В химических связях заключена энергия (Е).
А + Б = В + Д
реагенты продукты
В химических связях заключена энергия (Е).
А + Б = В + Д
реагенты продукты
Слайд 62Н2 + О2 = 2Н2О + 484 кДж
термохимическое уравнение
Qр – тепловой эффект реакции – теплота, которая выделяется или поглощается в результате реакции (записывается в уравнении). Для расчёта Qр используют значения величин Qобр. Всех участвующих в реакции соединений.
Qобр. – теплота образования соединения – тепловой эффект реакции образования 1 моля соединения из простых веществ в стандартных условиях (250С, 1 атм.).
Qобр. простых веществ в стандартных условиях равно 0.
Qр – тепловой эффект реакции – теплота, которая выделяется или поглощается в результате реакции (записывается в уравнении). Для расчёта Qр используют значения величин Qобр. Всех участвующих в реакции соединений.
Qобр. – теплота образования соединения – тепловой эффект реакции образования 1 моля соединения из простых веществ в стандартных условиях (250С, 1 атм.).
Qобр. простых веществ в стандартных условиях равно 0.
Слайд 7Закон Гесса
(петербургский академик начала 20в.)
Qр не зависит от
промежуточных стадий (при условии, что исходные вещества и продукты реакции одинаковы).
Qр равен сумме теплот образования всех продуктов реакции минус сумма теплот образования реагентов (с учётом коэффициентов).
Qр равен сумме теплот образования всех продуктов реакции минус сумма теплот образования реагентов (с учётом коэффициентов).
Qр = Σ Qобр. (прод.) - Σ Qобр. (реаг.)