КАТЕГОРИИ
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Относительная атомная и молекулярная массы (8 класс)
Содержание
- 1. Презентация по химии на тему Относительная атомная и молекулярная массы (8 класс)
- 2. Имеют ли вес атомы и как его
- 3. Массы атомов ничтожно малы Масса
- 4. Абсолютная и относительная массаИногда используются не
- 5. Эталон для сравнения атомных массУчёные пытались сопоставить
- 6. Атомная единица массы m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кг
- 7. Относительная атомная масса -АrАr показывает во сколько
- 8. Как определить Аr по таблице Д. И. Менделеева
- 9. Значения относительных атомных масс некоторых химических элементовводород11,00797кислородуглерод15,999412,01115 8 6Аr(Н) =1 Аr(С) =12 Аr(О) =16
- 10. Дробное значение Аrхлор 17 35,454В расчётах используют
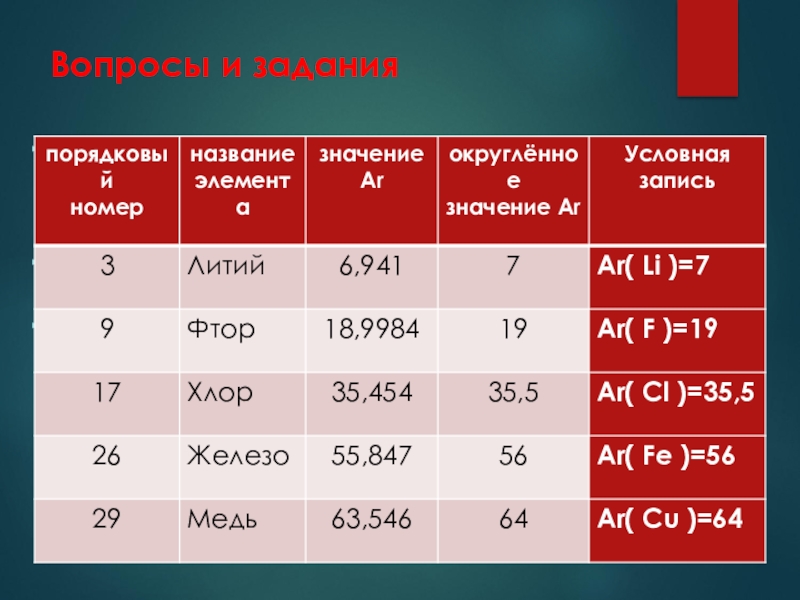
- 11. Вопросы и заданияЧто означают записи:
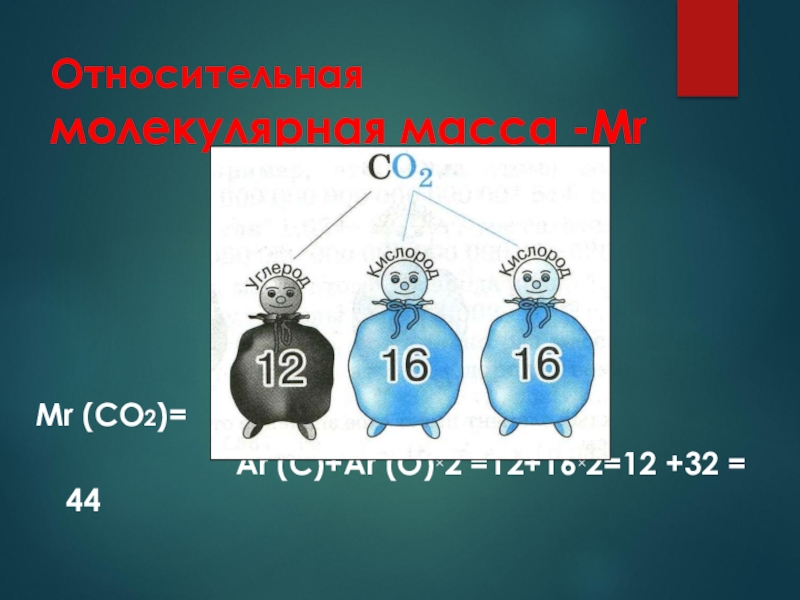
- 12. Относительная молекулярная масса -Мr показывает во сколько
- 13. Относительная молекулярная масса -МrMr (CO2)=
- 14. РассчитайтеМr (H2) =Mr (СаСl2) =Mr (CaCO3) =Мr
- 15. Проверка изученного I вариантМr(SO3) = Mr(NO2)
- 16. Спасибо за работу на уроке !
Имеют ли вес атомы и как его измерить?Джон Дальтон (1766-1844) английский физик и химик , изучая газы в составе воздуха , сделал вывод: «Я считаю , что атомы одного элемента одинаковы между
Слайд 1Относительная атомная и относительная молекулярная масса
АВТОР ПРЕЗЕНТАЦИИ:
ЩЕРБИНА МАРИНА ЯКОВЛЕВНА
УЧИТЕЛЬ ХИМИИ ВЫСШЕЙ
Слайд 2Имеют ли вес атомы и как его измерить?
Джон Дальтон (1766-1844)
английский физик и химик , изучая газы в составе воздуха , сделал вывод:
«Я считаю , что атомы одного элемента одинаковы между собой , но отличаются от атомов других элементов . Если об их размерах нельзя сказать ничего определённого , то об основном их физическом свойстве говорить можно : атомы имеют вес».
«Я считаю , что атомы одного элемента одинаковы между собой , но отличаются от атомов других элементов . Если об их размерах нельзя сказать ничего определённого , то об основном их физическом свойстве говорить можно : атомы имеют вес».
Слайд 3Массы атомов ничтожно малы
Масса самого лёгкого атома водорода
0,000
000 000 000 000 000 000 001 674 г
или 1,674 * 10-24 г
Масса самого тяжёлого атома урана
0,000 000 000 000 000 000 000 395 г
или 3,95 * 10-22 г
Пользоваться такими
величинами неудобно!
или 1,674 * 10-24 г
Масса самого тяжёлого атома урана
0,000 000 000 000 000 000 000 395 г
или 3,95 * 10-22 г
Пользоваться такими
величинами неудобно!
Слайд 4Абсолютная и относительная масса
Иногда используются не абсолютные , а относительные
величины ; например, диетологи , чтобы определить имеется ли у человека избыток или недостаток веса используют показатель массы тела в килограммах относительно роста человека в метрах .
Посчитайте во сколько раз вы увеличили свой вес относительно веса при рождении , а во сколько раз вы тяжелее стула массой 2кг ?
Посчитайте во сколько раз вы увеличили свой вес относительно веса при рождении , а во сколько раз вы тяжелее стула массой 2кг ?
Слайд 5Эталон для сравнения атомных масс
Учёные пытались сопоставить во сколько раз массы
атомов одних элементов тяжелее других.
Джон Дальтон сравнивал атомные массы химических элементов с массой самого лёгкого атома водорода и в 1803 году составил первую таблицу относительных атомных масс элементов по водороду.
Шведский химик Йёнс Якоб Берцелиус в 1818 году предложил для сравнения массу атома кислорода.
В 1961 году эталоном измерения или
атомной единицей массы принята
1/12 часть массы атома углерода.
Джон Дальтон сравнивал атомные массы химических элементов с массой самого лёгкого атома водорода и в 1803 году составил первую таблицу относительных атомных масс элементов по водороду.
Шведский химик Йёнс Якоб Берцелиус в 1818 году предложил для сравнения массу атома кислорода.
В 1961 году эталоном измерения или
атомной единицей массы принята
1/12 часть массы атома углерода.
н
о
1/12
C
Слайд 6Атомная единица массы
m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кг
ma(H)=1 а.е.м. ma(He)=4 а.е.м.
Слайд 7
Относительная атомная масса -Аr
Аr показывает во сколько раз масса атома элемента
больше 1/12 части массы атома углерода или а.е.м.
А r англ. « relative» - относительный
величина безразмерная
Слайд 9 Значения относительных атомных масс некоторых химических элементов
водород
1
1,00797
кислород
углерод
15,9994
12,01115
8
6
Аr(Н)
=1
Аr(С) =12
Аr(О) =16
Слайд 10Дробное значение Аr
хлор
17
35,454
В расчётах используют значения относительных атомных масс
, округлённые до целых чисел, но в случае с хлором для более точных вычислений пользуются дробной величиной
Аr (Сl )=35,5
Слайд 11Вопросы и задания
Что означают записи:
ma(Al)=27 a.e.м.
ma(S)=32 a.e.м.
Аr(Al)=26,9815≈27 Ar(S)=32,064≈32
Напишите округлённые значения относительных атомных масс элементов № 3, 9, 17, 26 , 29
Определите во сколько раз масса атома железа больше а) массы атома водорода
б) массы атома кислорода
в) 1/12 массы атома углерода
Аr(Al)=26,9815≈27 Ar(S)=32,064≈32
Напишите округлённые значения относительных атомных масс элементов № 3, 9, 17, 26 , 29
Определите во сколько раз масса атома железа больше а) массы атома водорода
б) массы атома кислорода
в) 1/12 массы атома углерода
Слайд 12Относительная молекулярная масса -Мr
показывает во сколько раз масса молекулы вещества
больше 1/12 массы атома углерода
равна сумме относительных атомных масс элементов , входящих в состав молекулы вещества, с учётом числа атомов
для немолекулярных веществ это понятие употребляется условно
равна сумме относительных атомных масс элементов , входящих в состав молекулы вещества, с учётом числа атомов
для немолекулярных веществ это понятие употребляется условно
Слайд 14Рассчитайте
Мr (H2) =
Mr (СаСl2) =
Mr (CaCO3) =
Мr (Ca(OH)2)=
Mr (СН3СООН)=
Мr (Ca3(PO4)2)=
1× 2 =2
40+35,5×2=111
40+12+16×3=100
40+16×2+1×2 =74
12×2+1×4+16×2=60
40×3+31×2+16×8 =
=120+62+128=310
40+35,5×2=111
40+12+16×3=100
40+16×2+1×2 =74
12×2+1×4+16×2=60
40×3+31×2+16×8 =
=120+62+128=310
Слайд 15Проверка изученного
I вариант
Мr(SO3) =
Mr(NO2) =
Mr(Al2S3) =
Mr(Cl2) =
Mr(K 2CO3)
=
Mr(Al(OH)3) =
Mr(Al(OH)3) =
II вариант
Мr(SO2) =
Mr(N2O5) =
Mr(Fe2S) =
Mr(SiCl4) =
Mr(Na 2SO4) =
Mr(Cu(OH)2) =