- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Особые свойства азотной кислоты
Содержание
- 1. Презентация по химии на тему Особые свойства азотной кислоты
- 2. Азотная кислота проявляет особые свойства: Взаимодействие с металламиВзаимодействие с неметалламиВзаимодействие с органическими соединениями
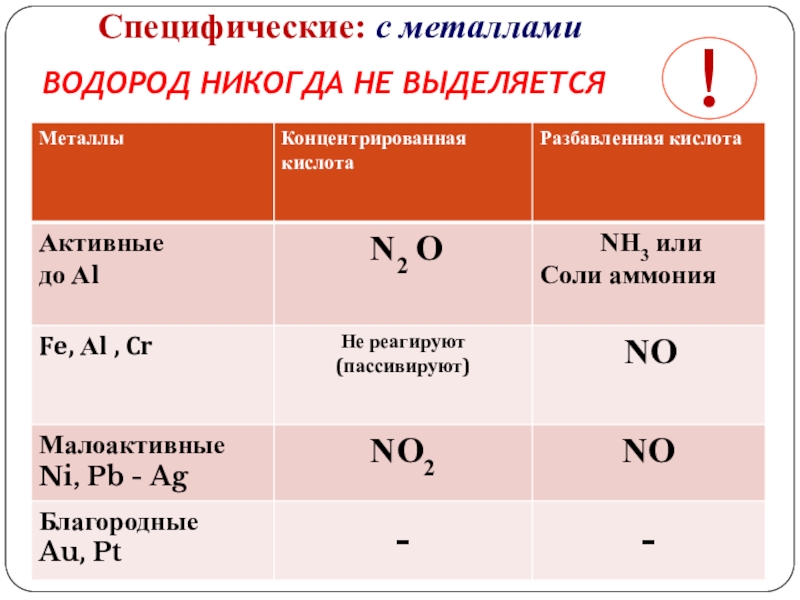
- 3. Cпецифические: с металлами ВОДОРОД НИКОГДА НЕ ВЫДЕЛЯЕТСЯ!
- 4. Взаимодействие с металлами:При взаимодействии с металлами образуются
- 5. Схема уравненияМе +HNO3 = соль +
- 6. При нагревании и под действием света
- 7. Получение
- 8. Промышленный способ1. Окисления аммиaка в NO в
- 9. Промышленный способ получения
- 10. Применение HNO3
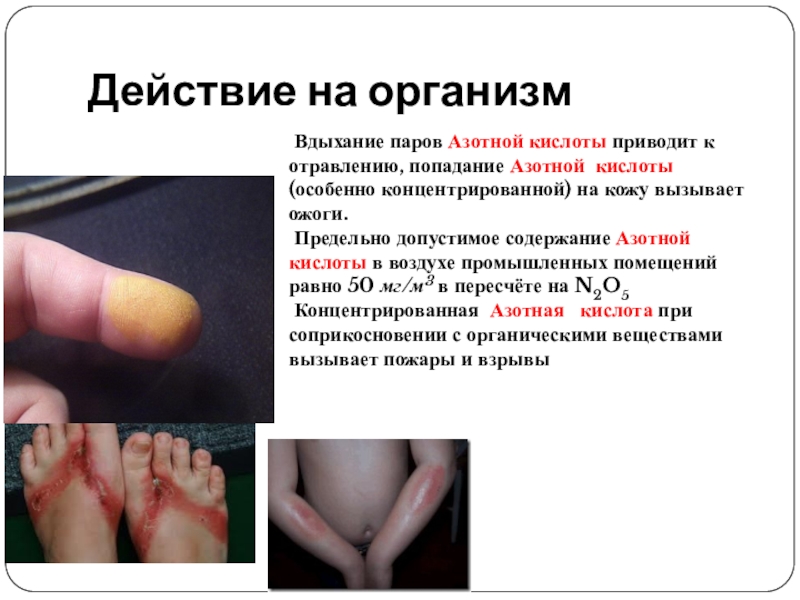
- 11. Действие на организм Вдыхание паров Азотной кислоты приводит
- 12. Слайд 12
- 13. Домашнее задание: §19 упр 1 стр.59 Составить
Слайд 2Азотная кислота проявляет особые свойства:
Взаимодействие с металлами
Взаимодействие с неметаллами
Взаимодействие с
Слайд 4Взаимодействие с металлами:
При взаимодействии с металлами образуются нитрат, вода и третий
HNO3(р.)+Me(до H2) → нитрат+H2O+NH3(NH4NO3)
HNO3(р.)+Me(после H2) → нитрат+H2O+NO
HNO3(к.)+Me(до H2) → нитрат+H2O+N2O(N2)
HNO3(к.)+Me(после H2) → нитрат+H2O+NO2
Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
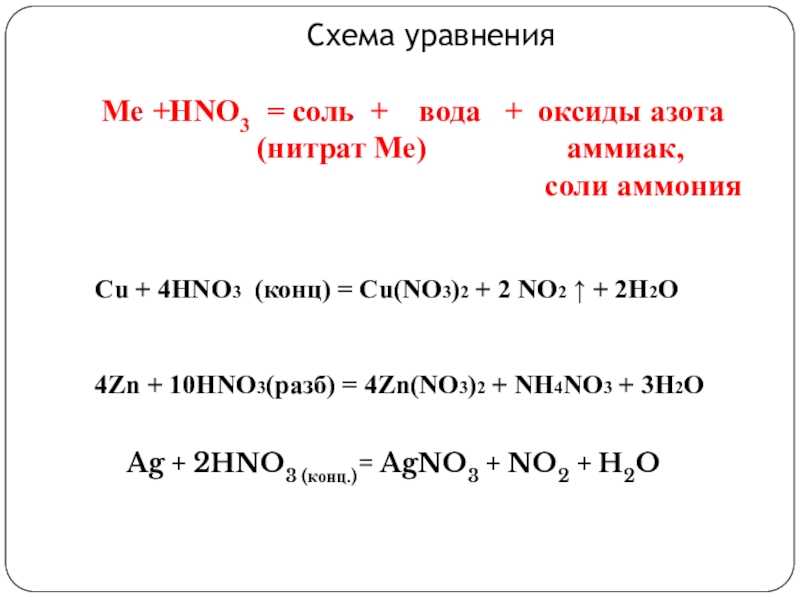
Слайд 5Схема уравнения
Ме +HNO3 = соль + вода + оксиды
(нитрат Ме) аммиак,
соли аммония
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2 NO2 ↑ + 2H2O
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Ag + 2HNO3 (конц.)= AgNO3 + NO2 + H2O
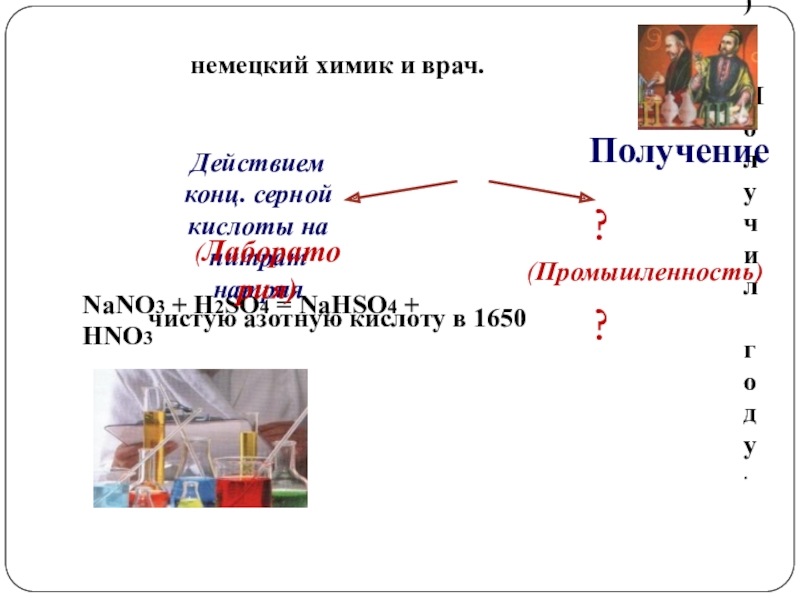
Слайд 7Получение
ГЛАУБЕР Иоганн Рудольф
немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году.
Завод азотной кислоты
NaNO3 + H2SO4 = NaHSO4 + HNO3
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
Слайд 8Промышленный способ
1. Окисления аммиaка в NO в присутствии платино-родиевого
катализатора:
4NH3 +
3. Поглощения NO2 водой в присутствии кислорода:
4NO2 + 2H2O + O2= 4HNO3
Массовая доля HNO3 составляет около 60%
2. Окисления NO в NO2 на холоду под давлением (10 ат):
2NO + O2 = 2NO2
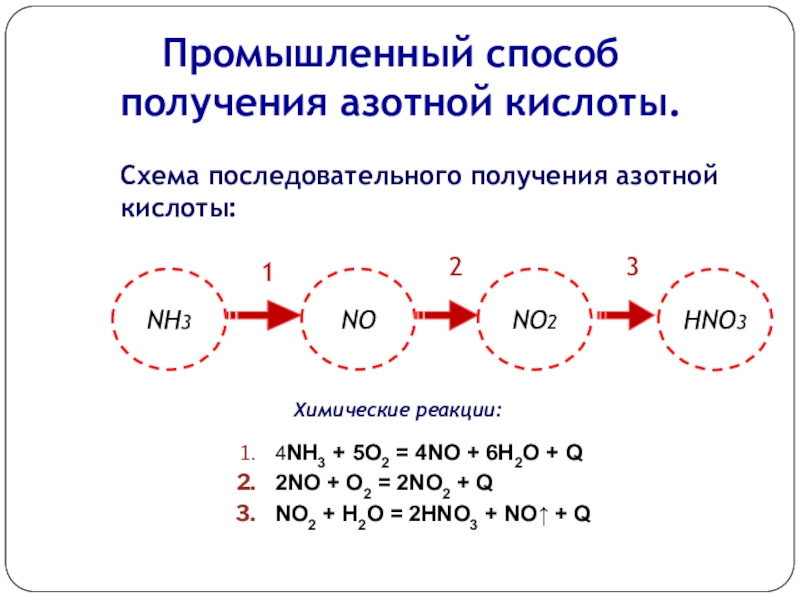
Слайд 9 Промышленный способ получения азотной кислоты.
Схема последовательного получения
Химические реакции:
1
2
3
4NH3 + 5О2 = 4NO + 6Н2О + Q
2NO + O2 = 2NO2 + Q
NO2 + H2O = 2HNO3 + NO↑ + Q
Слайд 11Действие на организм
Вдыхание паров Азотной кислоты приводит к отравлению, попадание Азотной
Предельно допустимое содержание Азотной кислоты в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5
Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы
Слайд 12
1. Азотной кислоте характерны общие свойства кислот:
реакция на индикатор, взаимодействие с оксидами металлов,
гидроксидами, солями более слабых кислот обусловленные
наличием в молекулах иона Н+;
2. Сильные окислительные свойства азотной кислоты
обусловлены строением ее молекулы. При ее взаимодействии с
металлами никогда не образуется водород, а образуются
нитраты, оксиды азота или другие его соединения (азот, нитрат
аммония) и вода в зависимости от концентрации кислоты и
активности металла;
3. Сильные окислительные способности HNO3 широко применяются
для получения различных важных продуктов народного хозяйства
(удобрения, лекарства, пластики и т.д.)