- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Основные понятия химии 11 класс
Содержание
- 1. Презентация по химии на тему: Основные понятия химии 11 класс
- 2. Химия – это наука о составе, строении,
- 3. Атом – это электронейтральная частица, состоящего из
- 4. Молекула – это отдельная электронейтральная частица, образующаяся
- 5. Химический элемент – это совокупность атомов с
- 6. Состав веществ. Изменение веществ.
- 7. Простые вещества – это вещества, образованные одним
- 8. Различают в качественный и количественный состав веществ. Качественный
- 9. Состав веществ отображают посредством химической символики. По предложению
- 10. Химический знак (символ) – несет значительную информацию.
- 11. Химическая формула – это способ отображения химического
- 12. Формулы вещества составляют на основании еще одного
- 13. Широко используются несколько видов химических формул:Простейшая (эмпирическая)
- 14. Относительная атомная масса ( ) химического элемента
- 15. Относительная атомная масса – одна из основных
- 16. Количество вещества (n или v) характеризуют числом
- 17. Слайд 17
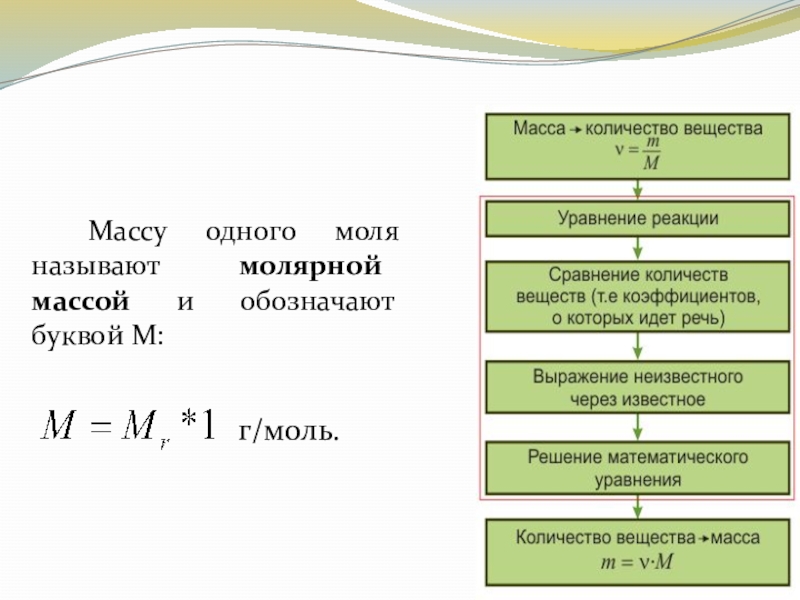
- 18. Массу одного моля называют молярной массой и обозначают буквой М:
- 19. Слайд 19
- 20. Молярная масса может быть выражена через число
- 21. Из этого выражения можно определить число молекул
- 22. Закон Авогадро. Сформулирован А. Авогадро в результате проведения
- 23. Найдите относительные молекулярные массы веществ, состав которых
- 24. Спасибо за работу!
- 25. Список использованной литературыГабриелян О.С. Химия для профессий
Химия – это наука о составе, строении, свойствах и превращениях веществ. Вещество – один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.
Слайд 2
Химия – это наука о составе, строении, свойствах и превращениях веществ.
Вещество
– один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.
Слайд 3
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и
отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента, предел химической делимости материи.
Слайд 4 Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей
между атомами одного или нескольких элементов, которая определяет химические свойства вещества.
Слайд 5
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Вещества, образованные
одним химическим элементом, называют простыми. Один и тот же химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией, а различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями.
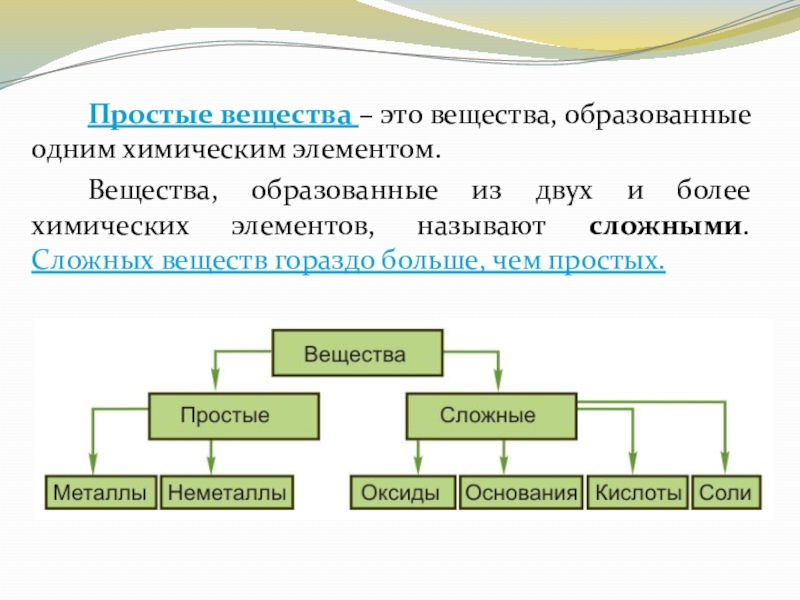
Слайд 7 Простые вещества – это вещества, образованные одним химическим элементом.
Вещества, образованные из
двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
Слайд 8
Различают в качественный и количественный состав веществ.
Качественный состав – это совокупность
химических элементов и (или) атомных группировок, составляющих данное химическое вещество.
Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Слайд 9 Состав веществ отображают посредством химической символики.
По предложению Й. Я. Берцелиуса элементы
принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Слайд 10 Химический знак (символ) – несет значительную информацию. Он обозначает название элемента,
один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Слайд 11 Химическая формула – это способ отображения химического состава вещества. Она обозначает
название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу.
Посмотреть видеоролик.
Посмотреть видеоролик.
Слайд 12 Формулы вещества составляют на основании еще одного важнейшего понятия в химии
– валентности.
Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.
Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.
Слайд 13 Широко используются несколько видов химических формул:
Простейшая (эмпирическая) формула показывает качественный состав
и соотношения, в которых находятся частицы, образующие данное вещество.
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру.
Графическая формула отражает порядок соединения атомов, т. е. связи между ними.
Посмотреть видеоролик получения формулы по названию
Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру.
Графическая формула отражает порядок соединения атомов, т. е. связи между ними.
Посмотреть видеоролик получения формулы по названию
Слайд 14
Относительная атомная масса ( ) химического элемента – это величина, показывающая
отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода :
Единая углеродная атомная единица массы (а. е. м.) равна:
Единая углеродная атомная единица массы (а. е. м.) равна:
Слайд 15
Относительная атомная масса – одна из основных характеристик химического элемента.
Относительная молекулярная
масса ( ) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.
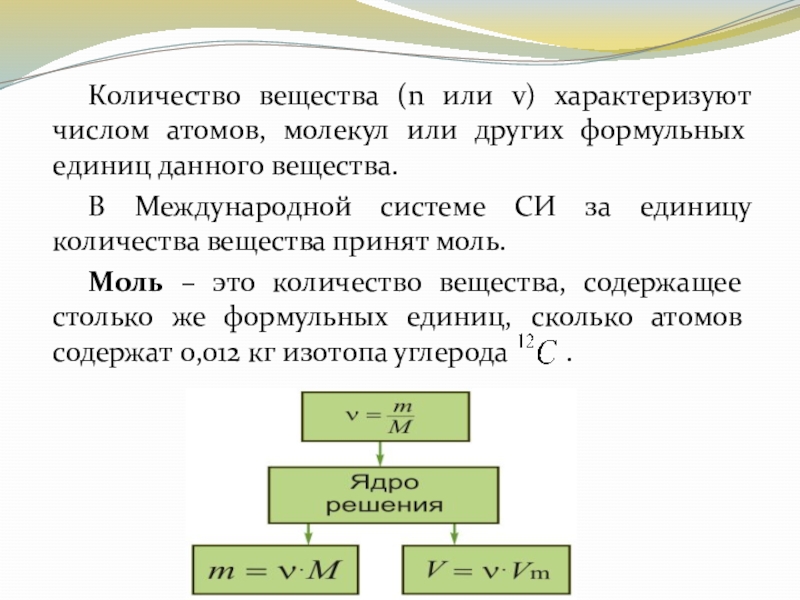
Слайд 16 Количество вещества (n или v) характеризуют числом атомов, молекул или других
формульных единиц данного вещества.
В Международной системе СИ за единицу количества вещества принят моль.
Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода .
В Международной системе СИ за единицу количества вещества принят моль.
Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода .
Слайд 20 Молярная масса может быть выражена через число молекул (или атомов) в
одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома):
Массу молекулы (атома) в килограммах можно рассчитать по уравнению
следовательно
Массу молекулы (атома) в килограммах можно рассчитать по уравнению
следовательно
Слайд 21 Из этого выражения можно определить число молекул или атомов, содержащихся в
одном месте любого вещества, которое называют постоянной Авогадро.
Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна
Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна
Слайд 22
Закон Авогадро.
Сформулирован А. Авогадро в результате проведения многочисленных экспериментов:
В равных объемах
различных газов при одинаковых условиях содержится одинаковое число молекул.
Слайд 23Найдите относительные молекулярные массы веществ, состав которых описывается формулами:
Рассчитайте относительные молекулярные
массы медного купороса и кристаллической соды
Сколько молекул содержится в 32 г сернистого газа
?
Сколько молекул содержится в 32 г сернистого газа
?
Задания
Слайд 25Список использованной литературы
Габриелян О.С. Химия для профессий и специальностей технического профиля.
Учебник - М. Академия, 2011.
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2009.
Габриелян О.С. Химия. 8-11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2006.
1с химия. Мультимедийное пособие
Тестер А.Баженова. http://edu-lider.ru/proverka-znanij-konstruktor-testov/
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2009.
Габриелян О.С. Химия. 8-11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2006.
1с химия. Мультимедийное пособие
Тестер А.Баженова. http://edu-lider.ru/proverka-znanij-konstruktor-testov/