- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Основные понятия и стехиометрические законы химии
Содержание
- 1. Презентация по химии на тему Основные понятия и стехиометрические законы химии
- 2. I.Стехиометрия-это раздел химии, в котором исследуется количественный
- 3. Стехиометрия имеет фундаментальное значение в современной химии.
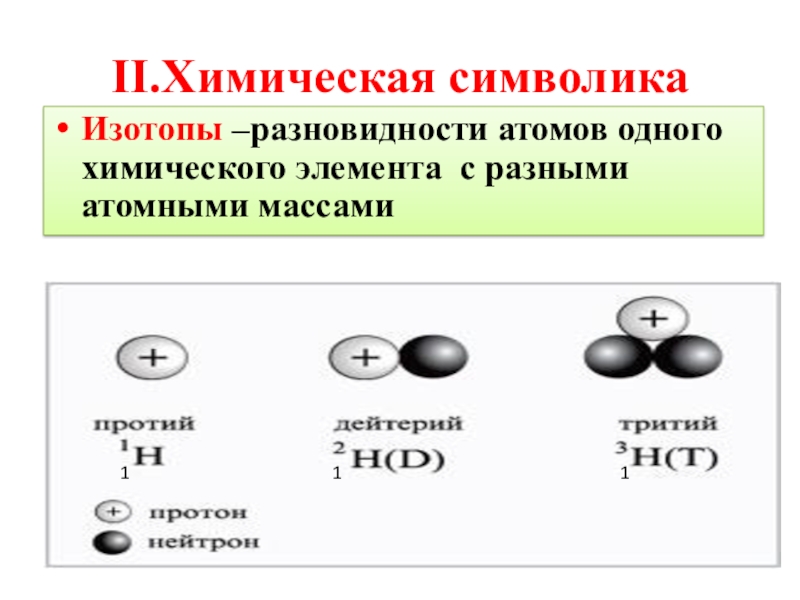
- 4. II.Химическая символикаИзотопы –разновидности атомов одного химического элемента с разными атомными массами111
- 5. III.ИзотопыА r(Э) сред.=Аr 1 ·ω1 +Аr
- 6. IV.Стехиометрические индексы Р2O3это числа, стоящие
- 7. V.Стехиометрические коэффициенты Например, стехиометрические коэффициенты в
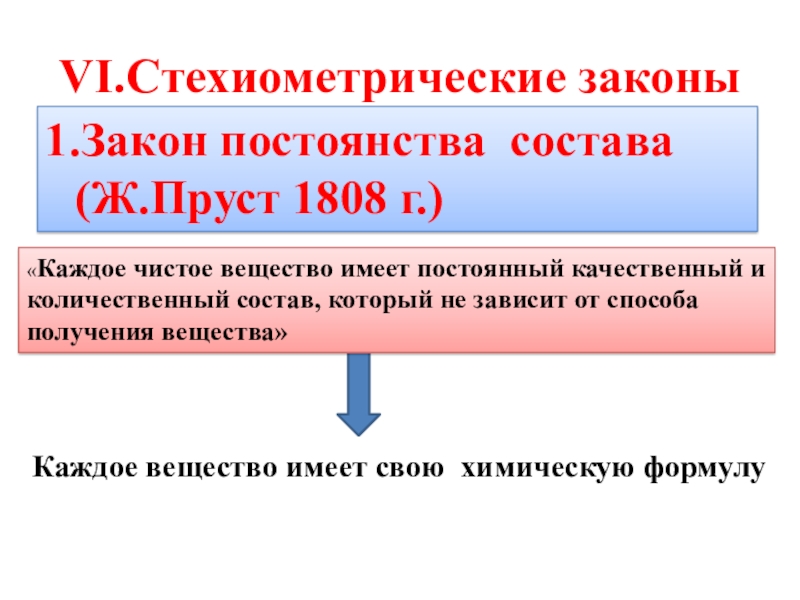
- 8. VI.Стехиометрические законы1.Закон постоянства состава (Ж.Пруст 1808 г.)Каждое
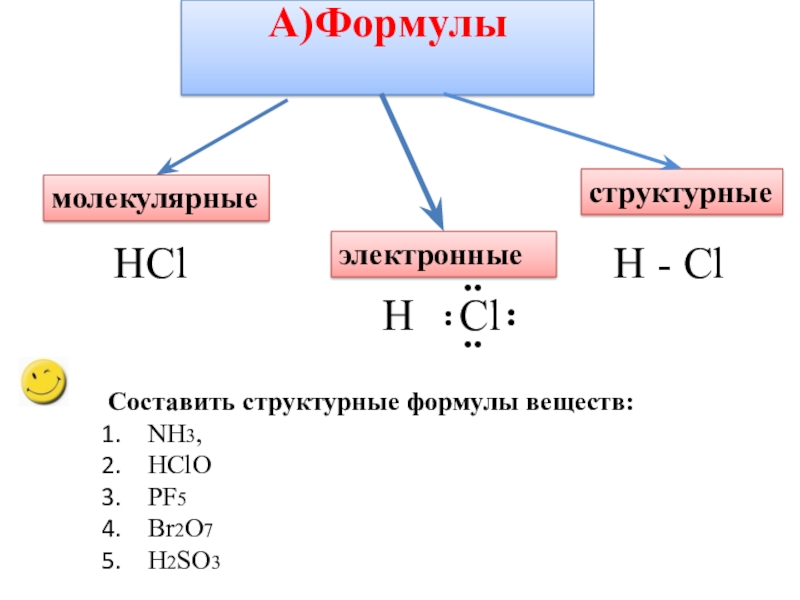
- 9. А)Формулы молекулярныеэлектронныеструктурныеHClH - ClH Cl¨¨¨¨Составить структурные формулы веществ:NH3,HClOPF5Br2O7H2SO3
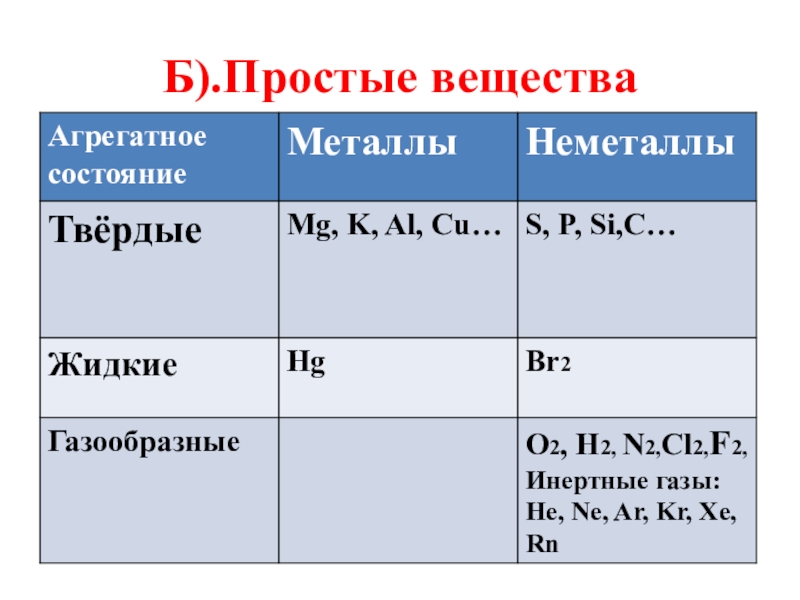
- 10. Б).Простые вещества
- 11. В).Сложные веществаСоставить формулы:Хлорид олова(IV)Оксид хрома(VI)Бромид алюминияОксид азота(V)СероводородСульфид свинца(II)
- 12. 2.Закон кратных отношений
- 13. 3.Закон эквивалентов
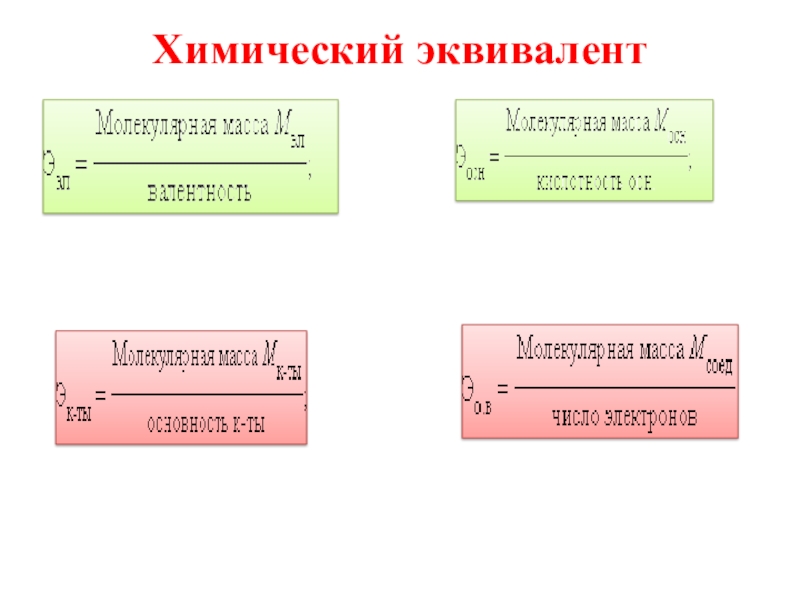
- 14. Химический эквивалент
- 15. 4.Закон Авогадро(1811 г. ) Из закона
- 16. А).Число Авогадрочисло частиц в моле любого вещества; NA = 6,02∙1023 моль–1
- 17. Б).Молярный объем (Vm )- объем моля любого
- 18. В).Молярная масса (M) М r(HCl)=1+35,5=36,5М (HCl)=36,5г/моль Масса
- 19. Г).Количество вещества Моль – количество вещества,
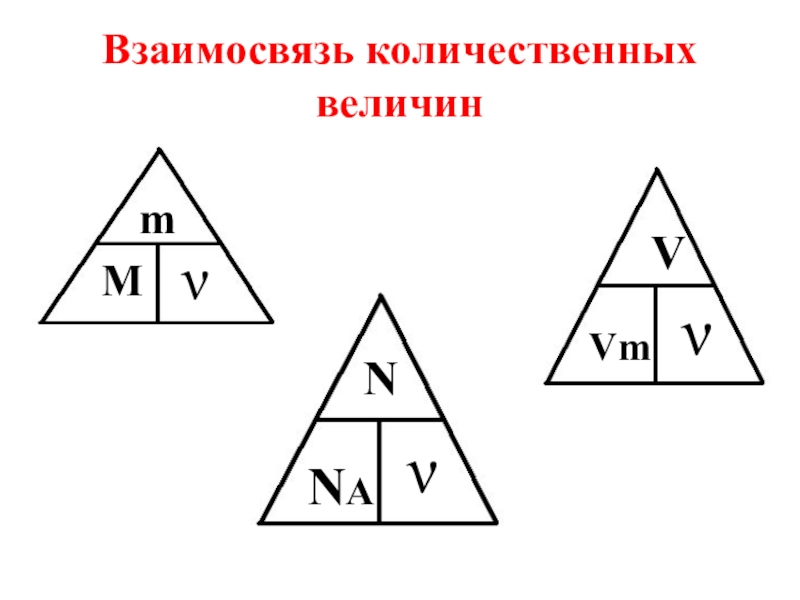
- 20. Взаимосвязь количественных величинmМNNAνννVVm
- 21. Д).Характеристики атомов и молекулМ r (В), mmМ
- 22. 5.Закон сохранения массы ( М. В. Ломоносов
- 23. 6.Закон простых объемных отношений (Ж. Гей-Люссак)По ЗОО:
Слайд 2I.Стехиометрия
-это раздел химии, в котором исследуется количественный состав химических соединений, а
Термин «стехиометрия» ввел в 1792 г. И. Рихтер, образовав его из двух греческих слов: «стехион», означающего «элементный состав», и «метрейн», означающего «измерять».
Слайд 3Стехиометрия имеет фундаментальное значение в современной химии. Она является основой количественного
Значение стехиометрии
Слайд 4II.Химическая символика
Изотопы –разновидности атомов одного химического элемента с разными атомными массами
1
1
1
Слайд 5III.Изотопы
А r(Э) сред.=
Аr 1 ·ω1
+
Аr 2·ω2
Массовая доля изотопа
ω1+ ω2
Слайд 6IV.Стехиометрические индексы
Р2O3
это числа, стоящие в химических формулах справа
Слайд 7V.Стехиометрические коэффициенты
Например, стехиометрические коэффициенты в уравнении реакции получения
числа, стоящие перед формулами веществ в уравнениях реакций. Они определяют соотношения количеств исходных веществ и продуктов реакции.
Слайд 8VI.Стехиометрические законы
1.Закон постоянства состава (Ж.Пруст 1808 г.)
Каждое вещество имеет свою химическую
«Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества»
Слайд 9А)Формулы
молекулярные
электронные
структурные
HCl
H - Cl
H Cl
¨
¨
¨
¨
Составить структурные формулы веществ:
NH3,
HClO
PF5
Br2O7
H2SO3
Слайд 11В).Сложные вещества
Составить формулы:
Хлорид олова(IV)
Оксид хрома(VI)
Бромид алюминия
Оксид азота(V)
Сероводород
Сульфид свинца(II)
Слайд 12 2.Закон кратных отношений
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношениям :
NO
N2O
m(N): m (O)= 1 : 1,14= 1 : 1
m(N): m (O)= 1 : 1,71= 2 : 3
N2O3
m(N): m (O)= 1 : 2,28= 1 : 2
NO2
m(N): m (O)= 1 : 2,85= 2 : 5
N2O5
m(N): m (O)= 1 : 0,57 = 2 : 1
«Если два элемента образуют между собой несколько молекулярных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа».
Слайд 13 3.Закон эквивалентов
Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
«В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты».
Слайд 154.Закон Авогадро(1811 г. )
Из закона Авогадро вытекают два следствия:
Одинаковое количество молекул любых газов при одинаковых условиях занимают одинаковый объем.
Относительная плотность одного газа по другому равна отношению их молярных масс.
«В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул».
M1
M2
=
D
Слайд 17Б).Молярный объем (Vm )-
объем моля любого газа при нормальных условиях(температура
Vm ( Г) = 22,4 л/моль
V= Vm·ν
Слайд 18В).Молярная масса (M)
М r(HCl)=1+35,5=36,5
М (HCl)=36,5г/моль
Масса одного моля вещества, численно
m = М· ν
M = mm · NA
Слайд 19Г).Количество вещества
Моль – количество вещества, содержащее 6,02∙1023 структурных единиц.
Физическая
Слайд 21Д).Характеристики атомов и молекул
М r (В), mm
М r(HCl)=1+35,5=36,5
mm (HCl)=6,06·10
Аr (Э) ,
Аr (C)=12
ma (C)=1,66·10 кг
-27
-27
кг
М r(Al2(SO4)3)=
М r(CH3COOH)=
М r(K2Cr2O7)= М r(C3H5(OH)3)=
Слайд 225.Закон сохранения массы ( М. В. Ломоносов 1748г.
2Zn + О2
130 г цинка и 32 г кислорода (общая масса 162 г) образуют оксида цинка 162 г. В соответствии с теорией относительности, открытой в 1905 г. А. Эйнштейном, было доказано, что закон сохранения массы не вполне точен. Общая масса веществ в ходе реакции должна изменяться в результате выделения или поглощения энергии согласно уравнению Δ Е = Δ тс2 где Δ Е — изменение энергии; Δ т — соответствующее изменение массы; с — скорость света в вакууме. Однако в химических реакциях изменения массы вследствие энергетических эффектов неощутимо малы. Поэтому в химии принято считать, что закон сохранения массы выполняется строго.
«
«Общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции».
Слайд 236.Закон простых объемных отношений (Ж. Гей-Люссак)
По ЗОО: V(H2):V(O2)=2:1
«При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа».