- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Основания и их свойства. Основные способы получения оснований
Содержание
- 1. Презентация по химии на тему: Основания и их свойства. Основные способы получения оснований
- 2. «Просто знать – ещё не всё, знания
- 3. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп
- 4. Валентность гидроксогруппы – Количество гидроксогрупп определяется степенью
- 5. Название основанийГидроксид +Название металла в родительном падеже+Степень окисления римскими цифрами
- 6. Дайте названия гидроксидамNaOHCa(OH)2Fe(OH)2Fe(OH)3Al(OH)3Гидроксид натрияГидроксид железа (II)Гидроксид кальция Гидроксид алюминия Гидроксид железа (III)
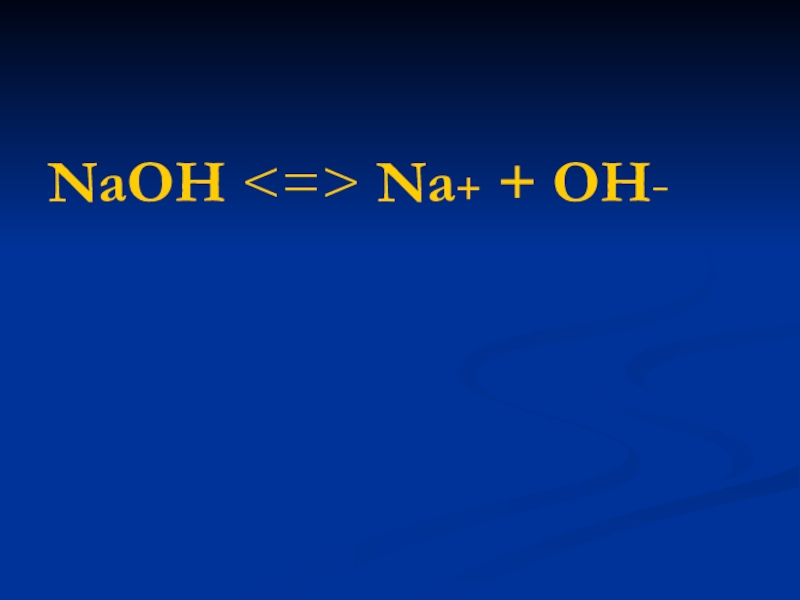
- 7. основания являются электролитами, диссоциирующие с образованием гидроксид-ионов ОН-
- 8. NaОН Na+ + ОН-
- 9. Классификация основанийРастворимые в воде(щелочи)Нерастворимые в водеNaOHCa(OH)2Al(OH)3Сu(OH)2
- 10. Получение оснований
- 11. Щелочи получают взаимодействием активных металлов с водой,
- 12. Свойства оснований
- 13. 1. Изменяют цвет индикаторовИндикаторы – от лат. «indication» - указатели
- 14. 2. Щёлочь + оксид неметалла → соль
- 15. 3. Щелочь + соль → новое
- 16. 4. Основание + кислота → соль
- 17. 5. Амфотерные гидроксиды взаимодействуют с растворами щелочей
- 18. Нерастворимое основание →оксид металла +
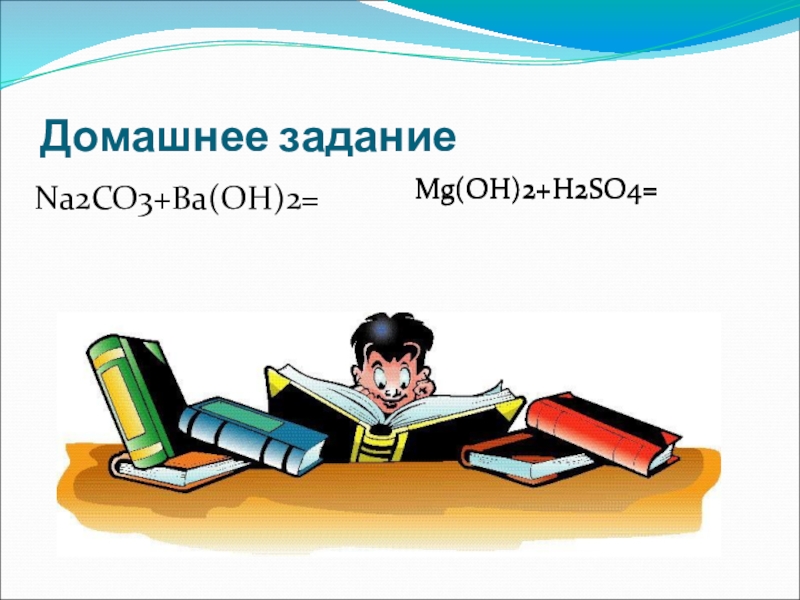
- 19. Домашнее заданиеNa2CO3+Вa(OH)2=Mg(OH)2+H2SO4=Mg(OH)2+H2SO4=
Слайд 2
«Просто знать – ещё не всё, знания нужно уметь использовать»
Тема: Основания и их свойства. Основные способы получения оснований
Слайд 3Основания
– это сложные вещества, состоящие из ионов металлов и связанных
Слайд 4Валентность гидроксогруппы –
Количество гидроксогрупп определяется степенью окисления металла, образующего основание.
Слайд 5Название оснований
Гидроксид
+
Название металла в родительном падеже
+
Степень окисления римскими цифрами
Слайд 6Дайте названия гидроксидам
NaOH
Ca(OH)2
Fe(OH)2
Fe(OH)3
Al(OH)3
Гидроксид натрия
Гидроксид железа (II)
Гидроксид кальция
Гидроксид алюминия
Гидроксид железа
Слайд 9Классификация оснований
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Ca(OH)2
Al(OH)3
Сu(OH)2
Слайд 11
Щелочи получают взаимодействием активных металлов с водой, а также их оксидов
2Na + 2Н2O = 2NaОН + H2 ↑
ВаО + Н2O = Ва(OH)2
2. Нерастворимые в воде основания получают в результате реакции обмена между солью и щелочью:
Сu(NO3)2 + KOH = KNO3 + Сu(OH)2 ↓
Слайд 142. Щёлочь + оксид неметалла → соль + вода
(
УСЛОВИЕ:
оксиду неметалла должна соответствовать определенная кислота
например: N2+5O5 → H N+5O3
S+6O3 → H2 S+6O4
2KOH + N2O5 → 2KNO3 + H2O
2LiOH + SO3 → Li2SO4 + H2O
Слайд 15 3. Щелочь + соль → новое основание + новая соль
( реакция обмена)
3NaOH+FeCl3→Fe(OH)3↓+ 3NaCl
Условия протекания реакции до конца:
образование осадка.
Слайд 175. Амфотерные гидроксиды взаимодействуют с растворами щелочей и кислот
Zn(OH)2 + 2НNO3
основание
H2 ZnO2 +2NaOH = Na2 ZnO2 + 2H2O
кислота
Слайд 18 Нерастворимое основание →оксид металла + вода
(разложение при нагревании)
Mg(OH)2 → MgO + H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Данный тип реакции не характерен для растворимых оснований