- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Основания
Содержание
- 1. Презентация по химии на тему Основания
- 2. Цели
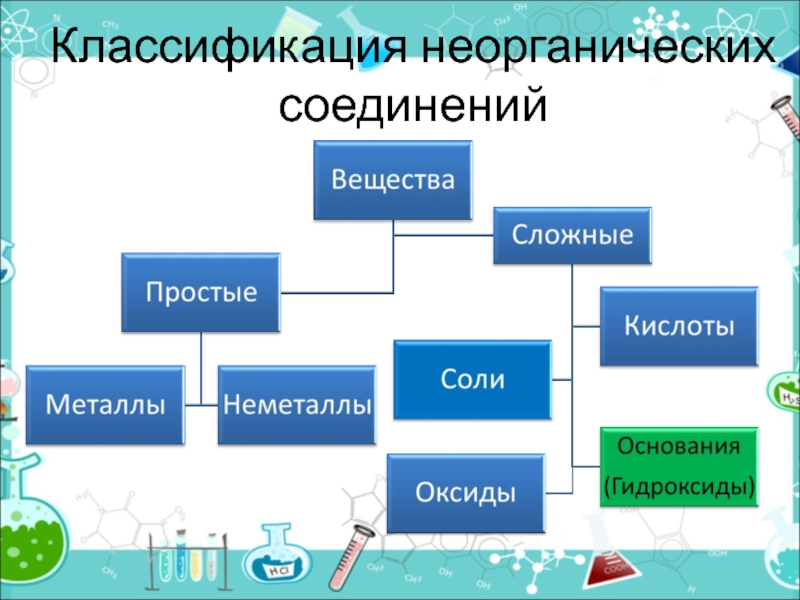
- 3. Классификация неорганических соединений
- 4. Номенклатура средних солеймагнияНазвание кислотного остаткаНаименование металла в родительном падежеМgСL2 хлорид
- 5. Номенклатура кислых солейУказать название кислотного остаткаК названию кислотного остатка прибавить «гидро-»Наименование металла в родительном падежеNaHSO4сульфатгидронатрия
- 6. Химические свойства1. Взаимодействие с металлами:
- 7. Химические свойства 2. Взаимодействие со щелочами:
- 8. Химические свойства3. Взаимодействие солеймежду собойКСl + AgNO3 → AgCl + KNO3
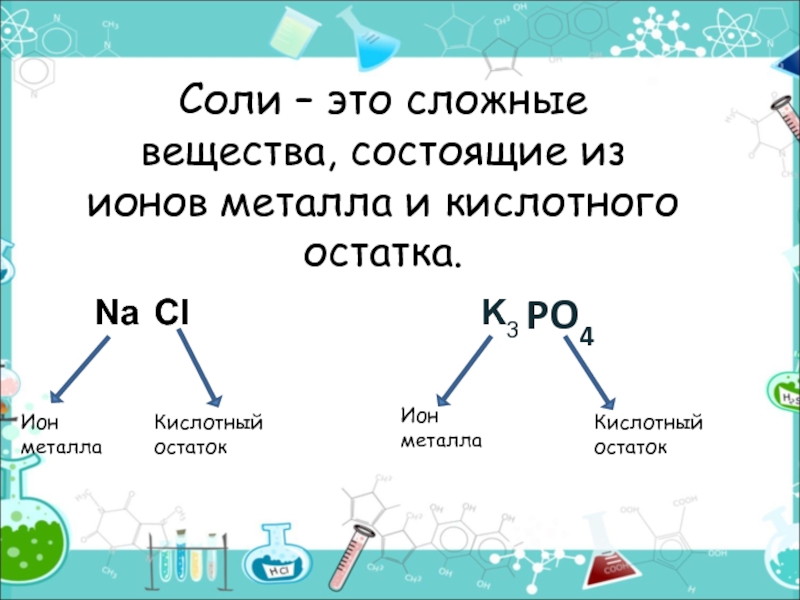
- 9. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.PO4Ион металлаКислотный остатокИон металлаКислотный остатокNaClK3
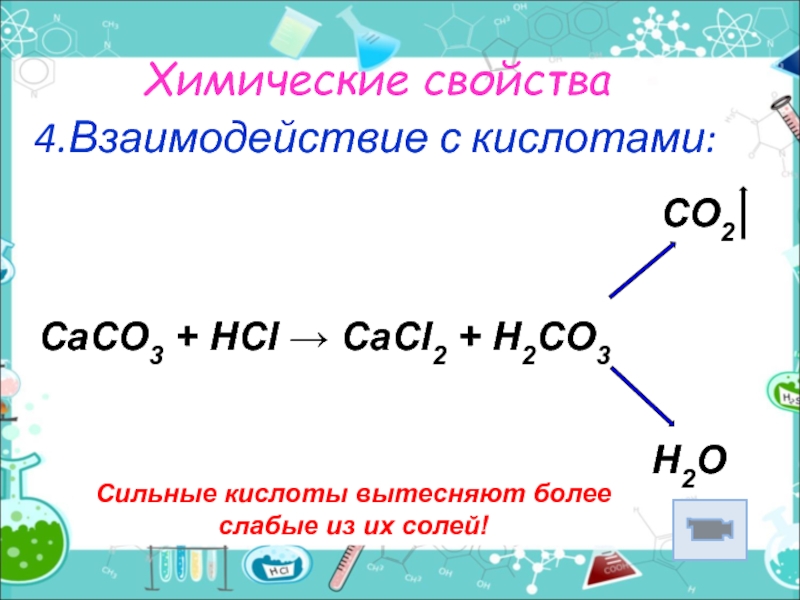
- 10. Химические свойства4.Взаимодействие с кислотами:Сильные кислоты вытесняют более
- 11. Химические свойства Разложение при нагревании
- 12. Способы получения 1. Кислота + основание
- 13. Способы получения 5. Основание + соль
- 14. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙсоли ТестЩелкните кнопку Тест для редактирования этого теста
Цели
Слайд 4Номенклатура средних солей
магния
Название кислотного остатка
Наименование металла в родительном падеже
МgСL2
хлорид
Слайд 5Номенклатура кислых солей
Указать название кислотного остатка
К названию кислотного остатка прибавить «гидро-»
Наименование
металла в родительном падеже
NaHSO4
сульфат
гидро
натрия
Слайд 9Соли – это сложные вещества, состоящие из ионов металла и кислотного
остатка.
PO4
Ион
металла
Кислотный
остаток
Ион
металла
Кислотный
остаток
Na
Cl
K3
Слайд 10Химические свойства
4.Взаимодействие с кислотами:
Сильные кислоты вытесняют более слабые из их солей!
CO2
CaCO3 + HCl → CaCl2 + H2CO3
H2O
CaCO3 + HCl → CaCl2 + H2CO3
H2O
Слайд 12Способы получения
1. Кислота + основание = соль + вода
H2SO4 +2NaOH = Na2SO4 + 2H2O
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
Основаны на химических свойствах оксидов,
оснований, кислот
10
способов
10
способов
10
способов
10
способов
10
способов
Слайд 13Способы получения
5. Основание + соль = новое основание + новая
соль
2КОН + СаSO4 = Са(ОН) 2 + К2SO4
6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
10. Металл + неметалл = соль
Fe +S = FeS
2КОН + СаSO4 = Са(ОН) 2 + К2SO4
6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
10. Металл + неметалл = соль
Fe +S = FeS
10
способов
10
способов
10
способов
10
способов
Слайд 14ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
соли
Тест
Щелкните кнопку Тест для редактирования этого
теста