- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Оксиды. Классификация, свойства, получение и применение оксидов
Содержание
- 1. Презентация по химии на тему Оксиды. Классификация, свойства, получение и применение оксидов
- 2. Цели урока:
- 3. Что такое оксиды?Оксиды – это сложные вещества,
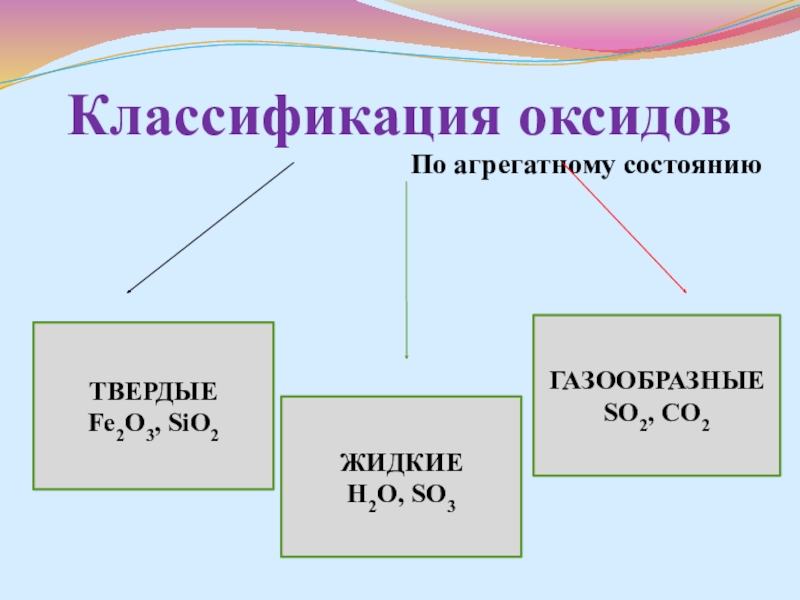
- 4. Классификация оксидовПо агрегатному состоянию ТВЕРДЫЕ Fe2O3, SiO2ЖИДКИЕ Н2О, SO3ГАЗООБРАЗНЫЕ SO2, CO2
- 5. Пример твердого оксидаПесок – диоксид кремния SiO2 с небольшим количеством примесей.
- 6. Пример жидкого оксида
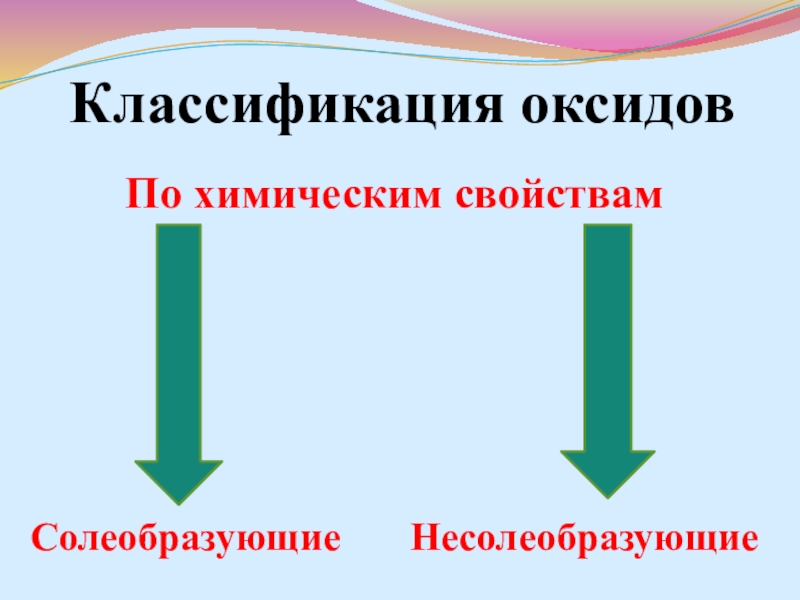
- 7. Классификация оксидовПо химическим свойствам Солеобразующие Несолеобразующие
- 8. Классификация оксидов Несолеобразующие оксиды –
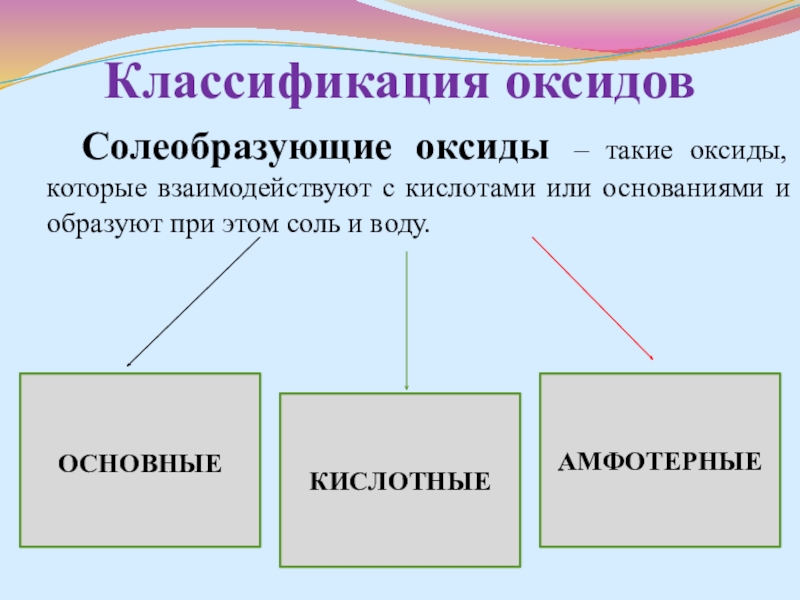
- 9. Классификация оксидов Солеобразующие оксиды –
- 10. Основные оксиды Основные оксиды –
- 11. Кислотные оксиды Кислотные оксиды –
- 12. 1 способ: окисление металлов где CuO – оксид меди (II)Способы получения оксидов
- 13. 2 способ: окисление неметаллов где CO2 – оксид углерода (IV)Способы получения оксидов
- 14. 3 способ: разложение кислот где - сернистая кислота,SO2 – оксид серы (IV)Способы получения оксидов
- 15. 4 способ: разложение солей где - карбонат кальция CаO – оксид кальция (II)Способы получения оксидов
- 16. 5 способ: разложение нерастворимых оснований где -
- 17. 6 способ: вытеснение из солей другими оксидами
- 18. 7 способ: горение сложных веществ где -
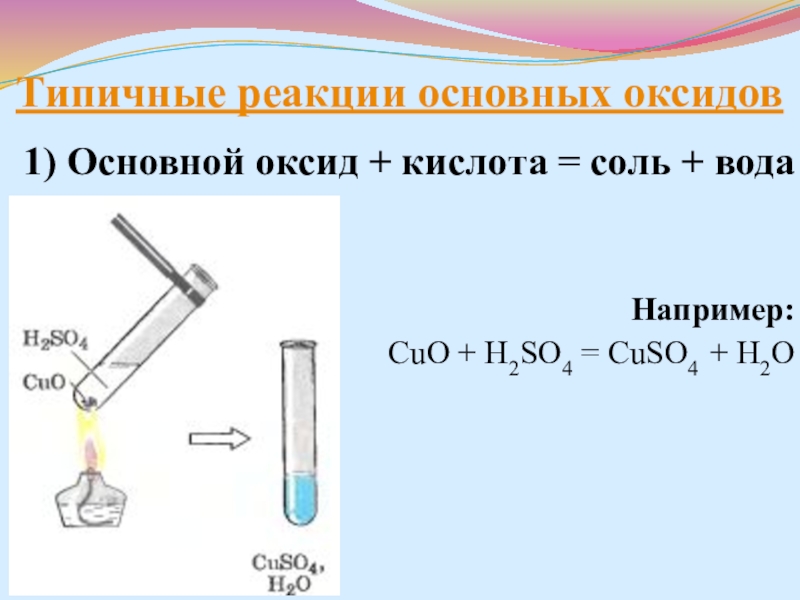
- 19. Химические свойства оксидовТипичные реакции основных оксидов1) Основной
- 20. Типичные реакции основных оксидов1) Основной оксид +
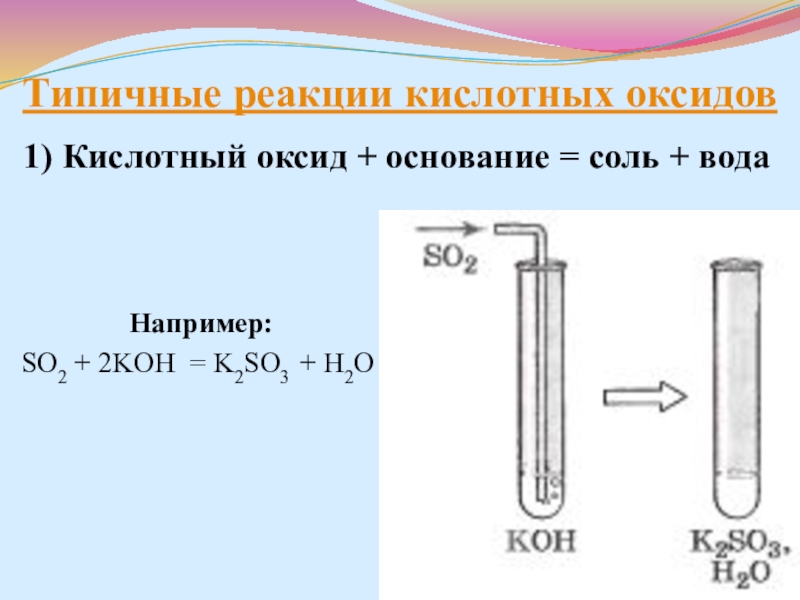
- 21. Типичные реакции кислотных оксидов1) Кислотный оксид +
- 22. Типичные реакции кислотных оксидов1) Кислотный оксид +
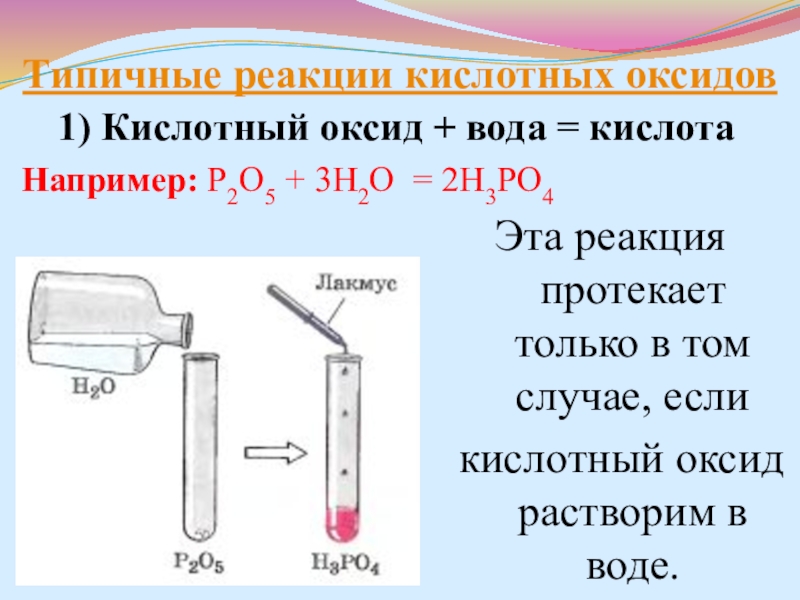
- 23. Типичные реакции кислотных оксидов1) Кислотный оксид +
- 24. Слайд 24
- 25. Применение оксидов
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Обобщение темы:Вопрос-ответ:Что такое оксиды?Какие оксиды называются основными?В каком случае кислотный оксид взаимодействует с водой?
- 30. Обобщение темы:Тест: «Правильный ответ»1) Какой из оксидов
- 31. Ответы на вопросы:1) Оксиды – это сложные
- 32. Использованные источники информации Габриелян О.С., Остроумов И.Г.
- 33. Спасибо за внимание
Слайд 1Краевое государственное бюджетное профессиональное образовательное учреждение
«Приморский многопрофильный колледж »
Презентация урока
« Оксиды, их классификация, свойства, получение, применение»
Группа ТОРАТ-17, специальность 23.02.03 Техническое обслуживание и ремонт автомобильного транспорта
Автор: Демидова Надежда Ивановна
Партизанский городской округ, 2017год
Слайд 3Что такое оксиды?
Оксиды – это сложные вещества, состоящие из двух химических
Слайд 4Классификация оксидов
По агрегатному состоянию
ТВЕРДЫЕ
Fe2O3, SiO2
ЖИДКИЕ
Н2О, SO3
ГАЗООБРАЗНЫЕ
SO2, CO2
Слайд 8Классификация оксидов
Несолеобразующие оксиды – такие оксиды, которые не
Например:
oксиды азота (I), (II) и (IV) - N2O, NO, NO2
oксид углерода (II) – СО
oксид кремния (II) - SiO
Слайд 9Классификация оксидов
Солеобразующие оксиды – такие оксиды, которые взаимодействуют
ОСНОВНЫЕ
КИСЛОТНЫЕ
АМФОТЕРНЫЕ
Слайд 10Основные оксиды
Основные оксиды – это такие оксиды, которым
Например:
MgO соответствует Mg(OH)2
Na2O соответствует NaOH
BaO соответствует Ba(OH)2
Слайд 11Кислотные оксиды
Кислотные оксиды – это такие оксиды, которым
Например:
SO3 соответствует H2SO4
CO2 соответствует H2CO3
P2O5 соответствует H3PO4
Слайд 143 способ: разложение кислот
где - сернистая кислота,
SO2 – оксид серы
Способы получения оксидов
Слайд 154 способ: разложение солей
где - карбонат кальция
CаO – оксид
Способы получения оксидов
Слайд 165 способ: разложение нерастворимых оснований
где - гидроксид железа (II),
FeO – оксид железа (II)
Способы получения оксидов
Слайд 176 способ: вытеснение из солей другими оксидами
где - карбонат натрия,
SiO2 – оксид кремния (IV),
Na2SiO3 - силикат натрия
Способы получения оксидов
Слайд 187 способ: горение сложных веществ
где - этанол (этиловый спирт),
Способы получения оксидов
Слайд 19Химические свойства оксидов
Типичные реакции основных оксидов
1) Основной оксид + кислота =
2) Основной оксид + кислотный оксид = соль
3) Основной оксид + вода = щелочь
Слайд 20Типичные реакции основных оксидов
1) Основной оксид + кислота = соль +
Например:
CuO + H2SO4 = CuSO4 + H2O
Слайд 21Типичные реакции кислотных оксидов
1) Кислотный оксид + основание = соль +
Например:
SO2 + 2KOH = K2SO3 + H2O
Слайд 22Типичные реакции кислотных оксидов
1) Кислотный оксид + основной оксид = соль
Например:
SO3 + K2O = K2SO4
CO2 + CaO = CaCO3
Слайд 23Типичные реакции кислотных оксидов
1) Кислотный оксид + вода = кислота
Например: P2O5
Эта реакция протекает только в том случае, если
кислотный оксид растворим в воде.
Слайд 29Обобщение темы:
Вопрос-ответ:
Что такое оксиды?
Какие оксиды называются основными?
В каком случае кислотный оксид
Слайд 30Обобщение темы:
Тест: «Правильный ответ»
1) Какой из оксидов несолеобразующий:
а) P2O5
в) SO3 г) CaO
2) Какой из предложенных оксидов кислотный:
а) K2O б) MgO
в) CO2 г) Na2O
3) Какой класс соединений образуется при взаимодействии кислотного оксида с водой:
а) кислота б) основание
в) соль г) соль и основание
Слайд 31Ответы на вопросы:
1) Оксиды – это сложные вещества, состоящие из двух
2) Основные оксиды – это такие оксиды, которым соответствуют основания.
3) Кислотный оксид взаимодействует с водой только в том случае, если кислотный оксид растворим в воде.
Слайд 32Использованные источники информации
Габриелян О.С., Остроумов И.Г. Химия для профессий
Интернет - сайты
www.hemi.wallst.ru ;
www. alhimikov. Net;
www.chem.msu.su ;
www.enauki.ru;
www.1september.ru;