- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Окислительно-восстановительные реакции.Метод электронного баланса (9 класс)
Содержание
- 1. Презентация по химии на тему Окислительно-восстановительные реакции.Метод электронного баланса (9 класс)
- 2. Слайд 2
- 3. Моделировать проставление СО.Формулировать определение СО, окисление,
- 4. Na2O, O2, NaCl, H2O, CO2, Ca, Al2S3,
- 5. H2SO4, H2CO3, H3PO4, HNO3, Задание №2. Определите степень окисления элементов в следующих соединениях:H2+C+4O3-2, H3+P+5O4-2 ,H+N+3O2-2,
- 6. Ребята, берегите зрение!Ребята, берегите зрение!
- 7. Мир окислительно – восстановительных реакций
- 8. Окислительно – восстановительные реакции - уже само
- 9. Что нужно человеку для жизни? Воздух и
- 10. Как приятно летом прогуляться по лесу или
- 11. Любите кефир, сметану, сыр , йогурт? Это
- 12. Если мы замерли, или хотим приготовить еду,
- 13. Растениям очень необходим азот. Несмотря на то,
- 14. А это узнали? Гальванический элемент, или проще
- 15. Окислительно – восстановительные реакции - уже само название наводит тоску, что уж говорить про уравнения.
- 16. По изменению степеней окисления химических элементов химические
- 17. Сu О + 2 HCl → CuCl2
- 18. CuO + CO → Cu + CO2+2-2+2-20+4-2
- 19. Составление уравнений окислительно - восстановительных реакций методом электронного баланса
- 20. Определить СО элементов до и после реакции.Определить,
- 21. Al + S →
- 22. Восстановитель – атом элемента,
- 23. …Окислитель как отъявленный злодейКак пират, бандит, агрессор,
- 24. Слайд 24
- 25. Извержение вулкановS + O2 → SO2Задание № 5. Составьте и уравняйте реакцию методом электронного баланса
- 26. МолнияN2 + O2 → NOЗадание № 6. Составьте и уравняйте реакцию методом электронного баланса
- 27. Взрывчатые веществаP + KClO3 → P2O5 +
- 28. Используя метод электронного баланса, расставьте коэффициенты в
- 29. Рефлексия 1.Какова цель нашего урока?2.Достигли ли мы
- 30. Разобрать и выучить конспект.Выполнить упр. кл.работыПрезентация BNM на сайте «Инфоурок» Домашнее задание
- 31. Благодарю за внимание!
Слайд 3Моделировать проставление СО.
Формулировать определение СО, окисление,
восстановление.
3.Применять полученные знания на
4.Моделировать понятие ОВР.
5.Решать ОВР методом электронного баланса.
6.Определять значимость ОВР в жизни.
7.Осуществлять рефлексию своей деятельности.
В результате изучения темы, вы будете способны:
Слайд 4Na2O, O2, NaCl, H2O, CO2, Ca, Al2S3, BaCl2.
Задание №1. Определите
Na2+O-2, O20, Na+Cl-, C+4O2-2, Ca0, Al2+3S-2 , Ba+2O-2.
Слайд 5H2SO4, H2CO3, H3PO4, HNO3,
Задание №2. Определите степень окисления элементов в
H2+C+4O3-2,
H3+P+5O4-2 ,
H+N+3O2-2,
Слайд 8Окислительно – восстановительные
реакции - уже само название наводит тоску,
что
А если отвлечься от уроков и посмотреть вокруг? Каждый день мы встречаемся с тысячами окислительно- восстановительных реакций и
даже не задумываемся какую роль они
играют в нашей жизни. Без этих реакций невозможно наше существование.
Слайд 9Что нужно человеку для жизни? Воздух и еда. Мы поглощаем пищу
Слайд 10Как приятно летом прогуляться по лесу или парку. Вокруг так много
Взвесьте это растение и отдельно землю,
в которой оно росло, и вы увидите, что масса земли не изменилась, в то время как масса растения увеличилась.
Откуда она взялась? Не удивляйтесь. Это тоже благодаря окислительно – восстановительной реакции -фотосинтезу.
В процессе фотосинтеза образуется так необходимый нам кислород и углеводы - строительный материал растений.
Слайд 11Любите кефир, сметану, сыр , йогурт? Это тоже продукты окислительно –
Слайд 12Если мы замерли, или хотим приготовить еду, то зажигаем огонь. Реакция
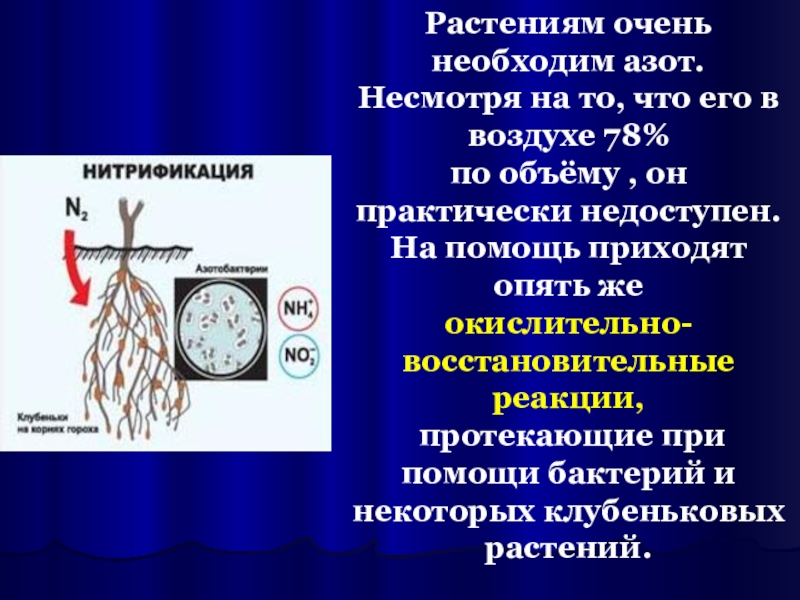
Слайд 13Растениям очень необходим азот.
Несмотря на то, что его в воздухе
по объёму , он практически недоступен.
На помощь приходят опять же
окислительно-восстановительные реакции,
протекающие при помощи бактерий и
некоторых клубеньковых растений.
Слайд 14А это узнали? Гальванический элемент, или проще – батарейка. С помощью
Слайд 15Окислительно – восстановительные
реакции - уже само название наводит тоску,
что
Слайд 16По изменению степеней окисления химических элементов химические реакции делят на две
Окислительно-восстановительные
Не окислительно - восстановительные
Слайд 17Сu О + 2 HCl → CuCl2 + H2O
+2
-2
+1
-1
+2
-1
+1
-2
Химические
относятся к не окислительно-восстановительным
реакциям.
В этой химической реакции СО
химических элементов в исходных веществах и
в продуктах реакции не изменяются
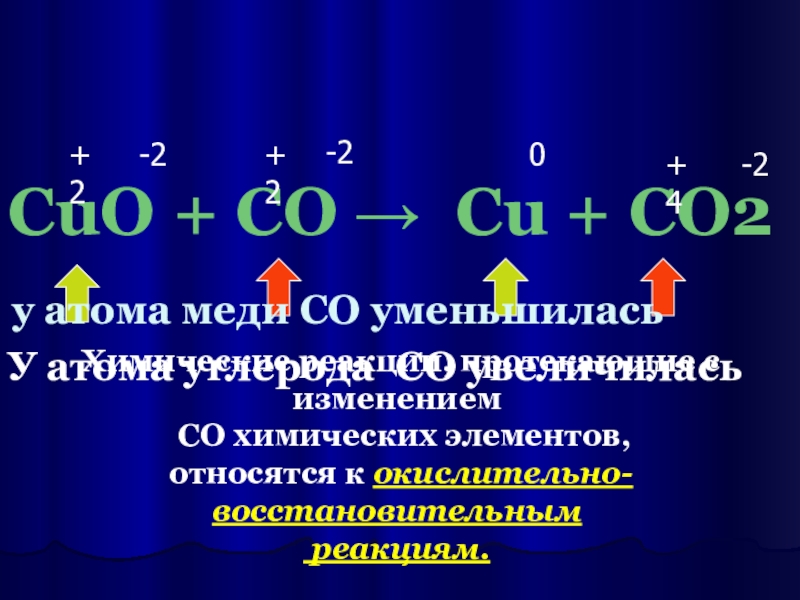
Слайд 18CuO + CO → Cu + CO2
+2
-2
+2
-2
0
+4
-2
Химические реакции, протекающие c
СО химических элементов,
относятся к окислительно-восстановительным
реакциям.
у атома меди СО уменьшилась
У атома углерода СО увеличилась
Слайд 20Определить СО элементов до и после реакции.
Определить, является реакция окислительно-восстановительной или
Подчеркнуть элементы, степени окисления которых изменяются.
Электронный баланс осуществляем в той части, где:
Есть больше веществ
Если одинаково, то пишем переход в правой части уравнения
Если до реакции есть окислители –O2 ; Cl2 ; Br2 ; F2 ; I2; или восстановитель H2,то переход пишем в левой части.
5. С помощью стрелок показываем переход :
Если CO элемента повышается ,то атом наоборот отдает электроны
Если CO элемента понижается ,то атом наоборот принимает электроны
Находим НОК отданных и принятых электронов
Чтобы расставить коэффициенты НОК делим на число отданных и принятых е
Расставляем оставшиеся коэффициенты
Записываем процессы
Алгоритм составления ОВР
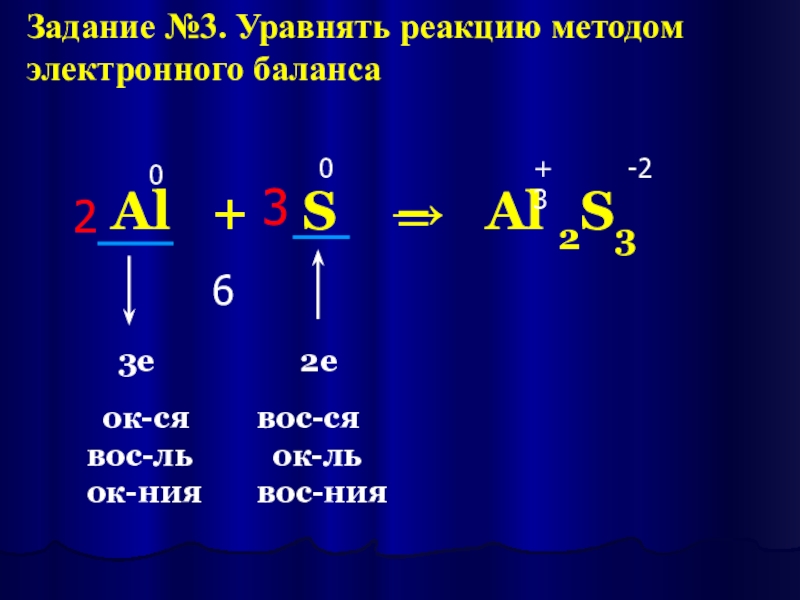
Слайд 21Al + S → Al 2S3
0
0
+3
-2
6
ок-ся
вос-ль
ок-ния
2
3
Задание
3е
2е
=
вос-ся
ок-ль
вос-ния
Слайд 22 Восстановитель – атом элемента, который отдает
NB!
Окислитель – атом элемента,
который принимает электроны.
Процесс окисления – это процесс отдачи электронов.
Процесс восстановления – это процесс принятия электронов.
Слайд 23…Окислитель как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Отнимает электроны - и
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает
И ущерб не возмещает…
Слайд 24 Лесные пожары
C + O2
Задание № 4. Составьте и уравняйте реакцию методом электронного баланса
Слайд 25Извержение вулканов
S + O2 → SO2
Задание № 5. Составьте и уравняйте
Слайд 27Взрывчатые вещества
P + KClO3 → P2O5 + KCl
Задание № 7*. Составьте
Слайд 28Используя метод электронного баланса, расставьте коэффициенты в уравнении химической реакции:
AL +HCL
Определите окислитель и восстановитель.
Задание № 8*.
Слайд 29Рефлексия
1.Какова цель нашего урока?
2.Достигли ли мы цели?
3.Что представляло
наибольшую трудность?
4. На
5.Своей работой на уроке я…
6.Урок для меня показался…
7. Материал урока мне был…
8. Мое настроение…
Слайд 30
Разобрать и выучить конспект.
Выполнить упр. кл.работы
Презентация BNM на сайте «Инфоурок»
Домашнее задание