- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Окислительно-восстановительные реакции в органической химии
Содержание
- 1. Презентация по химии на тему Окислительно-восстановительные реакции в органической химии
- 2. СодержаниеОкислительно-восстановительные реакции в органикеСтепень окисления в органической химииМетод электронного балансаМетод полуреакций
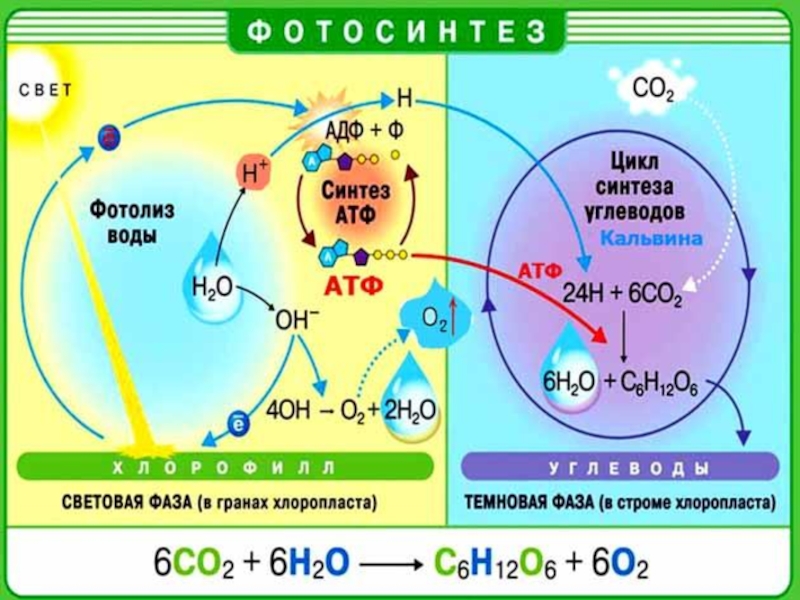
- 3. Окислительно-восстановительные реакции в органике Сгорание топлива
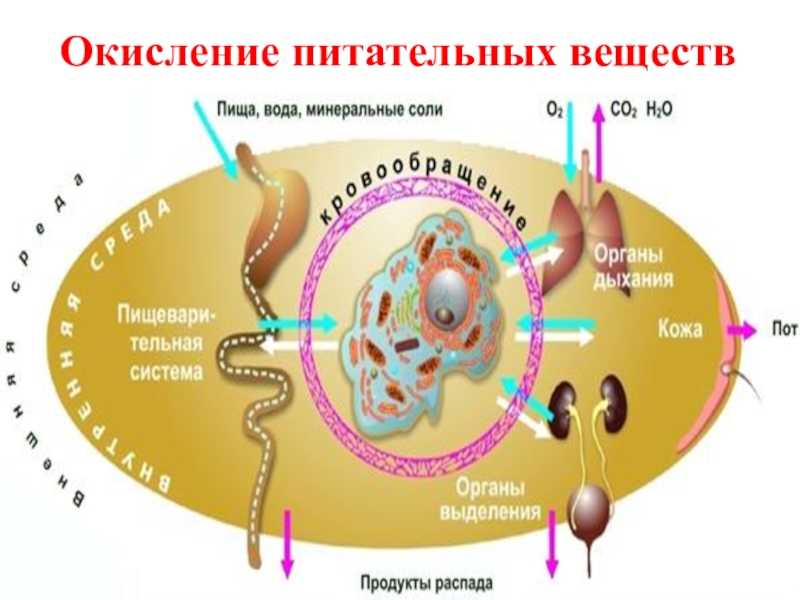
- 4. Окисление питательных веществ
- 5. Слайд 5
- 6. Порча пищевых продуктов
- 7. Степень окисления в органической химииВ неорганической химии
- 8. Слайд 8
- 9. Определение степени окисления в органических соединениях алгебраическим
- 10. Определение степени окисления в органических соединениях графическим
- 11. Определение степени окисления в органических соединениях графическим
- 12. Определение степени окисления в органических соединениях графическим
- 13. Определение степени окисления в органических соединениях графическим
- 14. Определение степени окисления в органических соединениях графическим
- 15. Определение степени окисления в органических соединениях графическим
- 16. Окислительно-восстановительные реакции с участием органических веществ, их
- 17. 2.Мягкое окисление В этом случае не происходит
- 18. 3.Деструктивное окисление. Происходит в более жестких условиях,
- 19. Деструкция (разрыв углеродной цепи) происходит у алкенов
- 20. Если при деструкции оторвался фрагмент содержащий 1
- 21. Подбор коэффициэнтов в уравнениях ОВР методом электронного
- 22. Горение бутана0+4 -2+ -214124264226окислениевосстановление52
- 23. Окисление фенилацетилена водным раствором перманганата калия при
- 24. Окисление бутена-1 водным раствором перманганата калия при
- 25. Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду (реакция Вагнера). 2
- 26. Реакция окисления глюкозы перманганата калия в кислой
- 27. Реакция окисления глюкозы перманганата калия в кислой
- 28. Преимущества метода полуреакций 1.Рассматриваются реально существующие ионы:
- 29. Метод полуреакцийНаписать молекулярную схему реакцииСоставить полное ионное
- 30. Метод полуреакцийА).если реакция протекает в кислой среде(Н+
- 31. Реакция окисления этилена раствором перманганата калия в
- 32. Реакция окисления этилена раствором перманганата калия в
- 33. Реакция окисления глюкозы перманганата калия в кислой
- 34. Первая полуреакция: C6H12O6 +6H2O → 6CO2+24H+ Посчитать заряды левой
- 35. Вторая полуреакция:
- 36. 5. Итак, мы получили два электронно-ионных уравнения.
- 37. Найденные коэффициенты подставляем в исходное уравнение: 5 C6H12O6
- 38. 5С12Н16О2+ 22KMnO4 +
- 39. Упражнения. Расставьте коэффициенты методом электронного баланса:а) С6Н5С2Н5+
- 40. Упражнения. Расставьте коэффициенты методом электронного баланса в
- 41. Задания для самостоятельной работы Закончите
- 42. Литература Карцова А.А, Левкин А. Н. Окислительно-восстановительные
Слайд 1Окислительно-восстановительные реакции в органической химии
Г.Нижний Новгород
МБОУ «Школа №77»
Учитель химии Баранова
Слайд 2Содержание
Окислительно-восстановительные реакции в органике
Степень окисления в органической химии
Метод электронного баланса
Метод полуреакций
Слайд 7Степень окисления в органической химии
В неорганической химии степень окисления – одно
Слайд 8 Для органической химии важна
Степень окисления в органической химии
С→ - смещение электронной плотности от углерода на более электроотрицательный атом
→ С - смещение электронной плотности на углерод
Слайд 9Определение степени окисления в органических соединениях алгебраическим методом
1.Алгебраический способ
- 4 +
Метан СН4,
- 2 + -2 +
метиловый спирт СНзОН,
0 + -2
формальдегид СН2О,
+ +2 -2 -2 +
муравьиная кислота НСООН
Слайд 10Определение степени окисления в органических соединениях графическим методом
1) изображается полная
2) по каждой связи стрелкой показывается смещение электронаов к наиболее электроотрицательному элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома – столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим несколько примеров:
2. Графический метод:
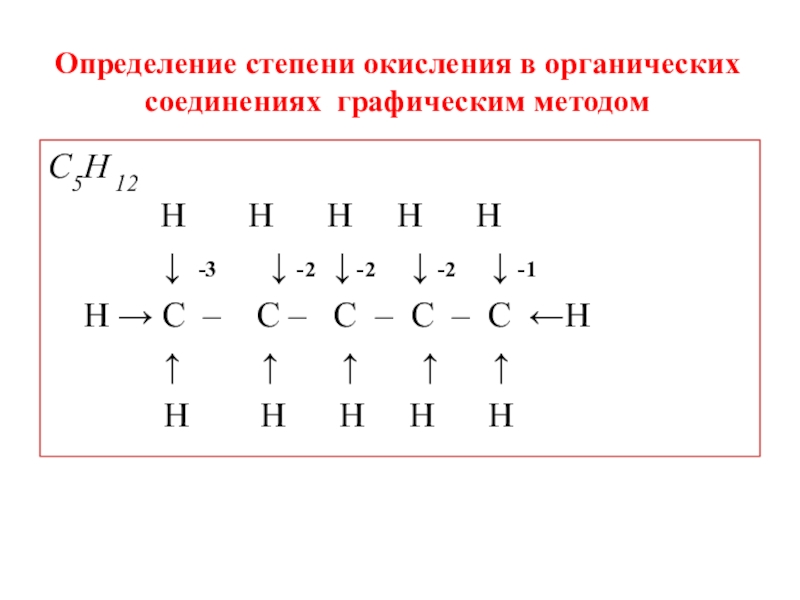
Слайд 11Определение степени окисления в органических соединениях графическим методом
C5H 12
↓ -3 ↓ -2 ↓ -2 ↓ -2 ↓ -1
Н → С – С – С – С – С ←Н
↑ ↑ ↑ ↑ ↑
Н Н Н Н Н
Слайд 12Определение степени окисления в органических соединениях графическим методом
Н
↓ -3 +1
Н → С – С => О
↑ ↑
Н Н
Слайд 13Определение степени окисления в органических соединениях графическим методом
CH3 – CH2
Н Н
↓ -1 ↓ -3
Н → С – С ← Н
↓ ↓
ОН Н
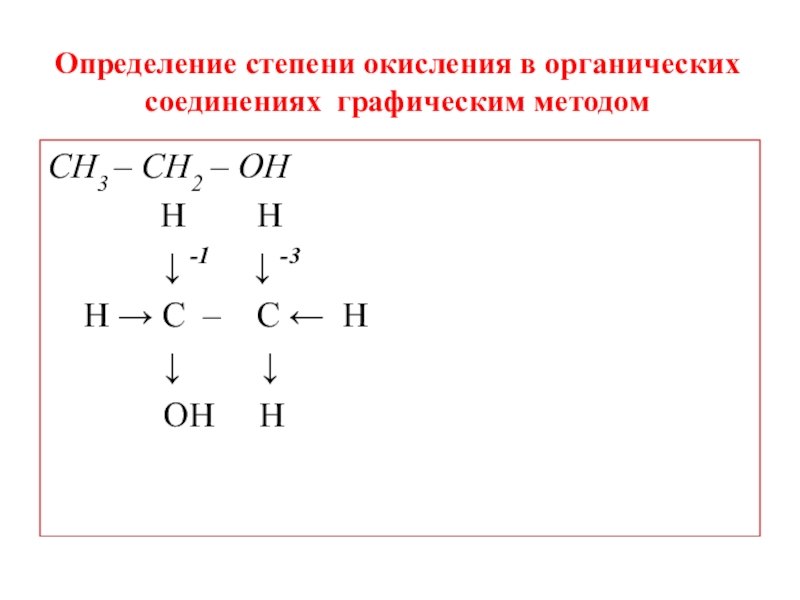
Слайд 14Определение степени окисления в органических соединениях графическим методом
СН3 СООН
↓-3 +3
Н → С – С => О
↑ ↓
Н ОН
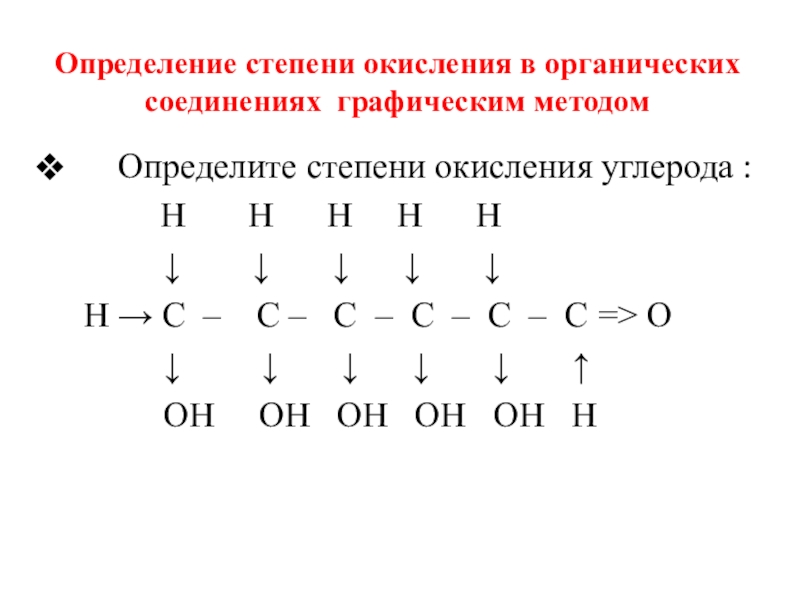
Слайд 15Определение степени окисления в органических соединениях графическим методом
Определите
Н Н Н Н Н
↓ ↓ ↓ ↓ ↓
Н → С – С – С – С – С – С => О
↓ ↓ ↓ ↓ ↓ ↑
ОН ОН ОН ОН ОН Н
Слайд 16Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов
1. Полное
Слайд 172.Мягкое окисление
В этом случае не происходит разрыва углеродной цепи. К
Слайд 183.Деструктивное окисление.
Происходит в более жестких условиях, чем мягкое окисление, сопровождается
Слайд 19Деструкция (разрыв углеродной цепи)
происходит у алкенов и алкинов – по
Слайд 20Если при деструкции оторвался фрагмент
содержащий 1 атом углерода, то он
Слайд 21Подбор коэффициэнтов в уравнениях ОВР методом электронного баланса
При составлении уравнений ОВР,
Слайд 23
Окисление фенилацетилена водным раствором перманганата калия при нагревании.
С6Н5-С0≡С-1Н + KMn+7O4 →
С 0 – 3е → С+3
восстановитель С -1– 5е → С+4
окислитель Mn+7 + 3е → Mn+4 3 8
Восстановление
3С6Н5-С0≡С-1Н + 8KMn+7O4 → 3С6Н5-С+3ООК + 8Mn+4O2 + 2К2С+4О3 + КНС+4О3 + H2O
8
3
Окисление
Слайд 24Окисление бутена-1 водным раствором перманганата калия при нагревании.
C-3H3-C-2H2-C-1H=C-2H2 + KMn+7O4
С2Н5-С+3ООК + Mn+4O2 + KOH+ К2С+4О3 + H2O
С -1 – 4е → С+3
Восстановитель С -2 – 6е → С+4 10 3
Окисление
окислитель Mn+7 + 3е → Mn+4 3 10
Восстановление
3C-3H3-C-2H2-C-1H=C-2H2 + 10KMn+7O4 →
3С2Н5-С+3ООК + 10Mn+4O2 + KOH+ 3К2С+4О3 +H2O
Слайд 25Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду
2
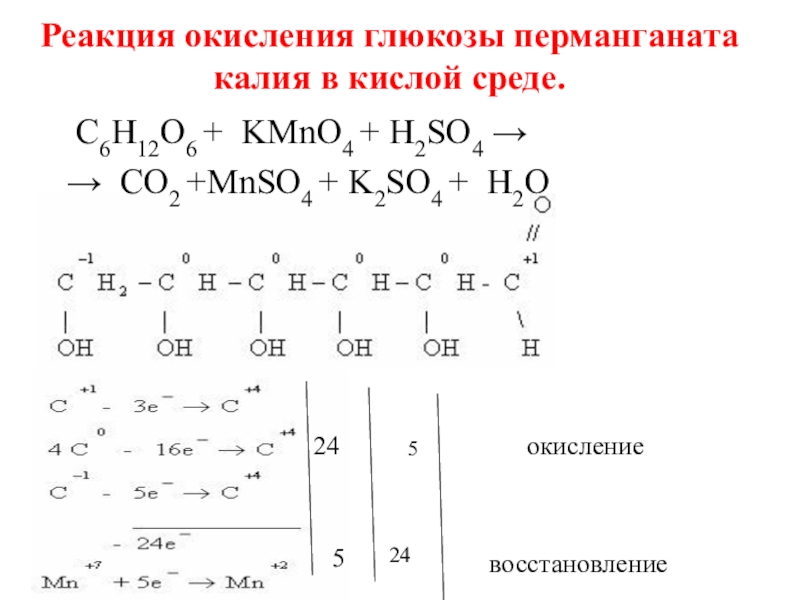
Слайд 26Реакция окисления глюкозы перманганата калия в кислой среде.
24
5
5
24
окисление
восстановление
C6H12O6 + KMnO4
→ CO2 +MnSO4 + K2SO4 + H2O
Слайд 27Реакция окисления глюкозы перманганата калия в кислой среде.
5 C6H12O6 +24 KMnO4
→ 30 CO2 +24MnSO4 +12 K2SO4 + 66 H2O
Слайд 28Преимущества метода полуреакций
1.Рассматриваются реально существующие ионы: MnO4-; Mn2+, и вещества
2.Не нужно знать все получающиеся вещества, они появляются при его выводе.
3.При использовании этого метода нет необходимости определять степени окисления атомов отдельных элементов, что особенно важно в случае ОВР, протекающих с участием органических соединений, для которых подчас очень сложно сделать это.
4.Этот метод дает не только сведения о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
5. Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Слайд 29Метод полуреакций
Написать молекулярную схему реакции
Составить полное ионное уравнение(все растворимые вещества раскладываем
3.Составить сокращённое ионное уравнение реакции.
4.Выписать отдельно ионы и молекулы, изменившие свой состав или заряд , и ионы, определяющие среду
5. Составить для них полуреакции (электронно-ионные уравнения) процессов окисления и восстановления с учётом среды,соблюдая 2 закона : закон сохранения массы и закон сохранения заряда
Слайд 30Метод полуреакций
А).если реакция протекает в кислой среде(Н+ и Н2О) ,
Б). если реакция протекает в щелочной среде,то в ту часть полуреакции, где не хватает кислорода, добавить ОН- , в противоположную - Н2О(ОН- и Н2О )
В). если реакция протекает в нейтральной среде, ни ионов Н+, ни ОН- в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
6. Найти НОК отданных и принятых электронов и множители для каждой полуреакции
7.Умножить каждый член полуреакции и сложить их. Привести подобные члены и полученные коэффициенты перенести в молекулярное уравнение
Слайд 31Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду
C2H4 + KMnO4 + H2O → CH2OH–CH2OH + MnO2 + KOH
C2H4 + 2K+ +2MnO4 - + 2H2O → CH2OH–CH2OH + 2MnO2 + 2K++ 2OH-
C2H4 +2MnO4 - + 2H2O → CH2OH–CH2OH + 2MnO2 + 2OH-
Вос-ль
Ок-ль
Слайд 32
Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду
3C2H4 + 6H2O-6е- + 2MnO4 - + 4H2O + 6е- → 3C2H4 (OH)2 +6Н+ + 2MnO2 + 8OH-
3C2H4 + 10H2O+ 2MnO4 - → 3C2H4 (OH)2 + 6 H2O + 2MnO2 + 2OH-
3C2H4 + 4H2O+ 2MnO4 - → 3C2H4 (OH)2 + 2MnO2 + 2OH-
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH
4
Слайд 33Реакция окисления глюкозы перманганата калия в кислой среде.
C6H12O6+ KMnO4+ H2SO4
П.и.у : C6H12O6+K++MnO4-+2H++SO42- → CO2+Mn2++SO42-+2K++SO42-+H2O
С.и.у. :
C6H12O6 +MnO4-+2H+ → CO2+Mn2++H2O
Слайд 34 Первая полуреакция:
C6H12O6 +6H2O → 6CO2+24H+
Посчитать заряды левой и правой частей схемы:
C6H12O6
0 +24
Они различны. Это связано с переходом электронов. Слева происходит отдача 24 электронов. Глюкоза окисляется , является восстановителем
Слайд 35 Вторая полуреакция:
MnO4-+H+ +5e
Для того чтобы связать четыре атома кислорода в молекулах воды, требуется 8 ионов H+:
MnO4-+8H+ → Mn2++4H2O
Посчитаем заряды левой и правой частей схемы:
MnO4-+8H+ → Mn2++4H2O
+7 +2
Изменение заряда системы от +7 до +2 связано с принятием 5 электронов (восстановление). Электроны принял ион MnO4-. Этот ион является окислителем.
Слайд 36 5. Итак, мы получили два электронно-ионных уравнения. Запишем их вместе:
MnO4-+8H++5e →
C6H12O6 +6H2O-24e → 6CO2+24H+ 24
Уравниваем число отданных и принятых электронов, найдя дополнительные множители. Теперь умножаем каждое уравнение на свой множитель и одновременно складываем их. Получаем:
24MnO4-+192 H+ + 120 е + 5C6H12O6+ 30H2O -120 е → 24Mn2++ 96H2O + 30CO2 +120H+
Приводим подобные члены (H2O и H+ )
5C6H12O6+24MnO4-+72 H+ → 30CO2+ 24Mn2++66H2O
120
24
5
Слайд 37
Найденные коэффициенты подставляем в исходное уравнение:
5 C6H12O6 +24 KMnO4 +36 H2SO4
→ 30 CO2 +24MnSO4 +12 K2SO4 + 66 H2O
Слайд 39Упражнения. Расставьте коэффициенты методом электронного баланса:
а) С6Н5С2Н5+ KMnO4+ H2SO4→ С6Н5СООН +
в) C12H22O 11+ K2Cr2O7+ H2SO 4→
→CO2 + Cr2 (SO4)3 + K2SO4+ H2O.
Слайд 40Упражнения.
Расставьте коэффициенты методом электронного баланса в уравнениях реакций:
б) С3Н8 + О2
Слайд 41Задания для самостоятельной работы
Закончите УХР и расставьте коэффициенты
CH3-CH=CH-CH3 + KMnO4 + H2SO4 →
CH3-CH=CH-CH3 + KMnO4 + H2О →
(CH3)2C=C-CH3 + KMnO4 + H2SO4 →
CH3-CH2-CH=CH2 + KMnO4 + H2SO4 →
СH3-CH2-C≡C-CH3 + KMnO4 + H2SO4 →
C6H5-CH3 + KMnO4+ H2O →
C6H5-CH2 CH 3 + KMnO4 + H2SO4 →
C6H5-CH3 + KMnO4 + H2SO4 →
Слайд 42Литература
Карцова А.А, Левкин А. Н. Окислительно-восстановительные реакции в органической химии //
Матч Дж. Органическая химия. Реакции, механизмы и структура: В 4т./ Пер. с англ.- М.: Мир, 1987-1988.
3. Хомченко Г.П., Савостьянова К.И. Окислительно-восстановительные реакции: Пособие для учащихся . М.- : Просвещение , 1980.