- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Обратимость химических реакций
Содержание
- 1. Презентация по химии на тему Обратимость химических реакций
- 2. Главное глазами не увидишь.
- 3. ЭпиграфБытие и небытие порождают друг друга, трудное
- 4. Проклассифицируйте реакции, используя различные признаки1. SO2 +H2O
- 5. 2SO2 + O2 2SO32NO + O2
- 6. НЕОБРАТИМЫЕ РЕАКЦИИ - это реакции, протекающие в данных
- 7. Обратимые реакции – это реакции, протекающие в данных
- 8. Обратимые физические процессы конденсация H2O (ж)
- 9. Обратимая химическая реакция СО2(водн.) + Н2О ⮀
- 10. Понятие «равновесие»Равновесие – это устойчивое соотношение между чем-либо.(С.И. Ожегов. Толковый словарь.)
- 11. Слайд 11
- 12. СХЕМА ВЗАИМОДЕЙСТВИЯ ПЯТИ ЭЛЕМЕНТОВ (СТИХИЙ) МИРОЗДАНИЯ (ВОСТОЧНАЯ ФИЛОСОФИЯ ФЭН-ШУЙ)ДЕРЕВОМЕТАЛЛВОДАЗЕМЛЯОГОНЬ
- 13. Равновесие в изобразительном искусстве - БАЛАНСВ.М. Васнецов «Богатыри»
- 14. Равновесие в музыке – ГАРМОНИЯ
- 15. Равновесие в природеЖЕРТВАХИЩНИКЦВЕТОЧНЫЕРАСТЕНИЯРАСТЕНИЯНАСЕКОМЫЕ-ОПЫЛИТЕЛИРАСТИТЕЛЬНОЯДНЫЕЖИВОТНЫЕ
- 16. Химическое равновесие -динамическое состояние химической системы, когда
- 17. Количественной характеристикой химического равновесия служит константа равновесия:
- 18. Гомогенная реакция N2 + 3H2 ⮀
- 19. Гетерогенная реакция CO2 + C(тв)
- 20. Константа химического равновесия зависит от природы реагентов
- 21. По значению констант равновесия можно судить о
- 22. Нарушение химического равновесияСмещение равновесия – переход из
- 23. Принцип Ле Шателье 1885гАнри Ле Шателье1850 -
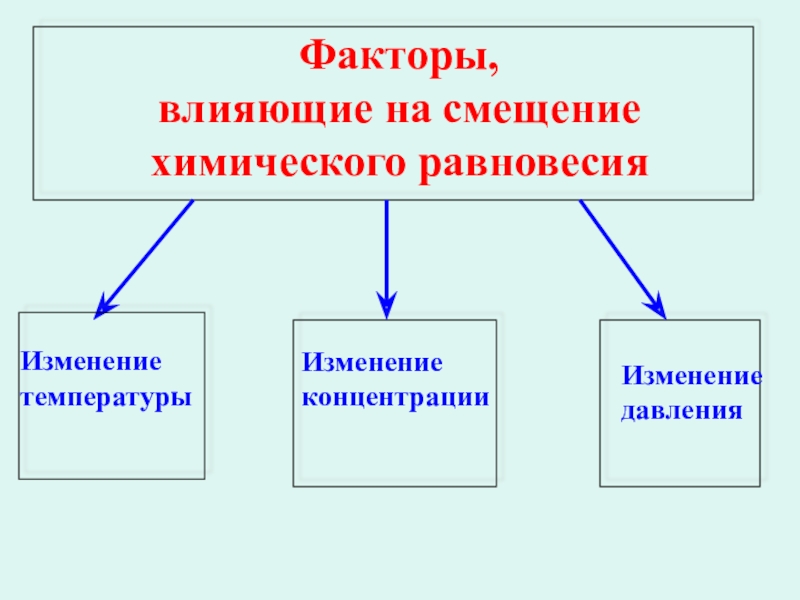
- 24. Факторы, влияющие на смещение химического равновесия
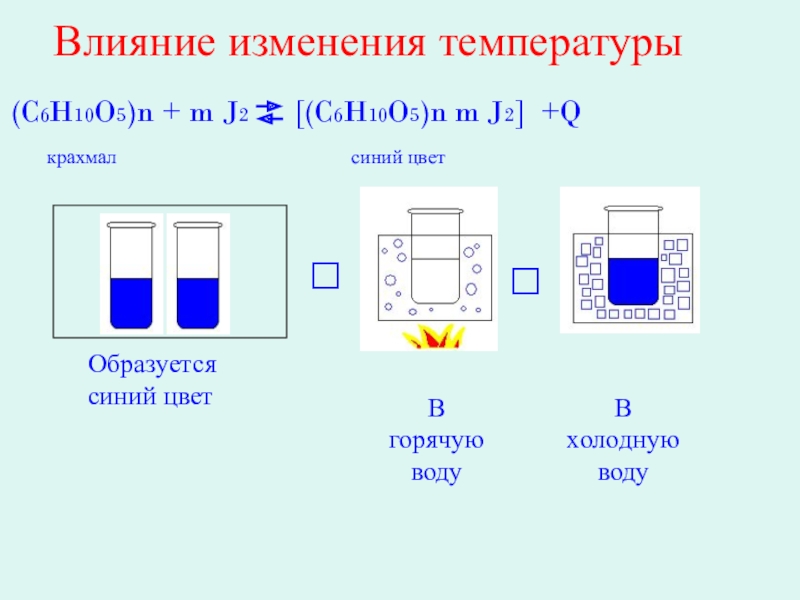
- 25. 1. Влияние изменения температуры N2 + 3H2
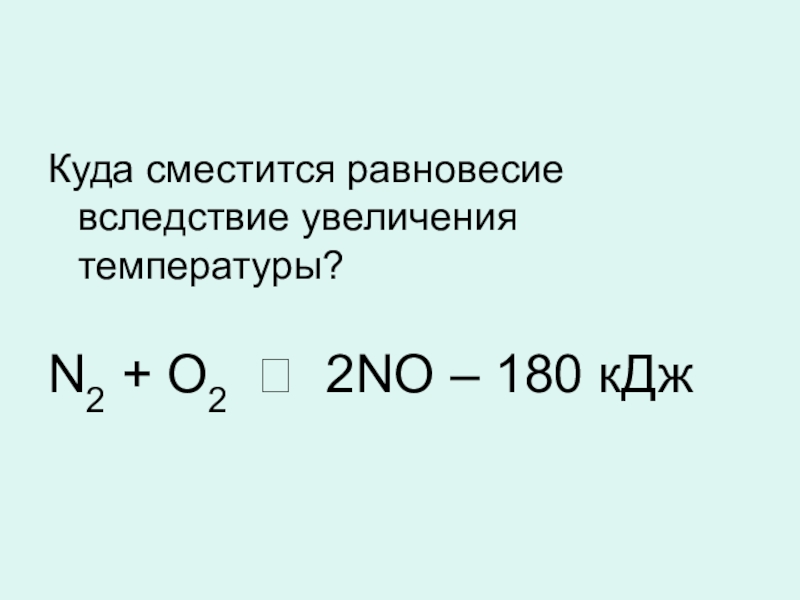
- 26. Куда сместится равновесие вследствие увеличения температуры? N2 + O2 ⮀ 2NO – 180 кДж
- 27. ??Влияние изменения температуры
- 28. 2. Влияние изменения давленияN2 (г.) + 3H2
- 29. Влияние изменения давленияКуда сместится равновесие в результате
- 30. Влияние изменения давленияПри увеличении давления равновесие смещается в сторону меньшего объема газообразных веществ, и наоборот.
- 31. 3. Влияние изменения концентрации веществaA + bB
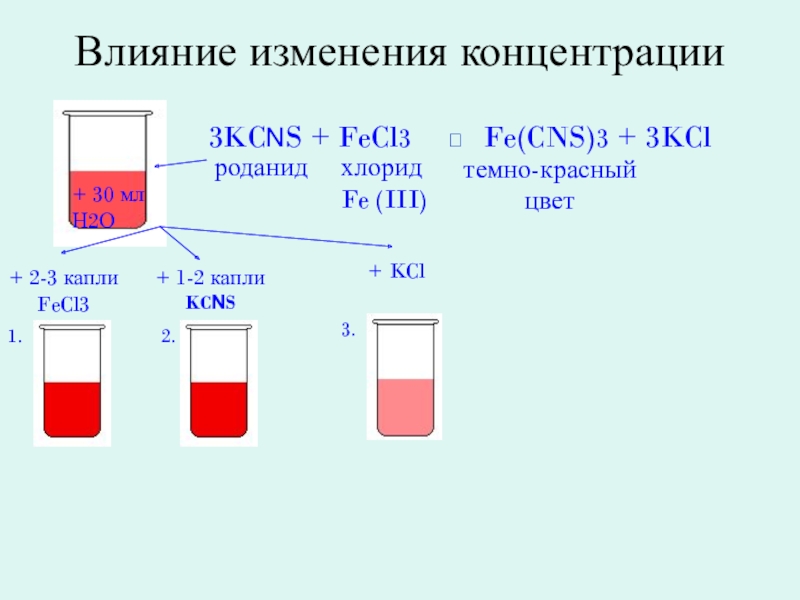
- 32. Влияние изменения концентрации+ 2-3 капли FeCl3+ 1-2 капли KCNS + KCl
- 33. ВЫВОДЫ При увеличении концентрации исходных веществ химическое
- 34. Условия смещения химического равновесия в сторону прямой
- 35. В приведенных системах установилось состояние химического равновесия.
- 36. 1) СО2 (г.) + С ⮀
- 37. 2) 3NО2 (г.) + Н2О ⮀
- 38. 3) CO (г.) + CI 2 (г.)
- 39. 4) 2 SO2 (г.) + О2 (г.)
- 40. Мы изучили обратимость химических реакций, химическое равновесие
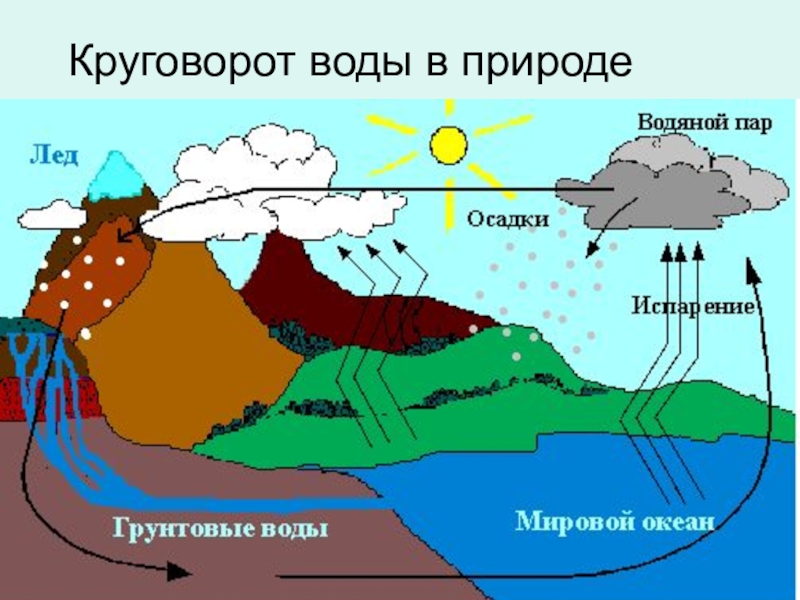
- 41. Круговорот воды в природе
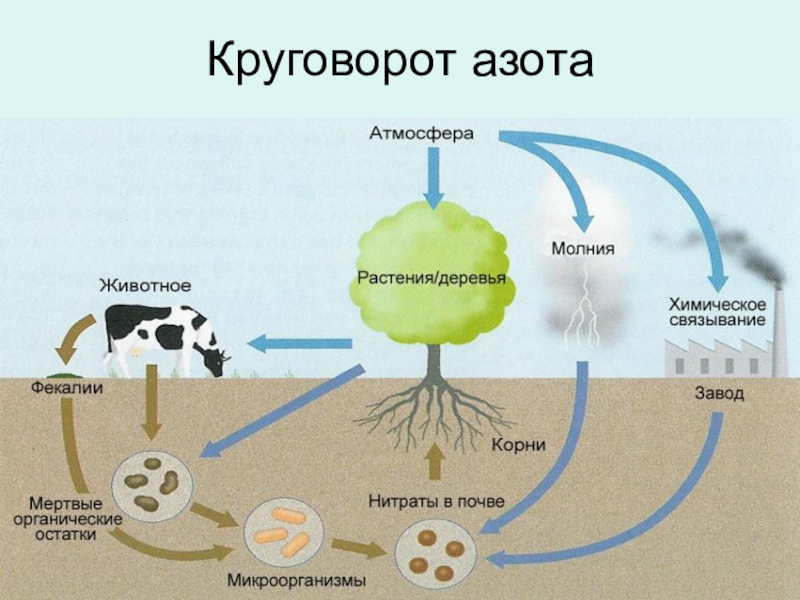
- 42. Круговорот азота
- 43. СИНКВЕЙН1. Назовите самое главное слово
- 44. ЖЕЛАЮ ВАМ ДУШЕВНОГО РАВНОВЕСИЯ!
Слайд 2Главное глазами не увидишь.
Цель урока. Изучить обратимость химических реакций, химическое равновесие
и условия его смещения.
Слайд 3Эпиграф
Бытие и небытие порождают друг друга, трудное и лёгкое создают друг
Лао-цзы
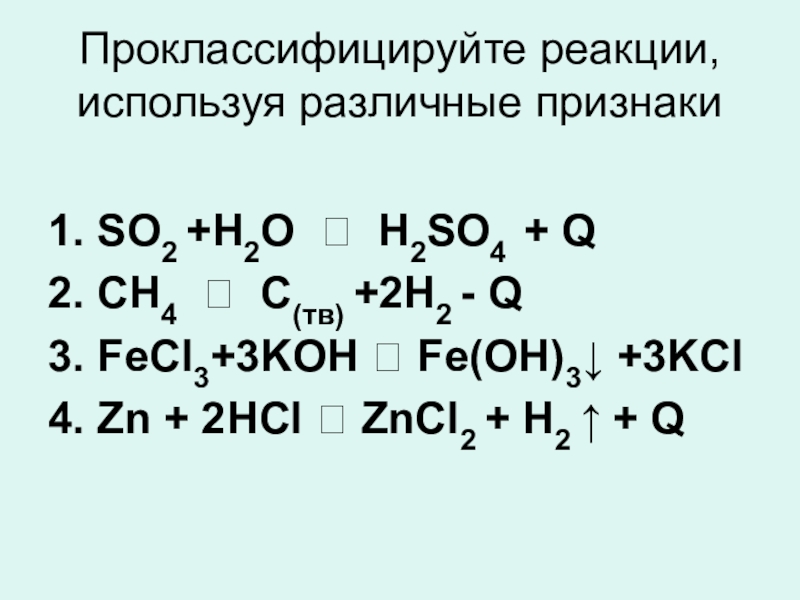
Слайд 4Проклассифицируйте реакции, используя различные признаки
1. SO2 +H2O ⮀ H2SO4 + Q
2.
3. FeCl3+3KOH ⭢ Fe(OH)3↓ +3KCl
4. Zn + 2HCl ⭢ ZnCl2 + H2 ↑ + Q
Слайд 52SO2 + O2 2SO3
2NO + O2 2NO2
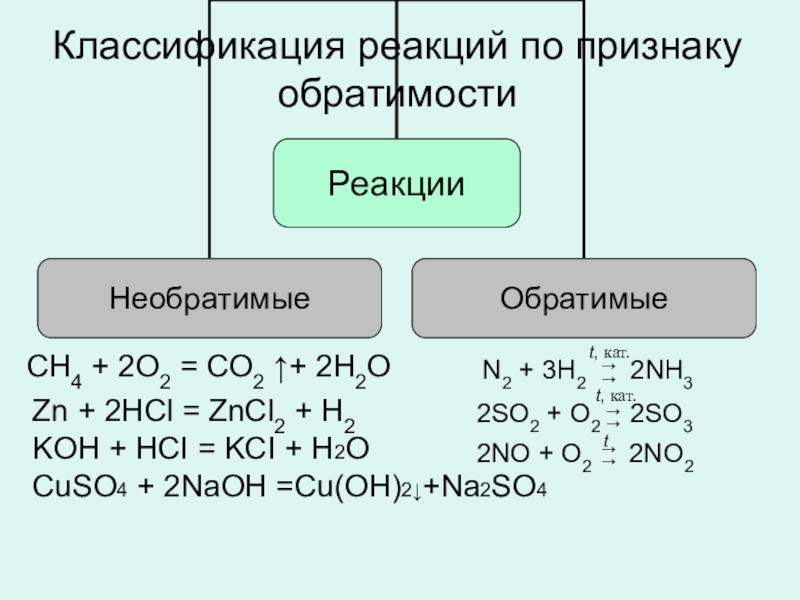
Классификация реакций
CH4 + 2O2 = CO2 ↑+ 2H2O
N2 + 3H2 2NH3
t, кат.
Zn + 2HCl = ZnCl2 + H2
KOH + HCI = KCI + H2O
CuSO4 + 2NaOH =Cu(OH)2↓+Na2SO4
t, кат.
t
Слайд 6НЕОБРАТИМЫЕ РЕАКЦИИ
- это реакции, протекающие в данных условиях только в одном
К ним можно отнести все реакции
обмена, сопровождающиеся образованием
осадка
газа
малодиссоциирующего вещества (воды)
и все реакции горения
Слайд 7Обратимые реакции
– это реакции, протекающие в данных условиях одновременно в двух
В органической химии признак обратимости отражают названия антонимы процессов:
Гидрирование – дегидрирование
Гидратация – дегидратация
Полимеризация – деполимеризация
Обратимы все реакции этерификации (противоположный процесс носит название гидролиза)и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма – обмена веществ.
Слайд 8Обратимые физические процессы
конденсация
H2O (ж) ⮀ H2O
испарение
выделение из раствора
СО2 (г) ⮀ СО2 (водн)
растворение
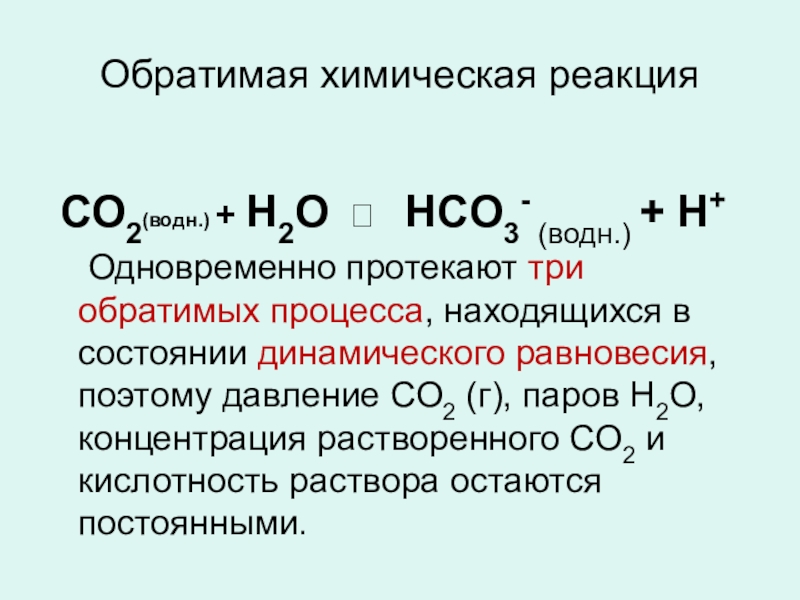
Слайд 9Обратимая химическая реакция
СО2(водн.) + Н2О ⮀ HCO3- (водн.) +
Одновременно протекают три обратимых процесса, находящихся в состоянии динамического равновесия, поэтому давление СО2 (г), паров Н2О, концентрация растворенного СО2 и кислотность раствора остаются постоянными.
Слайд 10Понятие «равновесие»
Равновесие – это устойчивое соотношение между чем-либо.
(С.И. Ожегов.
Толковый словарь.)
Слайд 12СХЕМА ВЗАИМОДЕЙСТВИЯ
ПЯТИ ЭЛЕМЕНТОВ (СТИХИЙ) МИРОЗДАНИЯ
(ВОСТОЧНАЯ ФИЛОСОФИЯ ФЭН-ШУЙ)
ДЕРЕВО
МЕТАЛЛ
ВОДА
ЗЕМЛЯ
ОГОНЬ
Слайд 15Равновесие в природе
ЖЕРТВА
ХИЩНИК
ЦВЕТОЧНЫЕ
РАСТЕНИЯ
РАСТЕНИЯ
НАСЕКОМЫЕ-
ОПЫЛИТЕЛИ
РАСТИТЕЛЬНОЯДНЫЕ
ЖИВОТНЫЕ
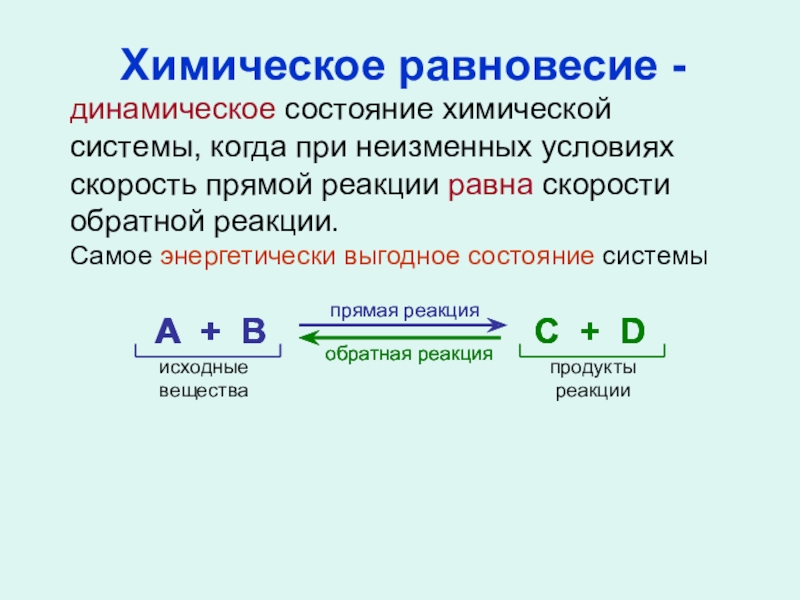
Слайд 16Химическое равновесие -
динамическое состояние химической системы, когда при неизменных условиях скорость
Самое энергетически выгодное состояние системы
А + В
С + D
прямая реакция
обратная реакция
исходные
вещества
продукты
реакции
А + В
С + D
прямая реакция
обратная реакция
С + D
обратная реакция
А + В
Слайд 17Количественной характеристикой химического равновесия служит константа равновесия:
k1
k1, k2 – константы скоростей прямой и обратной реакций,
[А],[B],[Б] – равновесные концентрации веществ А, Б, В.
А + Б ⮀ В
К = = ,
Слайд 20Константа химического равновесия зависит от природы реагентов
и от температуры.
Константа химического
Слайд 21
По значению констант равновесия можно судить о направлении и глубине протекания
при К= 1 химическое равновесие
при К > 1 – преобладают продукты реакции,
при К < 1 – исходные вещества.
Слайд 22Нарушение химического равновесия
Смещение равновесия – переход из одного состояния в другое
vпрям > vобр – равновесие смещается вправо;
vпрям < vобр – равновесие смещается влево.
Слайд 23Принцип Ле Шателье 1885г
Анри Ле Шателье
1850 - 1936
Если на систему, находящуюся
Слайд 251. Влияние изменения температуры
N2 + 3H2 ⮀ 2NH3 + Q
При
При понижении температуры – в направлении экзотермической реакции.
Слайд 282. Влияние изменения давления
N2 (г.) + 3H2 (г.) 2NH3
4 V
2 V
p ↑
t, кат.
При увеличении давления равновесие смещается в сторону меньшего объема газообразных веществ, и наоборот.
Слайд 29Влияние изменения давления
Куда сместится равновесие
в результате увеличения давления?
2NO2 ⮀
бурый бесцветный
Слайд 30Влияние изменения давления
При увеличении давления равновесие смещается в сторону меньшего объема
Слайд 313. Влияние изменения концентрации веществ
aA + bB d D
c(A), c(B) ↑ ⇒ равновесие смещается
c(D), c(F) ↓ ⇒ равновесие смещается
c(A), c(B) ↓ ⇒ равновесие смещается
c(D), c(F) ↑ ⇒ равновесие смещается
ВПРАВО
ВЛЕВО
ВПРАВО
ВЛЕВО
Слайд 33ВЫВОДЫ
При увеличении концентрации исходных веществ химическое равновесие смещается в сторону
При увеличении концентрации продуктов реакции химическое равновесие смещается в сторону образования исходных веществ.
При повышении давления химическое равновесие смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше.
При повышении температуры химическое равновесие смещается в сторону эндотермической реакции;
При понижении температуры химическое равновесие смещается в сторону экзотермической реакции.
Слайд 34Условия смещения химического равновесия в сторону прямой реакции
N2 (г.) + 3H2
4 V
2 V
p ↑
t, кат.
1. Понижение температуры
2. Повышение давления
3. Увеличение концентрации N2 и H2
4. Отведение из системы NH3
Слайд 35В приведенных системах установилось состояние химического равновесия. Назовите возможные условия, при
Проверка знаний
Слайд 36
1) СО2 (г.) + С ⮀ 2СО (г.) – Q
повысить
понизить давление
увеличить концентрацию СО2
отвести из системы СО
Слайд 37 2) 3NО2 (г.) + Н2О ⮀ 2НNO3 + NO (г.) +
понизить температуру
повысить давление
увеличить концентрацию исходных веществ
отвести из системы продукты реакции
Слайд 383) CO (г.) + CI 2 (г.) ⮀ COCI2 (г.) +
понизить температуру
повысить давление
увеличить концентрацию CO и CI 2
отвести из системы COCI2
Слайд 394) 2 SO2 (г.) + О2 (г.) ⮀ 2 SO3 (г.)
понизить температуру
повысить давление
увеличить концентрацию SO2 и О2
отвести из системы SO3
Слайд 40Мы изучили обратимость химических реакций, химическое равновесие и условия его смещения,
Убедились, что принцип Ле Шателье универсален.
И самое главное, поняв всю ценность этих знаний, вы сможете использовать их во благо.
Слайд 43СИНКВЕЙН
1. Назовите самое главное слово
сегодняшнего урока (существительное).
2. Опишите его
3. Назовите действия предмета речи (глаголы или причастия).
4. Сформулируйте свое отношение к теме.
5. Приведите слова, с которыми у вас ассоциируется понятие «равновесие».












![Презентация по химии на тему Обратимость химических реакций Гетерогенная реакция CO2 + C(тв) ⮀ 2CO – Q [ CO Гетерогенная реакция CO2 + C(тв) ⮀ 2CO – Q [ CO ] 2](/img/thumbs/1aa7cf44d22d04cb8dbef42ebb2b5778-800x.jpg)