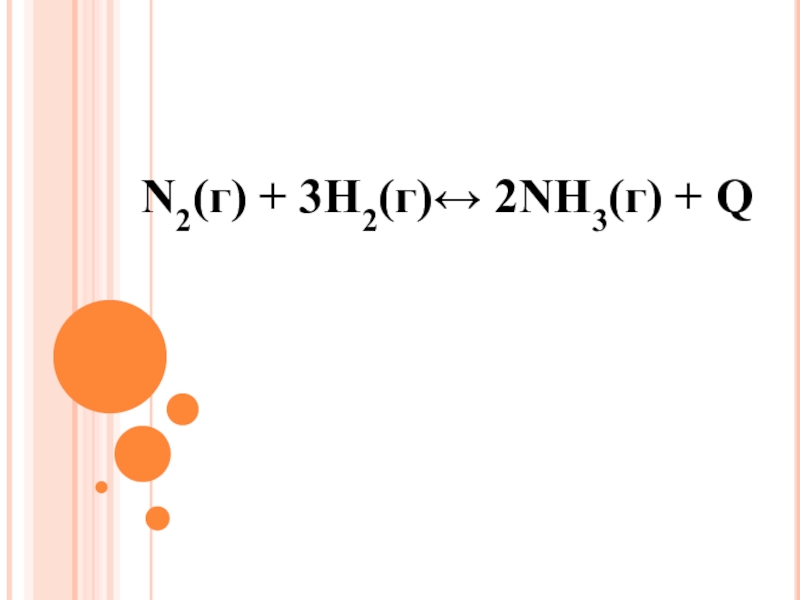- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Обратимость химических реакций. Химическое равновесие (11 класс)
Содержание
- 1. Презентация по химии на тему Обратимость химических реакций. Химическое равновесие (11 класс)
- 2. ПРИЗНАКИ НЕОБРАТИМОСТИCuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал
- 3. ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
- 4. H2 + I2 ↔ 2HI По закону
- 5. Слайд 5
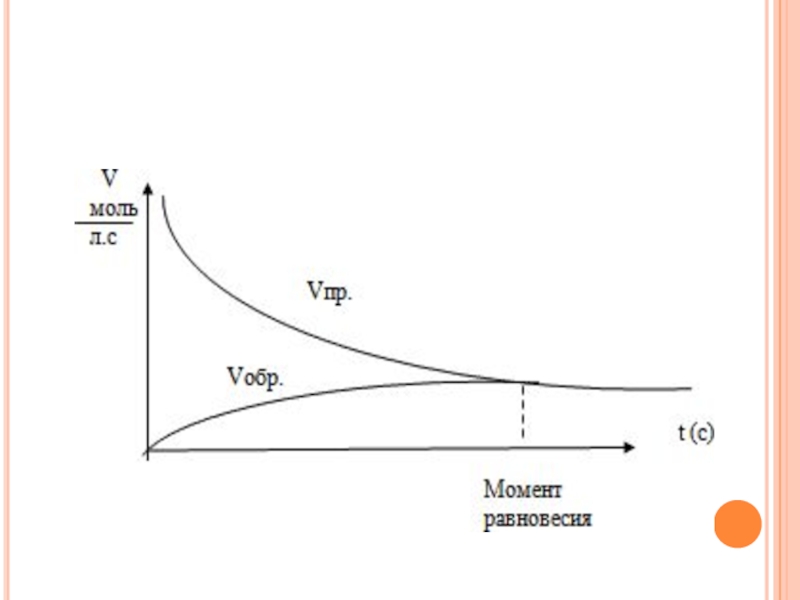
- 6. Состояние обратимого процесса, при котором скорости
- 7. Анри Луи Ле Шателье (1850- 1936), французский
- 8. .Факторы, влияющие на смещение химического равновесия
- 9. ПРИНЦИП ЛЕ ШАТЕЛЬЕЕсли на систему, находящуюся в
- 10. N2(г) + 3H2(г)↔ 2NH3(г) + Q
- 11. ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВЕЩЕСТВ С – КОНЦЕНТРАЦИЯ
- 12. ИЗМЕНЕНИЕ ДАВЛЕНИЯ Р - ДАВЛЕНИЕ↑p — равновесие
- 13. ИЗМЕНЕНИЕ ТЕМПЕРАТУРЫ Т - ТЕМПЕРАТУРА↑Т — равновесие смещается
- 14. КАТАЛИЗАТОРНа равновесие не влияет!!!
- 15. Слайд 15
- 16. ПРОИЗВОДСТВО АММИАКА И МЕТАНОЛА
- 17. ЗАКРЕПЛЕНИЕ
- 18. ЗАДАНИЯ ЕГЭ 1. Установите соответствие между уравнением
- 19. 3. При увеличении давления химическое равновесие не
- 20. 5. В системе 2SO2(г) +
- 21. 7. Химическое равновесие в системе С2Н5ОН +
- 22. 9. Установите соответствие между внешним воздействием на
- 23. 11. Установите соответствие между уравнением химической реакции
- 24. ДОМАШНЕЕ ЗАДАНИЕ§ 14, записи в тетради; Задания для самостоятельного решения
- 25. Спасибо за внимание!
Слайд 1
Что такое химическая реакция?
Признаки химических реакций?
Какие реакции называют: а) необратимыми, б)
Слайд 2ПРИЗНАКИ НЕОБРАТИМОСТИ
CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок
Na2CO3 + 2HCl=2NaCl +
H2SO4 + 2KOH = K2SO4 + 2H2O – образовалась вода – очень слабый электролит.
Слайд 4H2 + I2 ↔ 2HI
По закону действующих масс скорость прямой
Vпр=Kпр[H2]*[I2];
Vобр=Kобр [HI]²
Слайд 6Состояние обратимого процесса, при котором скорости прямой и обратной реакций
то Kпр[H2]*[I2] = Kобр [HI]².
Отсюда,
Кпр [HI]²
Коб [H2]*[I2]
Кпр / Коб = Кр
Кр - константа равновесия
Слайд 7
Анри Луи Ле Шателье (1850- 1936), французский ученый- химик, занимался исследованиями
Принцип смещения равновесий- самое известное, но далеко не единственное научное достижение Ле Шателье.
Слайд 9ПРИНЦИП ЛЕ ШАТЕЛЬЕ
Если на систему, находящуюся в состоянии химического равновесия, оказывать
Слайд 11ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВЕЩЕСТВ
С – КОНЦЕНТРАЦИЯ
↑c(реагента) – равновесие смещается в
↓c(реагента) – равновесие смещается в сторону обратной реакции (влево)
↑c(продукта) – равновесие смещается в сторону обратной реакции (влево)
↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо)
Слайд 12ИЗМЕНЕНИЕ ДАВЛЕНИЯ
Р - ДАВЛЕНИЕ
↑p — равновесие смещается в сторону реакции с
↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами
Слайд 13ИЗМЕНЕНИЕ ТЕМПЕРАТУРЫ
Т - ТЕМПЕРАТУРА
↑Т — равновесие смещается в сторону эндотермической реакции
↓Т — равновесие
Слайд 18ЗАДАНИЯ ЕГЭ
1. Установите соответствие между уравнением химической реакции и направлением
УРАВНЕНИЕ РЕАКЦИИ НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
А) N2(г)+3H2(г)↔2NH3(г) 1) смещается в сторону продуктов реакции
Б) 2H2(г)+O2(г)↔2H2O(г) 2) смещается в сторону исходных веществ
В) H2(г)+Cl2(г)↔2HCl(г) 3) не происходит смещения равновесия
Г) SO2(г)+Cl2(г)↔SO2Cl2(г)
Ответ: 1131
2. Для смещения равновесия в системе
CaCO3(т) ↔ CaO(т) + CO2(г) – Q
в сторону продуктов реакции необходимо
а) увеличить давление б) увеличить температуру
в) ввести катализатор г) уменьшить температуру
Слайд 193. При увеличении давления химическое равновесие не смещается в системе
б) 2H2(г) + O2(г) = 2H2O (г)
в) H2(г) + I2(г) = 2HI (г)
г) SO2(г) + Cl2(г) = SO2Cl2(г)
4. Установите соответствие между уравнением химической реакции и изменением условий, которое приводит к смещению равновесия в сторону продуктов:
УРАВНЕНИЕ РЕАКЦИИ РАВНОВЕСИЕ СМЕЩАЕТСЯ В СТОРОНУ
ПРОДУКТОВ ПРИ
А) H2(г)+S(тв)↔H2S(г)+Q 1)охлаждении
Б) CH3OH(г)↔CO(г)+2H2(г)-Q 2)повышении давления
В) CH4(г)↔C(тв)+2H2(г)-Q 3)понижении давления
Г) C6H12(г)↔C6H6(г)+3H2(г)-Q
Ответ: 1333
Слайд 205. В системе 2SO2(г) + O2(г) ↔ 2SO3(г) +
смещению химического равновесия в сторону исходных веществ будет способствовать
а) уменьшение давления
б) уменьшение температуры
в) увеличение концентрации SO2
г) уменьшение концентрацииSO3
6. Химическое равновесие в системе
C4H10 (г) ↔ C4H6(г) + 2H2(г) -Q
сторону обратной реакции, если
а) повысить температуру
б) уменьшить концентрацию H2
в) добавить катализатор
г) повысить давление
Слайд 217. Химическое равновесие в системе
С2Н5ОН + СН3СООН ↔ СН3СООС2Н5 + Н2О
1. Добавлении воды
2. Уменьшении концентрации уксусной кислоты
3. Увеличении концентрации эфира
4. При удалении сложного эфира
8.Установите соответствие между внешним воздействием на систему:
СО2(г) + С(тв) ↔ 2СО(г) – Q и смещение химического равновесия.
Внешнее воздействие Смещение химического равновесия
А. Увеличение концентрации СО 1. Смещается в сторону
прямой реакции
Б. Повышение температуры 2. Смещается в сторону
обратной реакции
В. Понижение давления 3. Не происходит смещения равновесия
Г. Использование катализатора
2113
Слайд 229. Установите соответствие между внешним воздействием на систему
WO3(тв) + 3H2(г) ↔ W(тв)
ВНЕШНЕЕ ВОЗДЕЙСТВИЕ СМЕЩЕНИЕ ХИМИЧЕСКОГО
РАВНОВЕСИЯ
А. Повышение температуры 1. Смещается в сторону прямой реакции
Б. Повышение давления 2. Смещается в сторону обратной реакции
В. Использование катализатора 3. Не происходит смещения равновесия
Г. Удаление паров воды
2331
10. Установите соответствие между уравнением химической реакции и смещением химического равновесия при увеличении давления в системе.
Уравнение реакции Направление смещения химического
равновесия
А. 2HI(г) ↔ H2(г) + I2(тв) 1. Смещается в сторону прямой реакции
Б. C(г) + 2S(г) ↔ CS2(г) 2. Смещается в сторону обратной реакции
В. C3H6(г) + H2(г) ↔ C3H8(г) 3. Не происходит смещения равновесия
Г. H2(г) + F2(г) ↔ 2HF(г)
1113
Слайд 2311. Установите соответствие между уравнением химической реакции и одновременным изменением условий
Уравнение реакции Изменение условий
А. N2(г) + H2(г) ↔ 2NH3(г) + Q 1. Увеличение температуры
и давления
Б. N2O4(ж) ↔ 2NO2(г) -Q 2. Уменьшение температуры
и давления
В. CO2(г) + C(тв) ↔ 2CO(г) + Q 3. Увеличение температуры и
уменьшение давления
Г. 4HCl(г) + O2(г) ↔ 2H2O(г) + 2Cl2(г) + Q 4. Уменьшение температуры
и увеличение давления
4322
12. В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
1. N2(г) + 3H2(г) ↔ 2NH3(г) + Q
2. N2O4(г) ↔ 2NO2(г) - Q
3. CO2(г) + H2(г) ↔ CO(г) + H2O(г) - Q
4. 4HCl(г) + O2(г) ↔ 2H2O(г) + 2Cl2(г) + Q