- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Неметаллы ( 9класс)
Содержание
- 1. Презентация по химии на тему Неметаллы ( 9класс)
- 2. Цели и задачи работы:Обобщить и проанализировать собранный
- 3. Расположение неметаллов в периодической таблице Д. И.МенделееваЭО
- 4. АллотропияКислород
- 5. Получение кислорода
- 6. 16 +8 О )2)6
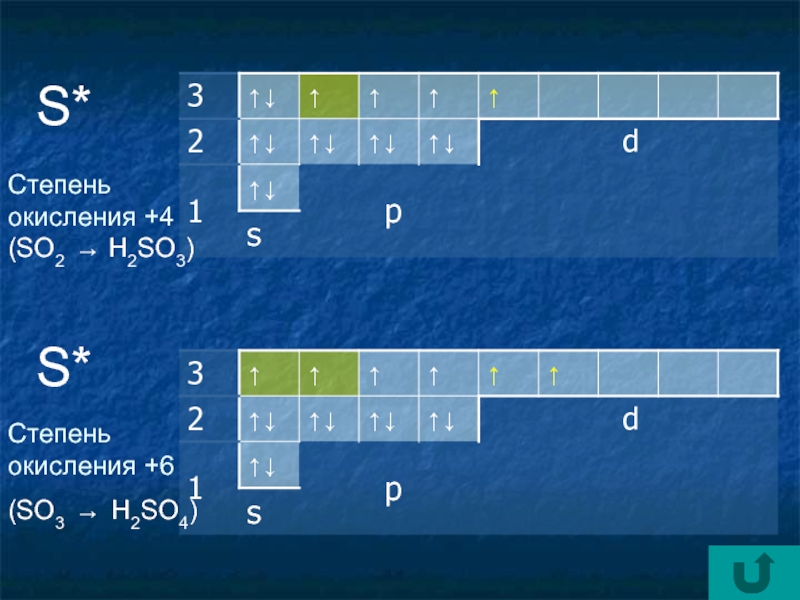
- 7. 32+16 S )2)8)6S*Степени окисленияСера(16 p+11; 16 n01
- 8. S*Степень окисления +4 (SO2 → H2SO3)S*Степень окисления +6 (SO3 → H2SO4)
- 9. 14 +7 N )2)5
- 10. 12+6 C )2)4
- 11. Окислительные и восстановительные свойства неметалловС металлами
- 12. 4Li0 + O20 = 2Li2+O-2 Li0
- 13. SСерная кислотаФизические свойства H2SO4 : Бесцветная Тяжелая
- 14. Слайд 14
- 15. Химические свойства:Концентрированная H2SO4 Сильный окислитель Реакции идут:
- 16. Раствор H2SO4 :с м е
- 17. 2NaOH + H2SO4 = Na2SO4 + 2H2OSс
- 18. BaCl2 + H2SO2 = BaSO4⭣ + 2HClc c o л я м и (качественная реакция)
- 19. Производство серной кислотыТехнологический процесс производства
- 20. Технологический процесс производства серной кислоты1. Аппарат обжига
- 21. Применение H2SO4Получение красителейМинеральных удобренийОчистка нефтепродуктовЭлектрическое получение медиЭлектролит в аккумуляторахПолучение взрывчатых веществКрасителейИскусственного шелкаГлюкозыСолейКислотS
- 22. NАммиакФизические свойства NH3: Бесцветный газ Резкий запах
- 23. NАммиакПри нагревании разлагается
- 24. Реагирует с кислотами2NH3 + H2SO4 = (NH4)2SO4NH3 + HCl = NH4Cl
- 25. NПолучение NH3 и растворение его в воде
- 26. Слайд 26
- 27. NПолучение минеральных удобренийДля паянияВ медицинеВ бытуПолучение взрывчатых веществАзотной кислотыПрименение NH3
- 28. Азотная кислотаФизические свойства HNO3: Резкий запах Обычно
- 29. NХимические свойства:Азотная кислотас металлами (концентрированная, раствор) Ме
- 30. Cu + 4HNO3(концентрированная) = Cu(NO3)2 + 2NO2 + 2H2O
- 31. 3Cu + 8HNO3(р-р) = 3Cu(NO3)2 + 2NO + 4H2O
- 32. Раствор HNO3 :Nс с о л
- 33. Раствор HNO3 :NC нерастворимым о с
- 34. Соли азотной кислотыпримеры: 2NaNO3 = t 2NaNO2
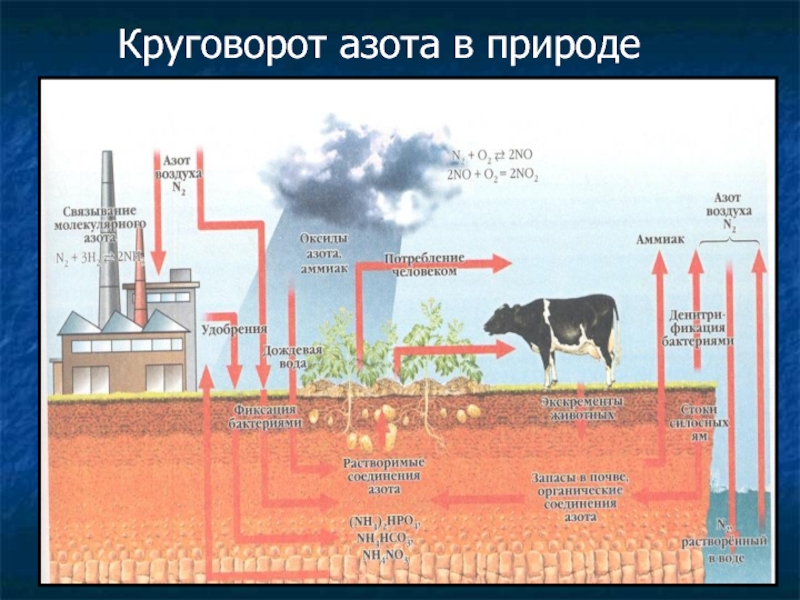
- 35. Круговорот азота в природе
- 36. Cуглерод
- 37. Физические свойства СO2: Бесцветный газ Без запаха
- 38. CO2 + Ca(OH)2 = CaCO3↓ + H2O
- 39. H2CO3, слабая двухосновная кислота, при нормальных условиях
- 40. Угарный газFe2O3 + 3CO = 2Fe +
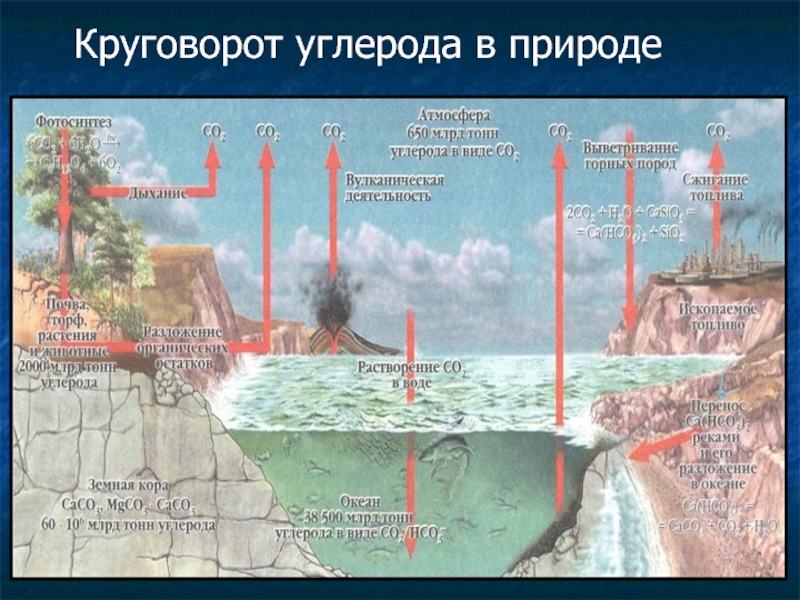
- 41. Круговорот углерода в природе
- 42. ЗаключениеВ работе: Обобщен собранный теоретический материал по
Слайд 2Цели и задачи работы:
Обобщить и проанализировать собранный теоретический материал по теме
Сравнить свойства различных неметаллов изучая продукт опытных исследований.
Получить представление о структуре неметаллов (электронное строение, строение кристаллических решеток).
Определить в каких областях применяются неметаллы.
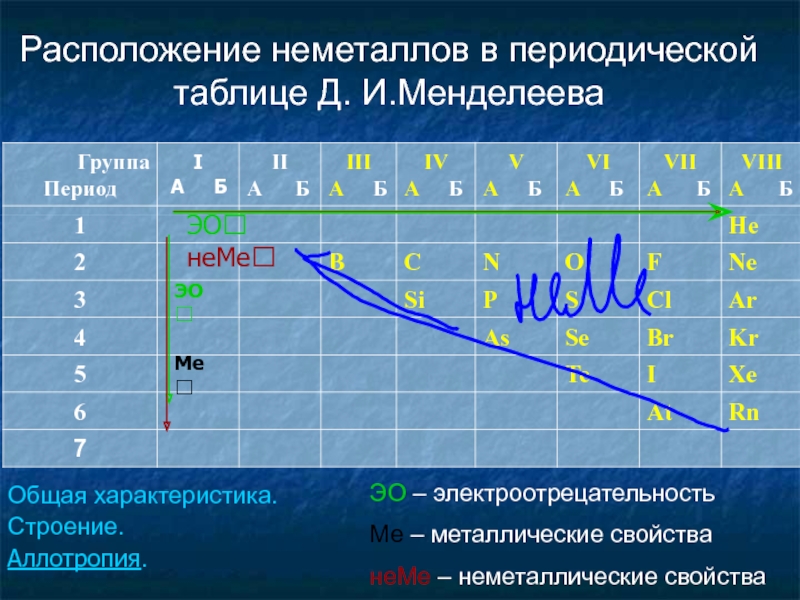
Слайд 3Расположение неметаллов в периодической таблице Д. И.Менделеева
ЭО – электроотрецательность
Ме – металлические
неМе – неметаллические свойства
Общая характеристика.
Строение.
Аллотропия.
ЭО⭡ неМе⭡
ЭО⭣
Ме⭡
Слайд 4Аллотропия
Кислород
Сера Sкр , Sпласт
Фосфор Р4 , Ркр , Рчёр
Углерод алмаз, графит, карбин
Слайд 616 +8 О )2)6
1s22s22p4
Степени окисления
Строение атомов неметаллов
Кислород
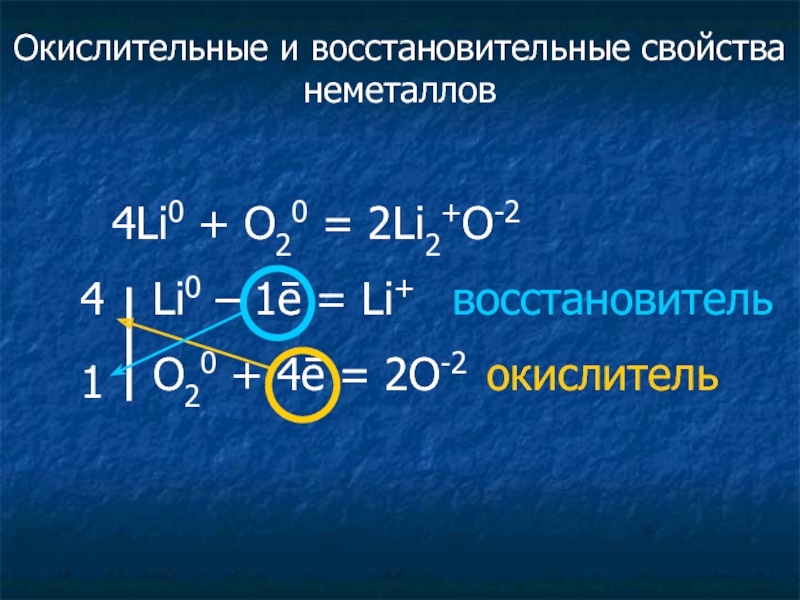
Слайд 124Li0 + O20 = 2Li2+O-2
Li0 – 1ē = Li+
O20 + 4ē = 2O-2 окислитель
4
1
Окислительные и восстановительные свойства неметаллов
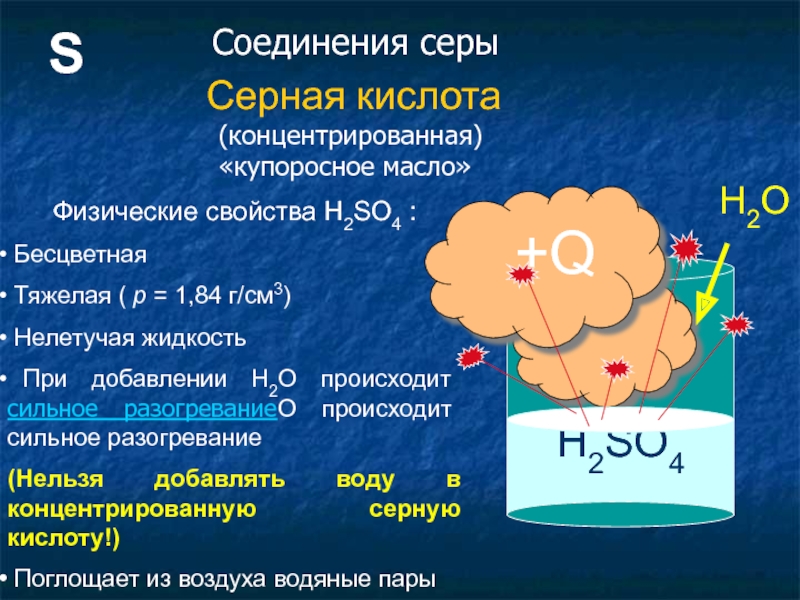
Слайд 13S
Серная кислота
Физические свойства H2SO4 :
Бесцветная
Тяжелая ( p = 1,84
Нелетучая жидкость
При добавлении H2O происходит сильное разогреваниеO происходит сильное разогревание
(Нельзя добавлять воду в концентрированную серную кислоту!)
Поглощает из воздуха водяные пары
Соединения серы
(концентрированная) «купоросное масло»
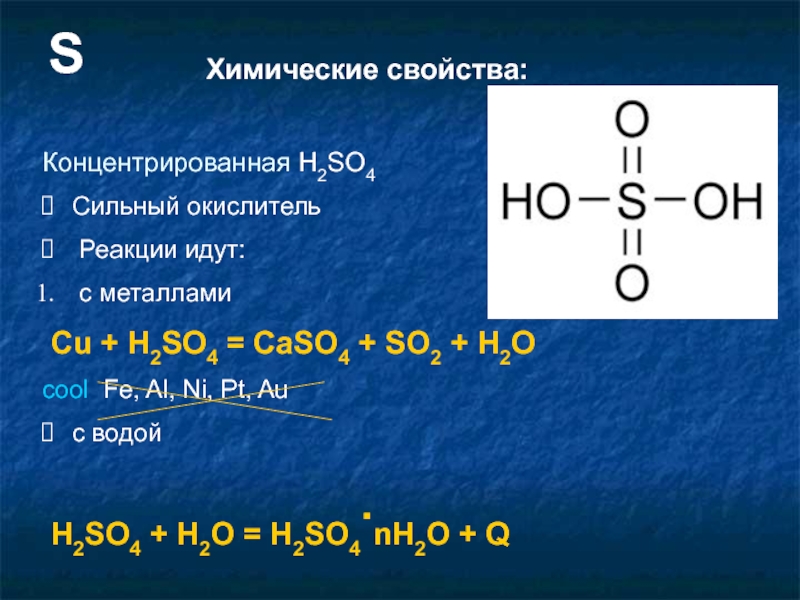
Слайд 15Химические свойства:
Концентрированная H2SO4
Сильный окислитель
Реакции идут:
c металлами
Cu +
cool Fe, Al, Ni, Pt, Au
с водой
H2SO4 + H2O = H2SO4.nH2O + Q
S
Слайд 16Раствор H2SO4 :
с м е т а л л
Zn + H2SO4 = ZnSO4 + H2↑
Cu, Hg, Ag, Pt, Au
CuO + H2SO4 = t CuSO4 + H2O
S
с о к с и д а м и
Слайд 172NaOH + H2SO4 = Na2SO4 + 2H2O
S
с растворимыми о с н
с нерастворимыми о с н о в а н и я м и
Cu(OH)2⭣ + H2SO4 = CuSO4 + 2H2O
Слайд 20Технологический процесс производства серной кислоты
1. Аппарат обжига в «кипящем слое»
}
2. Циклон (очистка от огарка)
3. Электрофильтр (очистка от огарка)
4. Сушильная башня (очистка от влаги)
Аппараты очистки
5. Теплообменник
6. Контактный аппарат (V2O5 t=5000C)
2SO2 + O2 ⮀ 2SO3 + Q
7. Поглотительная башня
SO3 + H2SO4 = H2S2O7 (олеум)
Слайд 21Применение H2SO4
Получение красителей
Минеральных удобрений
Очистка нефтепродуктов
Электрическое получение меди
Электролит в аккумуляторах
Получение взрывчатых веществ
Красителей
Искусственного
Глюкозы
Солей
Кислот
S
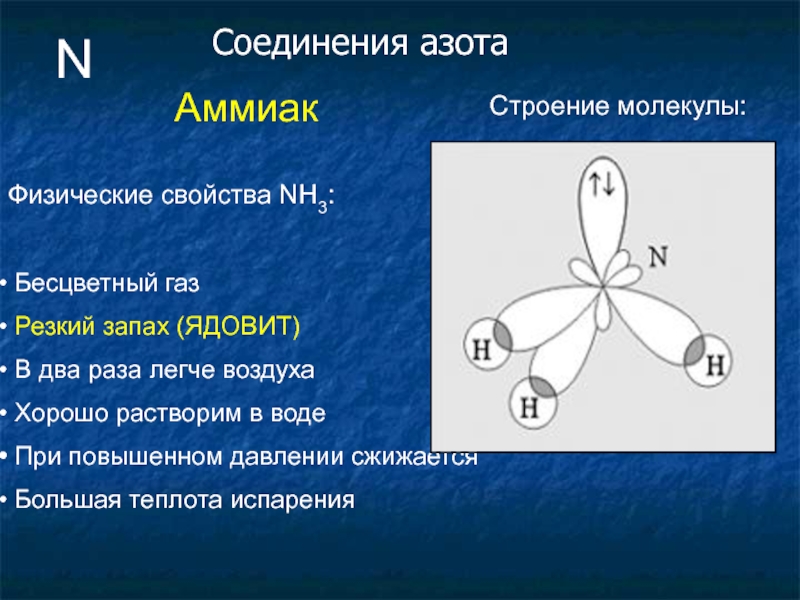
Слайд 22N
Аммиак
Физические свойства NH3:
Бесцветный газ
Резкий запах (ЯДОВИТ)
В два раза
Хорошо растворим в воде
При повышенном давлении сжижается
Большая теплота испарения
Строение молекулы:
Соединения азота
Слайд 23N
Аммиак
При нагревании разлагается
2NH3 ⮀t
Химические свойства:
2) 4NH3 + 5O2 =кат. 4NO + 6H2O
Горит в кислороде
1) 4NH3 + 3O2 = t 2N2 + 6H2O
2N-3 - 6ē = N20
O20 + 4ē = 2O-2
4
6
2
3
N-3 - 5ē = N+2
O20 + 4ē = 2O-2
4
5
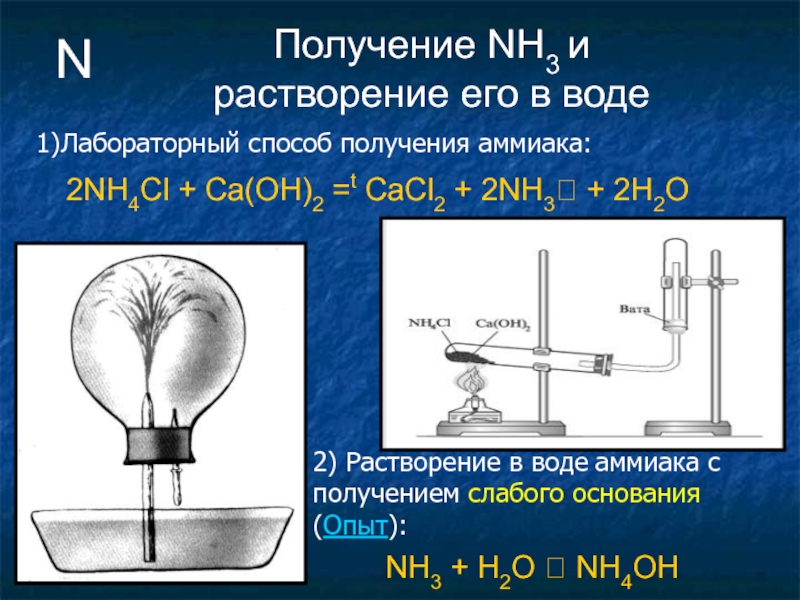
Слайд 25N
Получение NH3 и растворение его в воде
2NH4Cl +
NH3 + H2O ⮀ NH4OH
2) Растворение в воде аммиака с получением слабого основания (Опыт):
1)Лабораторный способ получения аммиака:
Слайд 27N
Получение минеральных удобрений
Для паяния
В медицине
В быту
Получение взрывчатых веществ
Азотной кислоты
Применение NH3
Слайд 28Азотная кислота
Физические свойства HNO3:
Резкий запах
Обычно окрашена в желтый цвет
4HNO3 = 4NO2 + O2 + 2H2O
Строение молекулы:
N
Слайд 29N
Химические свойства:
Азотная кислота
с металлами (концентрированная, раствор)
Ме + HNO3 (конц. ,
Cu + 4HNO3(концентрированная) = Cu(NO3)2 + 2NO2 + 2H2O
Слайд 32Раствор HNO3 :
N
с с о л я м и
CuO
с о к с и д а м и
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Слайд 33Раствор HNO3 :
N
C нерастворимым о с н о в а
Fe(OH)2 + 2HNO3 = Fe(NO3)2 + H2O
NaOH + HNO3 = NaNO3 + H2O
c растворимым о с н о в а н и е м
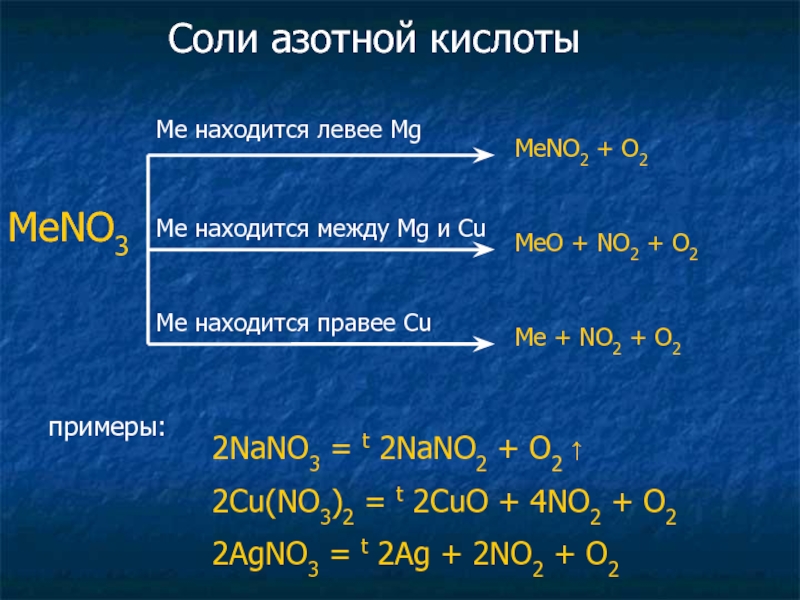
Слайд 34Соли азотной кислоты
примеры:
2NaNO3 = t 2NaNO2 + O2 ↑
2Cu(NO3)2
2AgNO3 = t 2Ag + 2NO2 + O2
Слайд 37
Физические свойства СO2:
Бесцветный газ
Без запаха
Тяжелее воздуха
Химические свойства СO2:
1)
2) CO2 + 2Mg = 2MgO + C
3) CO2 + H2O ⮀ H2CO3
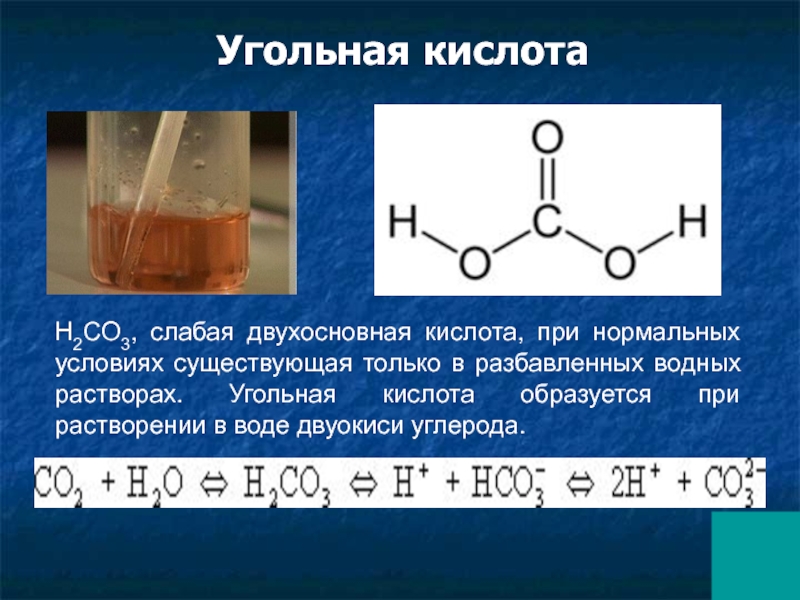
Слайд 39H2CO3, слабая двухосновная кислота, при нормальных условиях существующая только в разбавленных
Угольная кислота
Слайд 40Угарный газ
Fe2O3 + 3CO = 2Fe + CO2
2CO + O2 =
Физические свойства СO:
Бесцветный газ
Без запаха
Сильный ЯД!!!
Легче воздуха
Химические свойства СO:
Сильнейший восстановитель
Слайд 42Заключение
В работе:
Обобщен собранный теоретический материал по теме неметаллы.
Представлены опыты
Приведены примеры использования неметаллов в различных отраслях промышленности.