- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Неметаллы
Содержание
- 1. Презентация по химии на тему: Неметаллы
- 2. Удивить готов он нас - Он и
- 3. НЕМЕТАЛЛЫ - это химические элементы, для
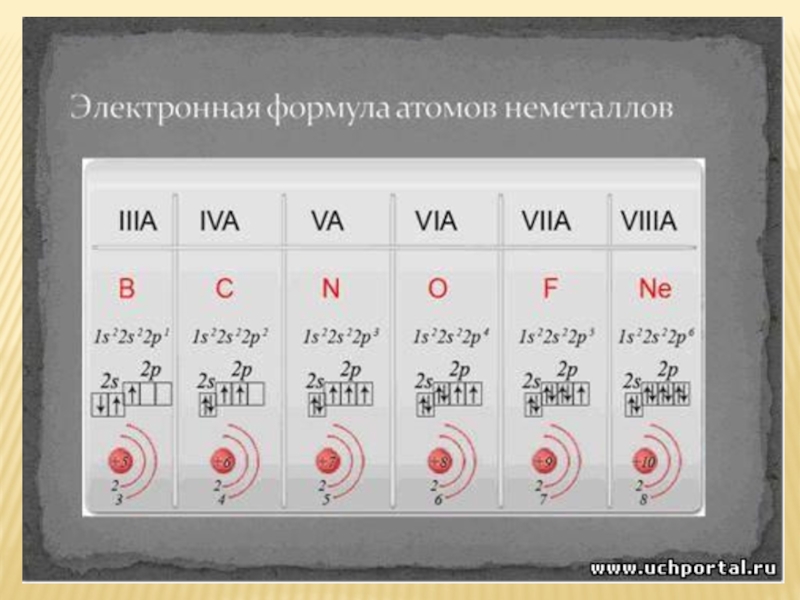
- 4. Положение неметаллов в периодической системе химических элементов
- 5. Кроме того, к неметаллам относят также водород
- 6. Слайд 6
- 7. ЗАДАНИЕ:Напишите электронные формулы - серы, фтора,
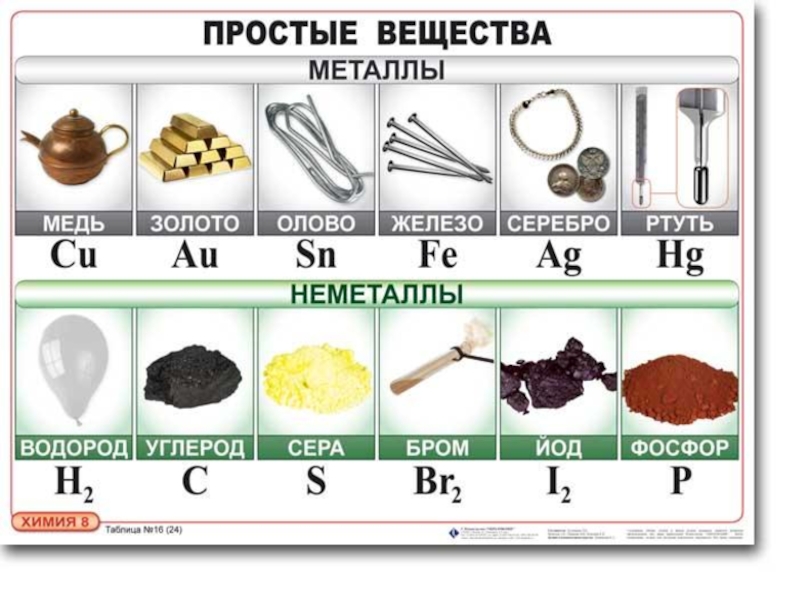
- 8. НАХОЖДЕНИЕ НЕМЕТАЛЛОВ В
- 9. Слайд 9
- 10. Чаще неметаллы находятся в химически связанном виде:
- 11. фосфат кальция
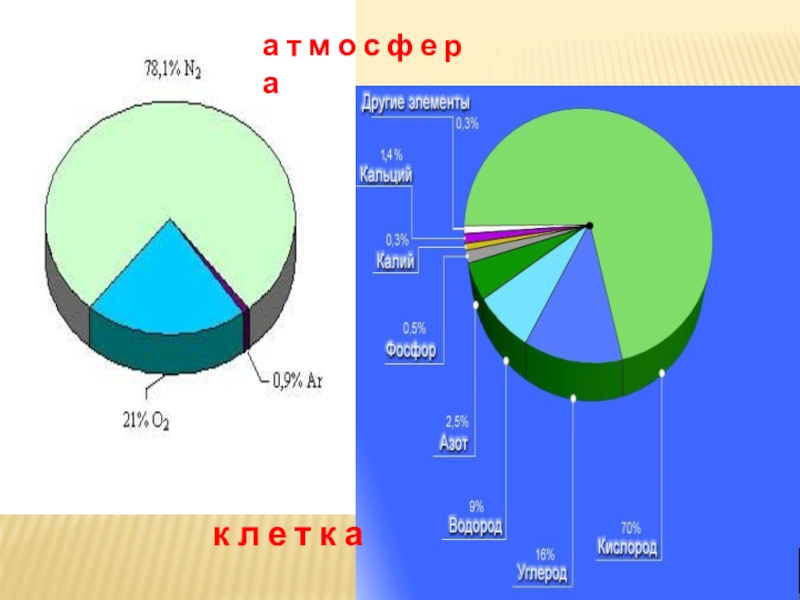
- 12. а т м о с ф е р ак л е т к а
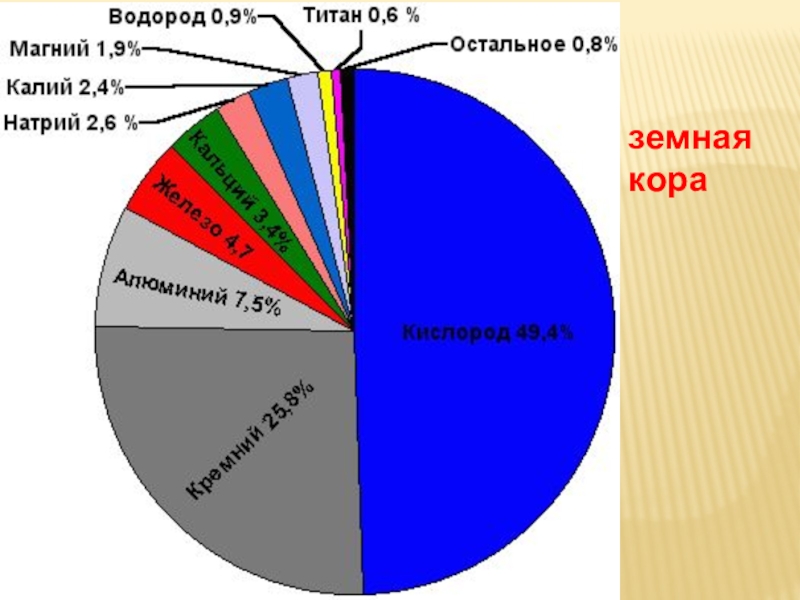
- 13. земная кора
- 14. ЗАДАНИЕ: Какого газа ( по объему)
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВПРОСТЫЕ ВЕЩЕСТВА – атомы в
- 16. С Е Р АКРАСНЫЙ ФОСФОРБЕЛЫЙ ФОСФОР
- 17. КРЕМНИЙСЕЛЕН
- 18. У некоторых неметаллов наблюдается проявление аллотропии: -
- 19. Гость из космоса пришел, в воздухе приют
- 20. 10.Какой неметалл является лесом?
- 21. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВОкислительные свойства простых веществ:Реагируют с
- 22. ЗАДАНИЕ:Напишите уравнения реакций и укажите окислитель: Na
- 23. Восстановительные свойства неметаллов (
- 24. ЗАДАНИЕСоставьте уравнения реакций и определите восстановитель:Si +
- 25. ПОЛУЧЕНИЕ НЕМЕТАЛЛОВв промышленности
- 26. Молекулярный азот в промышленности получают фракционной перегонкой
- 27. Фосфор получают из апатитов или фосфоритов в
- 28. Хлор в промышленных масштабах получают вместе с
- 29. Р Е Б У С ЫЙ О ДК Р Е М Н И Й
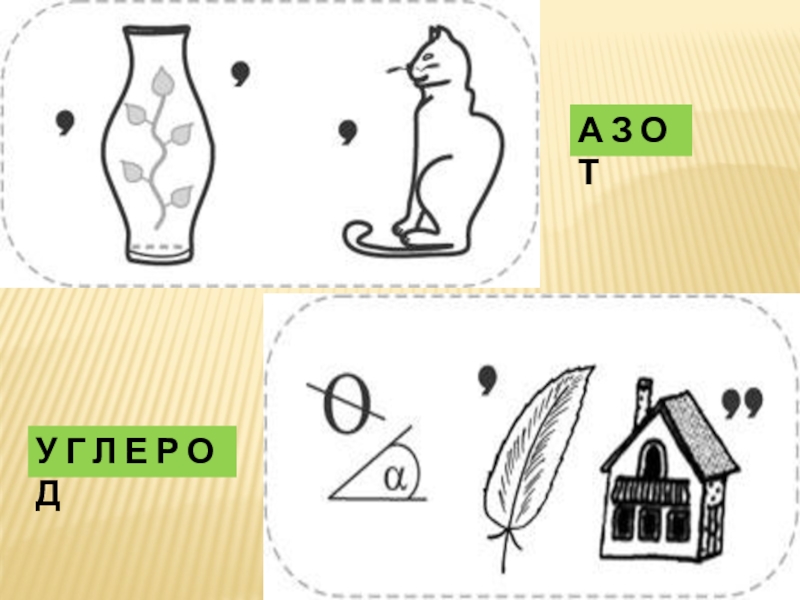
- 30. А З О ТУ Г Л Е Р О Д
- 31. 1. Неметаллы, расположенные в порядке усиления их
- 32. 5. Верны ли следующие суждения о неметаллах
- 33. 9. Схеме превращения P⁻³→ P⁺⁵
Слайд 2Удивить готов он нас - Он и уголь, и алмаз, Он в карандашах
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент …
КИСЛОРОДА
АЗОТ
УГЛЕРОД
Слайд 3НЕМЕТАЛЛЫ - это химические элементы, для
атомов которых характерна способность
принимать электроны до завершения
внешнего уровня.
В главной подгруппе:
число электронов на внешнем слое не изменяется
радиус атома увеличивается
электроотрицательность
уменьшается
окислительные свойства
уменьшаются
-НЕМЕТАЛЛИЧЕСКИЕ свойства УМЕНЬШАЮТСЯ
В периоде:
радиусы атомов уменьш.
- число электронов на
внешнем слое уменьш.
- электроотрицательность
увеличивается
окислительные свойства
увеличиваются
- НЕМЕТАЛЛИЧЕСКИЕ
свойства
УВЕЛИЧИВАЮТСЯ
Слайд 4Положение неметаллов в периодической системе химических элементов
Немета́ллы — химические элементы с
системы. Расположение их в главных подгруппах соответствующих периодов:
.
Слайд 5Кроме того, к неметаллам относят также водород и
гелий.
Характерной особенностью неметаллов
O 1ѕ²2ѕ²2p⁴ Cl 1ѕ²2s²2p⁶3s²3p⁵
Это определяет их большую способность к присоединению дополнительных электронов,
и проявлению более высокой окислительной активности, чем у металлов.
Слайд 7ЗАДАНИЕ:
Напишите электронные формулы - серы, фтора,
S 1s²2s²2p⁶3s²3p⁴ F 1s²2s²2p⁵
As 1s²2s²2p⁶3s²3p⁶4s²4p³ Br 1s²2s²2p⁶3s²3p⁶4s²4p⁵
У какого из элементов ярче выражены
неметаллические свойства и почему:
а) As - N б) Cl - S
а) N – меньше радиус атома (больше значение
электроотрицательности)
б) Cl - меньше радиус атома, больше валентных
электронов ( больше значение ЭО)
Слайд 8НАХОЖДЕНИЕ НЕМЕТАЛЛОВ В ПРИРОДЕ
В свободном виде могут
фтор, хлор, кислород, азот, водород,
инертные газы,
твёрдые — иод, астат, сера, селен, теллур,
фосфор, мышьяк, углерод, кремний, бор,
при комнатной температуре в жидком состоянии существует
бром.
Распространёнными являются
кислород, кремний, водород;
редкими — мышьяк, селен, иод.
Слайд 10Чаще неметаллы находятся в химически связанном виде:
различные силикаты, фосфаты, сульфиды.
силикат натрия
сульфид свинца
Слайд 14ЗАДАНИЕ:
Какого газа ( по объему) больше всего
А З О Т А
Какого элемента-неметалла ( по массе)
больше всего в литосфере?
К И С Л О Р О Д А
Атомов какого элемента-неметалла (по массе)
больше всего в живых организмах ?
К И С Л О Р О Д А
Слайд 15ФИЗИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
ПРОСТЫЕ ВЕЩЕСТВА – атомы в молекуле связаны
СТРОЕНИЕ:
Молекулярное - а) газы - O₂ , Cl₂ , N₂ , H₂ , F₂ , O₃
(летучие) б) твердые - I₂ , P₄ , S₈
в) жидкие - Br₂
Атомное - твердые - C , B , Si , Se , Te
( длинные цепи атомов)
- высокие: твердость, температура плавления и
кипения
ОБЩИЕ ЧЕРТЫ: почти все – диэлектрики, кристаллы
непластичны, легко разрушаются
Слайд 18У некоторых неметаллов наблюдается проявление
аллотропии:
- для газообразного кислорода характерны
две аллотропных модификации — кислород (O2)
и озон (O3),
- для твёрдого углерода множество форм —
алмаз, астралены, графен, графан, графит, карбин,
фуллерены, стеклоуглерод
ФИЗИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
АЛМАЗ
ГРАФИТ
Слайд 19
Гость из космоса пришел, в воздухе приют себе нашел.
2.В доме выше всех живем, вдвоем тепло и свет даем.
ВОДОРОД И ГЕЛИЙ
3.Он безжизненным зовется, но жизнь без него не создается.
АЗОТ
4.Красив в кристаллах и парах, на детей наводит страх.
ЙОД
5.Из горы кусочек вынули, в деревянный ствол задвинули.
ГРАФИТ В КАРАНДАШЕ
6.Гордиться уголек невзрачный негорючим братом, и братом прозрачным.
АЛМАЗ, ГРАФИТ
Слайд 2010.Какой неметалл является лесом?
11.Какие химические элементы утверждают, что могут другие вещества рождать?
ВОДОРОД, КИСЛОРОД, УГЛЕРОД
7.Прокаленный уголек дышать пожарнику помог.
АКТИВИРОВАННЫЙ УГОЛЬ
8.Белый воздуха боится, покраснел чтоб сохраниться.
БЕЛЫЙ И КРАСНЫЙ ФОСФОР
9.Хоть многие вещества превращает в яд, в химии она достойна всяческих наград.
СЕРА
Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
Окислительные свойства простых веществ:
Реагируют с металлами
2Fe + 3 Cl₂⁰ = 2 FeCl⁻₃
Реагируют с водородом
H₂ + S⁰ = H₂S⁻² 3N₂⁰ + H₂ = 2N⁻³H₃
Реагируют с неметаллами с более низким
значением электроотрицательности
2P⁰ + 5S⁰ = P₂⁺⁵S₅⁻² S⁰ + 3 F₂⁰ = S⁺⁶F₆⁻
Реагируют с некоторыми сложными веществами
C⁻⁴H⁺₄ + 2 O⁰₂ = C⁺⁴O₂⁻² + 2 H₂⁺O⁻²
2 KI⁻ + Cl₂⁰ = 2 KCl⁻ + I₂⁰
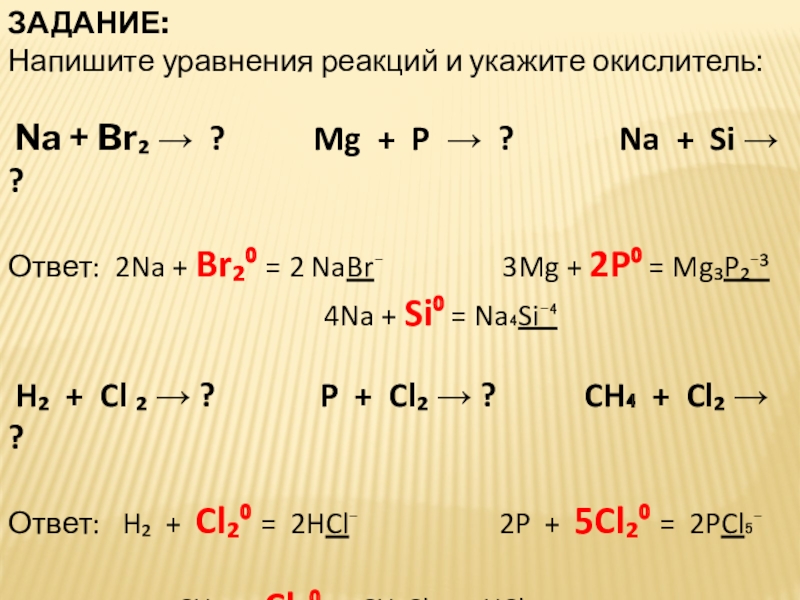
Слайд 22ЗАДАНИЕ:
Напишите уравнения реакций и укажите окислитель:
Na + Br₂ →
Ответ: 2Na + Br₂⁰ = 2 NaBr⁻ 3Mg + 2P⁰ = Mg₃P₂⁻³
4Na + Si⁰ = Na₄Si⁻⁴
H₂ + Cl ₂ → ? P + Cl₂ → ? CH₄ + Cl₂ → ?
Ответ: H₂ + Cl₂⁰ = 2HCl⁻ 2P + 5Cl₂⁰ = 2PCl₅⁻
CH₄ + Cl₂⁰ = CH₃Cl⁻ + HCl⁻
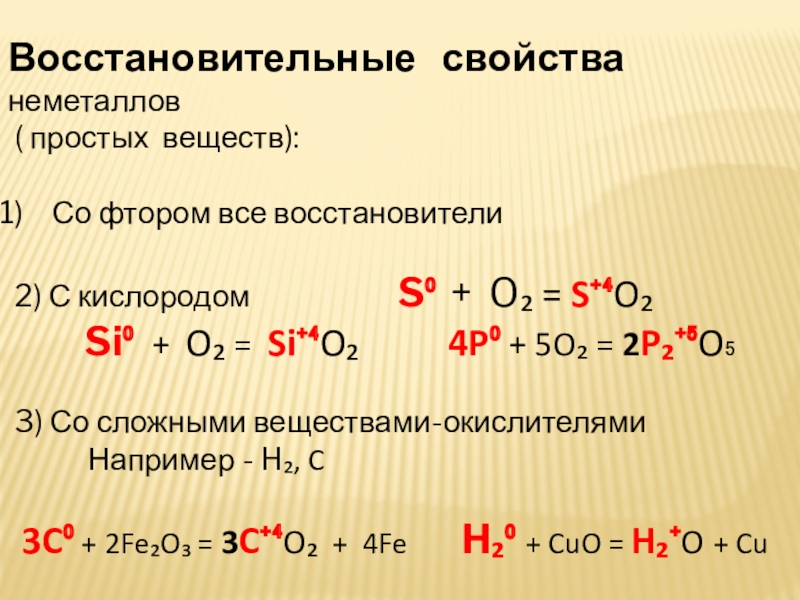
Слайд 23Восстановительные свойства неметаллов
( простых веществ):
Со фтором все
2) С кислородом S⁰ + O₂ = S⁺⁴O₂
Si⁰ + O₂ = Si⁺⁴O₂ 4P⁰ + 5O₂ = 2P₂⁺⁵O₅
3) Со сложными веществами-окислителями
Например - H₂, C
3C⁰ + 2Fe₂O₃ = 3C⁺⁴O₂ + 4Fe H₂⁰ + CuO = H₂⁺O + Cu
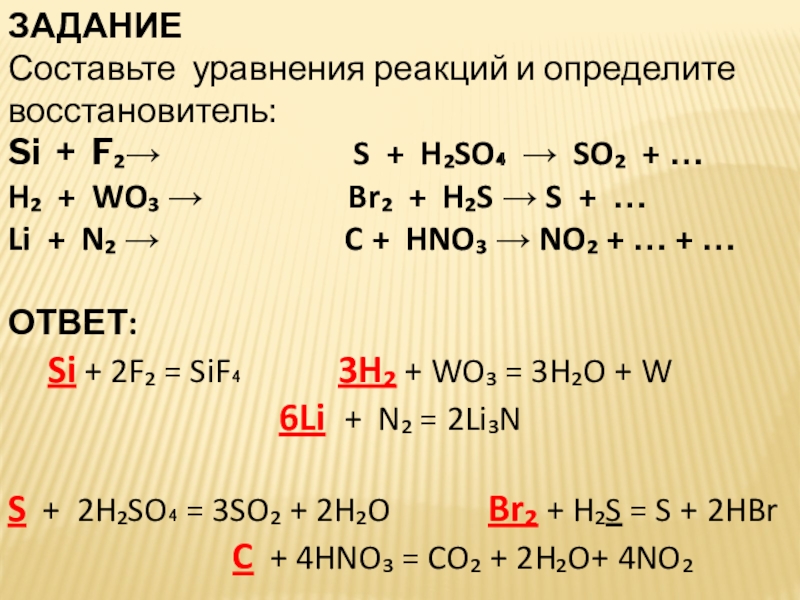
Слайд 24ЗАДАНИЕ
Составьте уравнения реакций и определите восстановитель:
Si + F₂→
H₂ + WO₃ → Br₂ + H₂S → S + …
Li + N₂ → C + HNO₃ → NO₂ + … + …
ОТВЕТ:
Si + 2F₂ = SiF₄ 3H₂ + WO₃ = 3H₂O + W
6Li + N₂ = 2Li₃N
S + 2H₂SO₄ = 3SO₂ + 2H₂O Br₂ + H₂S = S + 2HBr
C + 4HNO₃ = CO₂ + 2H₂O+ 4NO₂
Слайд 26Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 %
Слайд 27Фосфор получают из апатитов или фосфоритов в
результате взаимодействия с коксом
кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются
2Ca₃(PO₄)₂↓+10C+6SiO₂↓=P₄+10CO↑+6CaSiO₃↓
в приёмнике
под водой.
Слайд 28Хлор в промышленных масштабах получают вместе
с гидроксидом натрия и
электролиза раствора поваренной соли:
2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
Слайд 311. Неметаллы, расположенные в порядке усиления их неметалличности, - это
1)
2) сера, хлор, фтор 4) бор, кремний, водород
2. Неметаллические свойства элементов в ряду углерод- азот- кислород-фтор:
1) не изменяются 2) усиливаются 3) ослабевают 4) изменяются периодически
Т Е С Т
ОТВЕТ: 1 - 2 2 - 2 3 - 4 4 - 3
3.Завершенный внешний энергетический имеет частица:
1) P⁺³ 2) S⁺⁴ 3) Cl⁺⁵ 4) C⁻⁴
4. Частице Si⁻⁴ соответствует электронная конфигурация:
1) 1s²2s²2p⁶3s² 2) 1s²2s²2p⁶3s²3p⁴ 3) 1s²2s²2p⁶3s²3p⁶4s²
Слайд 325. Верны ли следующие суждения о неметаллах и их
А. Низшая степень окисления азота и фосфора равна -5.
Б. Высший оксид кремния проявляет кислотные
свойства.
1 ) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения неверны
6. Ковалентная полярная связь образуется в соединении:
1) NaCl 2) NH₃ 3) P₄ 4) BaCl₂
7. Атомную кристаллическую решетку имеет:
1) I₂ 2) CO₂ 3) KCl 4) Si
8. Молекулярное строение имеет:
1) Кремний 2) Сера 3) Бор 4) Цинк
Ответ: 5 - 3 6 - 2 7 - 4 8 - 2
Слайд 339. Схеме превращения P⁻³→ P⁺⁵ соответствует
уравнение:
3)2PH₃ + 4O₂ = P₂O₅ + 3H₂O
4) P₂O₅ + 6NaOH = 2Na₃PO₄ + 3H₂O
ОТВЕТ: 9 - 3
10. Простое вещество сера взаимодействует с каждым из
веществ ряда:
1) HCl, Na, O₂ 2) Mg, O₂, H₂
3) K, Zn, Na₂SO₄ 4) Al, H₂O, O₂
ОТВЕТ: 10 - 2
11. Расставьте коэффициенты в схеме реакции:
P + H₂SO₄ → H₃PO₄+ SO₂ + H₂O
ОТВЕТ: 2P⁰ + 5H₂S⁺⁶O₄ → 2H₃P⁺⁵O₄+ 5S⁺⁴O₂ + 2H₂O