- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Металлы
Содержание
- 1. Презентация по химии на тему Металлы
- 2. «Металлы отверзают недро земное к плодородию; металлы
- 3. Металлы в истории человечестваСемь металлов создал свет
- 4. Металлы в истории человечества
- 5. Понятие о металлахМета́лл (название происходит от лат.Мета́лл
- 6. Металлы в периодической системеЛевый нижний угол относительно диагонали В-At + все побочные подгруппы
- 7. Металлы в периодической системеК элементам - металлам
- 8. Особенности строения атомов металловВнешних (валентных) электоронов мало
- 9. Изменение свойств металлов
- 10. Металлическая связьМеталлическая связь – это связь в
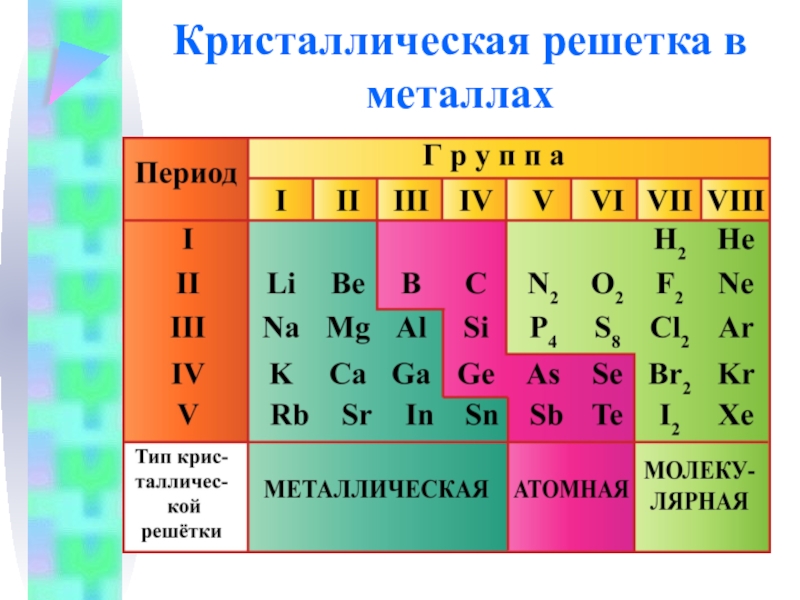
- 11. Кристаллическая решетка в металлах
- 12. Модели кристаллов металлов (кубическая гранецентрированная)По этому типу
- 13. Модели кристаллов металлов (кубическая объемноцентрированная)По этому типу
- 14. Физические свойства металловМетПластичностьМеталлический блескПлотностьТвердостьТеплопроводностьЭлектропровлдностьТемпература плавления
- 15. Физические свойства металлов1. Металлический блескСамые блестящие металлы
- 16. Физические свойства металлов2. Электро- и теплопроводностьВ ряду
- 17. Физические свойства металлов3. Температуры кипения и плавленияСамый
- 18. Физические свойства металлов 3. Температуры кипения и плавления
- 19. Физические свойства металлов4. ТвердостьСамый твердый – хром
- 20. Физические свойства металлов 3. Твердость
- 21. Физические свойства металлов5. ПлотностьПлотность тем меньше, чем
- 22. Физические свойства металлов5. Плотность
- 23. Физические свойства металлов5. ПластичностьПластичность - способность изменять
- 24. Химические свойства металлов Взаимодействие с простыми веществамиС кислородом большинство
- 25. Химические свойства металлов Взаимодействие с простыми веществамиС галогенами металлы
- 26. Химические свойства металлов Взаимодействие с простыми веществамиС азотом некоторые
- 27. Химические свойства металлов Взаимодействие с простыми веществамиС водородом самые
- 28. Химические свойства металлов Взаимодействие со сложными веществами
- 29. Химические свойства металлов Взаимодействие со сложными веществами
- 30. Химические свойства металлов Взаимодействие со сложными веществами
- 31. Химические свойства металлов Взаимодействие со сложными веществами
- 32. Металлы в природе
- 33. Металлы в природе
- 34. Металлы в природе В САМОРОДНОМ ВИДЕзолотосеребромедьплатина
- 35. Металлы в природе КАРБОНАТЫМалахит Cu2(OH)2CO3Магнезит MgCO3Мрамор CaCO3
- 36. Металлы в природе ХЛОРИДЫКаменная соль NaClКарналлитKCl*MgCl2*6H2OСильвин KCl
- 37. Металлы в природе СУЛЬФИДЫГаленит PbSПирит FeS2Медный блеск CuS
- 38. Металлы в природе ОКСИДЫМагнетит Fe3O4Лимонит 2Fe2O3* 3H2OГематит Fe2O3Каолин Al2O3*2SiO2*2H2O
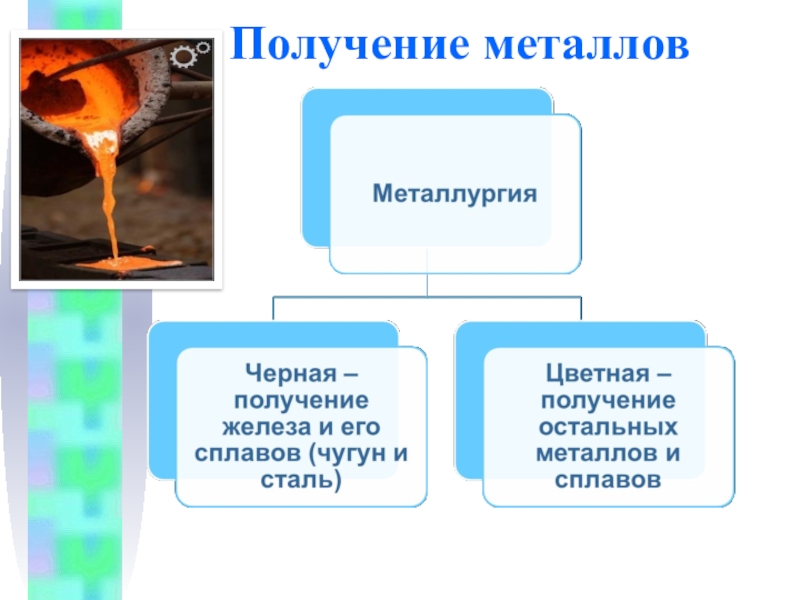
- 39. Получение металловМинералы и горные породы, содержащие металлы
- 40. Получение металлов
- 41. Получение металлов ПИРОМЕТАЛЛУРГИЯВосстановление металлов из руд при
- 42. Восстановление углем или угарным газом: CuO + C
- 43. Получение металлов ГИДРОМЕТАЛЛУРГИЯПолучение металлов из растворов их
- 44. Получение металлов ЭЛЕКТРОМЕТАЛЛУРГИЯ Электрометаллургия – это
- 45. Применение металлов1. Ядерная энергетика (U). 2. Производство
- 46. Применение металловМеталлы составляют одну из основ цивилизации
- 47. Применение металловВ медицине благородные металлы применяют для
- 48. Применение металловХорошо известно бактерицидное действие малых концентраций
- 49. Применение металловВ электротехнической промышленности алюминий и его
- 50. Применение металлов Также широко алюминий применяется в
Слайд 2«Металлы отверзают недро земное к плодородию; металлы служат нам в ловлении
Слайд 3Металлы в истории человечества
Семь металлов создал свет
По числу семи планет:
Медь, железо, серебро…
Дал на Космос на добро.
Злато, олово, свинец…
Сын мой, сера – их отец.
А еще ты должен знать:
Всем им ртуть – родная мать.
Слайд 5Понятие о металлах
Мета́лл (название происходит от лат.Мета́лл (название происходит от лат. metallum —
Металлы – это химические элементы, атомы которых способны только отдавать электроны, имеют низкие значения электроотрицательности (от 0,7 до 2,0), им соответствуют простые вещества, металлы.
К металлам относятся примерно 70 % всех химических элементов
Слайд 6Металлы в периодической системе
Левый нижний угол относительно диагонали В-At + все
Слайд 7Металлы в периодической системе
К элементам - металлам относятся:
s - элементы
а также p- элементы главных подгрупп:
III (кроме бора),
IV (Ge, Sn, Pb),
V (Sb,Bi) и VI (Po).
Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Низшая степень окисления Ме = 0, высшая =№ группы (искл.Ι-Б и VΙΙ-Б).
Слайд 8Особенности строения атомов металлов
Внешних (валентных) электоронов мало (у типичных металлов 1-3):
Радиусы
ВСЕ МЕТАЛЛЫ ВОССТАНОВИТЕЛИ
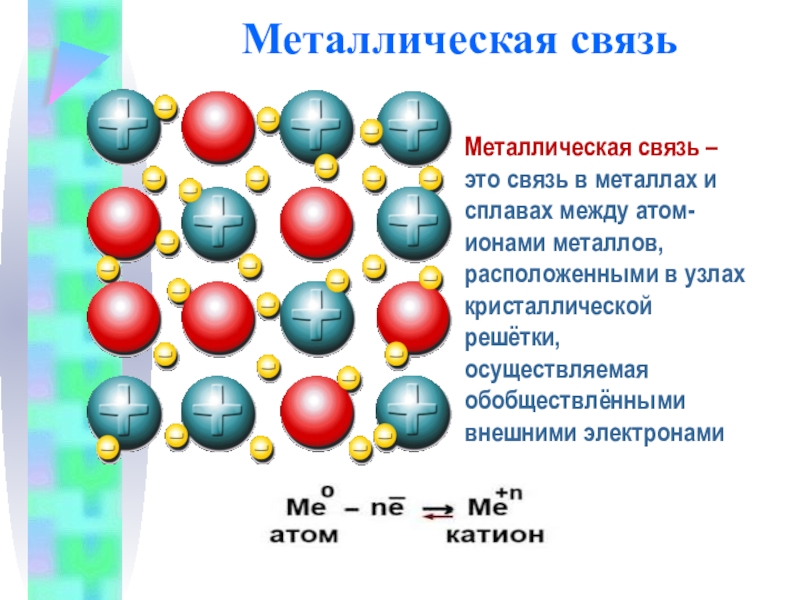
Слайд 10Металлическая связь
Металлическая связь – это связь в металлах и сплавах между
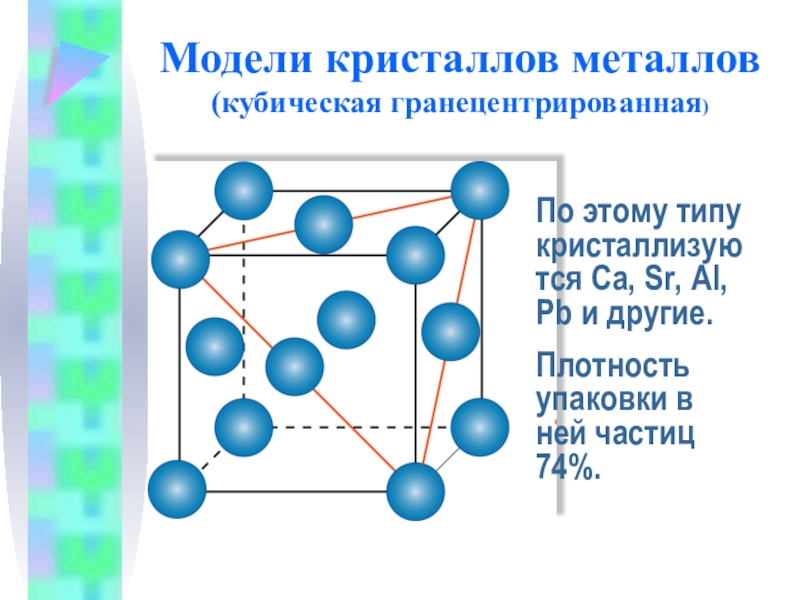
Слайд 12Модели кристаллов металлов
(кубическая гранецентрированная)
По этому типу кристаллизуются Са, Sr, Al, Pb
Плотность упаковки в ней частиц 74%.
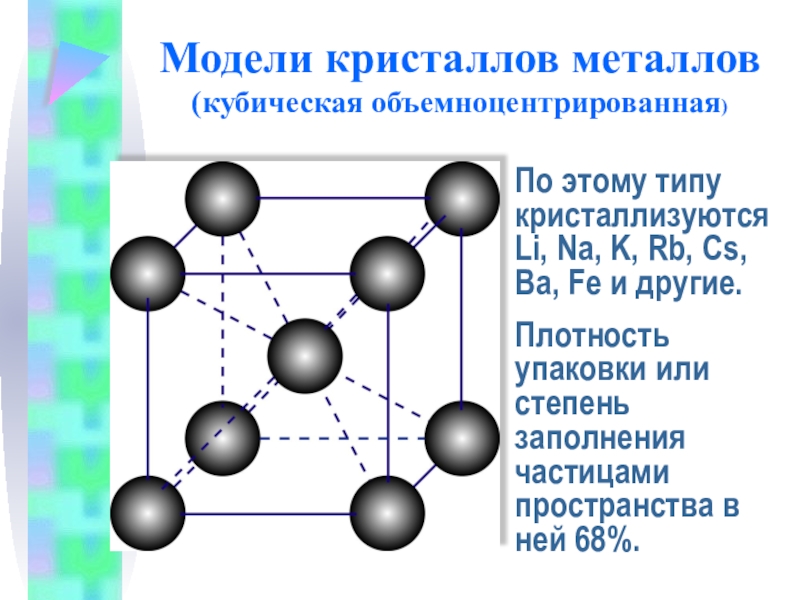
Слайд 13Модели кристаллов металлов
(кубическая объемноцентрированная)
По этому типу кристаллизуютсяLi, Na, K, Rb, Cs,
Плотность упаковки или степень заполнения частицами пространства в ней 68%.
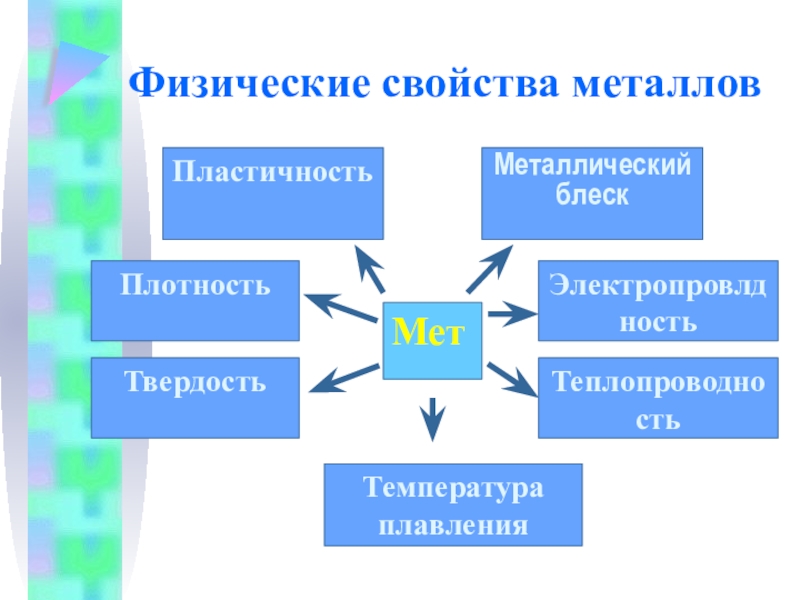
Слайд 14Физические свойства металлов
Мет
Пластичность
Металлический блеск
Плотность
Твердость
Теплопроводность
Электропровлдность
Температура плавления
Слайд 15Физические свойства металлов
1. Металлический блеск
Самые блестящие металлы – Hg, Ag, Pd.
В порошке все металлы, кроме Al и Mg,
теряют блеск и имеют чёрный или
тёмно-серый цвет.
Слайд 16Физические свойства металлов
2. Электро- и теплопроводность
В ряду Ag→Cu → Al →
Наименьшая электропроводность в ряду Mn → Pb → Hg
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
Слайд 17Физические свойства металлов
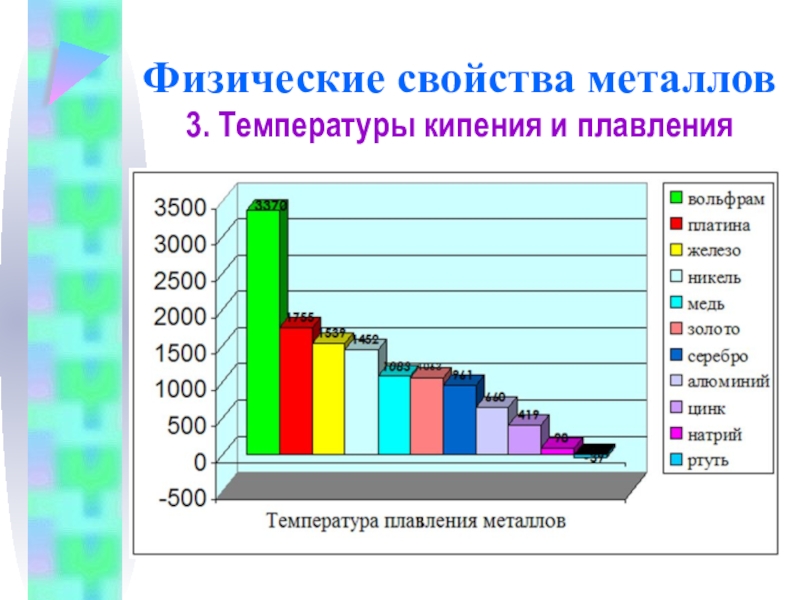
3. Температуры кипения и плавления
Самый легкоплавкий металл – ртуть
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Ртуть
Вольфрам
Слайд 19Физические свойства металлов
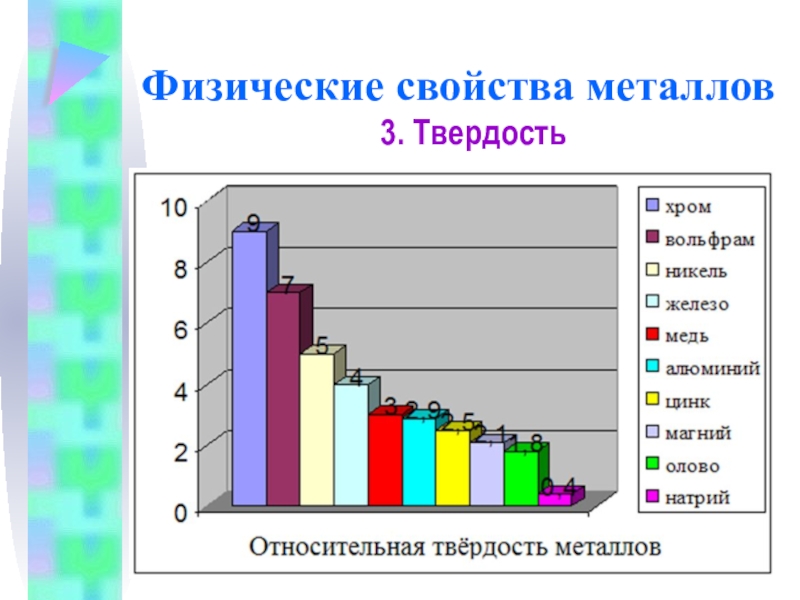
4. Твердость
Самый твердый – хром (режет стекло).
Самые мягкие –
Хром
Щелочные металлы
Слайд 21Физические свойства металлов
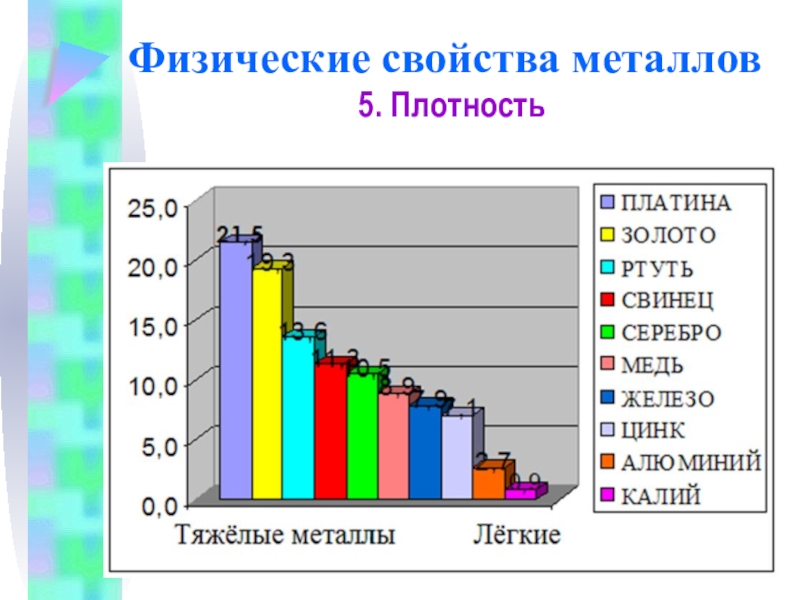
5. Плотность
Плотность тем меньше, чем меньше атомная масса металла
Самый легкий – литий (ρ =0,53 г/см3), всплывает в керосине.
Самый тяжелый – осмий (ρ =22,6 г/см3
осмий, не только самый тяжелый, но и самый дорогой металл
Литий – самый лёгкий металл
Золото – один из тяжёлых металлов
Слайд 23Физические свойства металлов
5. Пластичность
Пластичность - способность изменять форму при ударе, вытягиваться
Au→Ag → Cu → Sn → Pb → Zn → Fe уменьшается.
Сусальное золото
Слайд 24Химические свойства металлов
Взаимодействие с простыми веществами
С кислородом большинство металлов образует оксиды – амфотерные
4Li + O2 = 2Li2O,
4Al + 3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2.
Слайд 25Химические свойства металлов
Взаимодействие с простыми веществами
С галогенами металлы образуют соли галогеноводородных кислот
С серой металлы образуют сульфиды – соли сероводородной кислоты
Zn + S = ZnS
Слайд 26Химические свойства металлов
Взаимодействие с простыми веществами
С азотом некоторые металлы образуют нитриды, реакция практически
3Mg + N2 = Mg3N2
С углеродом образуются карбиды
4Al + 3C = Al3C4
С фосфором – фосфиды:
3Ca + 2P = Ca3P2.
Слайд 27Химические свойства металлов
Взаимодействие с простыми веществами
С водородом самые активные металлы образуют ионные гидриды
2Na + H2 = 2NaH
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au
Слайд 28Химические свойства металлов
Взаимодействие со сложными веществами
С ВОДОЙ
Активные металлы
энергично
при обычных условиях
Ca + 2H2O → Ca(OH)2 + H2↑
Металлы средней активности взаимодействуют с водой при нагревании
3Fe + 4H2O → Fe2O3·FeO + 4H2
Неактивные металлы с водой не реагируют
Слайд 29Химические свойства металлов
Взаимодействие со сложными веществами
С КИСЛОТАМИ
С растворами кислот реагируют металлы,
1. в ряду активности стоят до водорода.
При этом чем левее стоит метал, тем активнее он вытесняет водород;
Li K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Au Вытесняют водород из кислот Не вытесняют водород
2. образуют с этими кислотами растворимые соли.
Это необходимо для того, чтобы на поверхности металла не образовалась защитная солевая пленка
Слайд 30Химические свойства металлов
Взаимодействие со сложными веществами
С КИСЛОТАМИ
При взаимодействии металлов с азотной
Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Слайд 31Химические свойства металлов
Взаимодействие со сложными веществами
С СОЛЯМИ
С солями менее активных металлов,
Слайд 38 Металлы в природе
ОКСИДЫ
Магнетит Fe3O4
Лимонит
2Fe2O3* 3H2O
Гематит Fe2O3
Каолин
Al2O3*2SiO2*2H2O
Слайд 39Получение металлов
Минералы и горные породы, содержащие металлы и их соединения и
Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.
Плавка металла в Древнем Египте (дутьё подаётся мехами, сшитыми из шкур животных).
Слайд 41Получение металлов
ПИРОМЕТАЛЛУРГИЯ
Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль
Соли кислородсодержащих кислот – термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Слайд 42Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO
Водородотермия:
Cr2O3 + H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3
Такими способами получают металлы средней активности и неактивные.
Слайд 43Получение металлов
ГИДРОМЕТАЛЛУРГИЯ
Получение металлов из растворов их солей.
Перевод нерастворимого соединения в раствор:
CuO
Восстановление металла из раствора:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают Cu, Ag, Au, Zn, Mo, U и другие металлы.
Слайд 44Получение металлов
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электрометаллургия – это способы получения металлов с помощью электрического
2NaCl → 2Na + Cl2
MgBr2 → Mg + Br2
Слайд 45Применение металлов
1. Ядерная энергетика (U).
2. Производство осветительных приборов (W, Mo).
3. Медицина
Слайд 46Применение металлов
Металлы составляют одну из основ цивилизации на планете Земля. Среди
Слайд 47Применение металлов
В медицине благородные металлы применяют для изготовления инструментов, деталей приборов,
Слайд 48Применение металлов
Хорошо известно бактерицидное действие малых концентраций серебра на
питьевую воду. При
Слайд 49Применение металлов
В электротехнической промышленности алюминий и его сплавы применяют для изготовления
Алюминиевая фольга стала очень распространенным упаковочным материалом, так как она гораздо прочнее и дешевле оловянной. Также алюминий стал широко использоваться для изготовления тары для консервирования и храпения продуктов сельского хозяйства. Но хранение не ограничивается маленькими баночками, алюминий используется для строительства зернохранилищ и других быстровозводимых сооружений, востребованных в сельском хозяйстве.
Слайд 50Применение металлов
Также широко алюминий применяется в военной промышленности при строительстве самолетов,
Широкое применение алюминий высокой чистоты находит в таких новых областях техники как ядерная энергетика, полупроводниковая электроника, радиолокация. Большое распространение алюминий получил как антикоррозийное покрытие, он прекрасно защищает металлические поверхности от действия различных химических веществ и атмосферной коррозии.
Широко используется еще одно полезное свойство алюминия - его высокая отражающая способность. Поэтому из него изготовливаются различные отражающие поверхностеи нагревательных и осветительных рефлекторов и зеркал.