- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Металлы, 9 класс
Содержание
- 1. Презентация по химии на тему Металлы, 9 класс
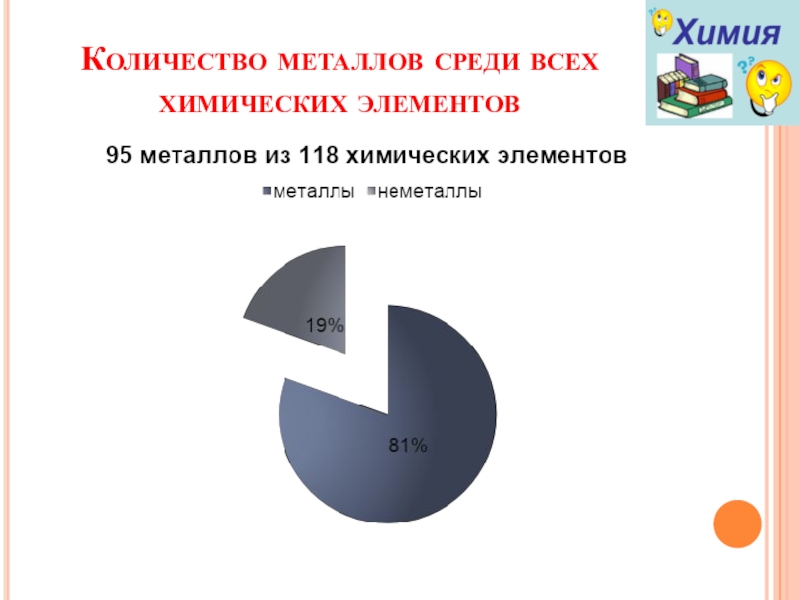
- 2. Количество металлов среди всех химических элементов
- 3. Расположение элементов – металлов в ПСХЭ:1 группа
- 4. Большая часть металлов существует в природе в
- 5. Металлы – это химические элементы, атомы которых
- 6. Главные особенности элементов металлов.Число валентных электронов
- 7. Химическая металлическая связь.Металлическая связь – это связь
- 8. Металлы – простые вещества.Все металлы обладают
- 9. Слайд 9
- 10. Взаимодействие металлов с галогенами
- 11. Взаимодействие металлов с кислородомАктивныеметаллы O
- 12. o +1
- 13. Химические свойства металлов1. Все металлы проявляют только
- 14. Применение металлов
- 15. Проверь себя:Какие из соединений вступают в реакцию с металлами:О2K2OCuSO4H2OSBaSO4 H2SO4CrFe2O3
- 16. Спасибо за внимание!
Слайд 1
Муниципальное бюджетное общеобразовательное учреждение
Долгокычинская средняя
Металлы
9 класс
Автор:
Учитель химии
Зарубина Наталья Романовна
с. Долгокыча
2017
Слайд 3Расположение
элементов – металлов
в ПСХЭ:
1 группа главная подгруппа – щелочные
2 группа главная подгруппа – щелочно-земельные металлы
3 группа главная подгруппа – все кроме бора
4 группа главная подгруппа – все кроме углерода и кремния
5 группа главная подгруппа – сурьма и висмут
6 группа главная подгруппа – только полоний
Во всех побочных подгруппах – только металлы
Слайд 4Большая часть металлов существует в природе в виде минеральных образований -
Некоторые неактивные металлы существуют в виде самородков: золото, серебро, платина, медь
Нахождение в природе
Слайд 5Металлы – это химические элементы, атомы которых отдают электроны внешнего (
o 2+
Fe – 2e → Fe
Слайд 6Главные особенности
элементов металлов.
Число валентных электронов (1-3 ).
Сравнительно большие радиусы атомов.
Небольшие
Некоторые химические элементы металлы обладают двойственными свойствами: Al, Zn, Fe… (амфотерность).
Исключительно восстановительные свойства
( отдают свои электроны).
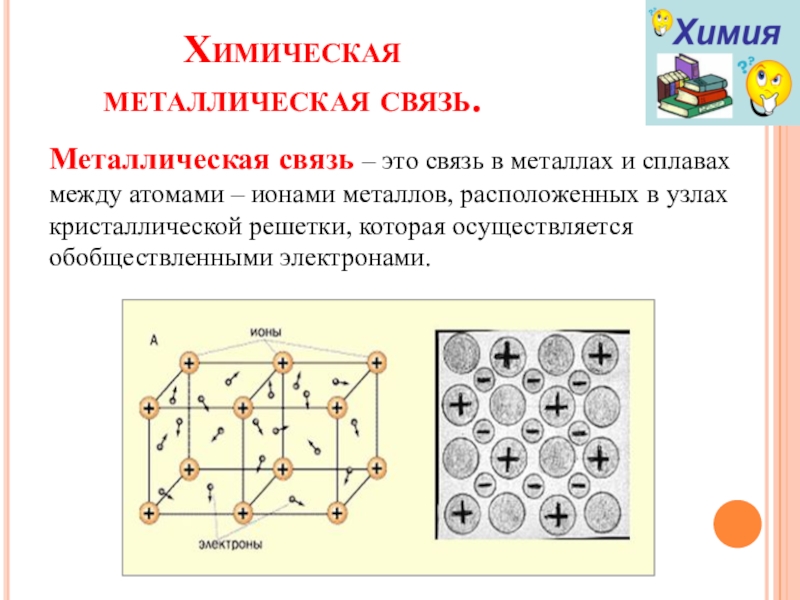
Слайд 7Химическая металлическая связь.
Металлическая связь – это связь в металлах и сплавах
Слайд 8Металлы – простые
вещества.
Все металлы обладают общими физическими свойствами:
Пластичность – смещение
Металлический блеск – наличие свободных электронов.
Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.
Слайд 10Взаимодействие металлов с галогенами
o
2Са + Н 2О → 2Сa(ОН)
o +3 -1
2Sb + 2Cl2 → 2SbCl3
o o +3 -1
2Fe + 3Cl2 → 2FeCl3
Взаимодействие металлов с серой
o o +2 -2
Fe + S → FeS
o o +3 -2
2Al + 3S → Al2S3
Взаимодействие металлов с водой
o +1 +1 -1 o
2К + 2H2O = 2КOH + H2
(Щелочные и щелочно-земельные металлы)
o +1 to
3Fe + 4H2O → Fe3O4 + 4H2↑
(малоактивные)
Химические свойства металлов
o o +1 -1
2Na + Cl2 → 2NaCl
2
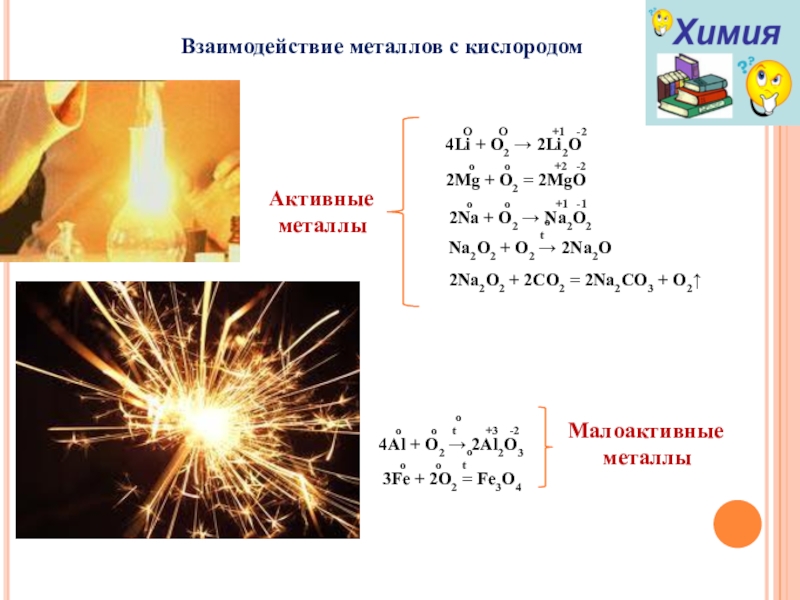
Слайд 11Взаимодействие металлов с кислородом
Активные
металлы
O O
4Li + O2 → 2Li2O
o o +2 -2
2Mg + O2 = 2MgO
o o +1 -1
2Na + O2 → Na2O2
to
Na2O2 + O2 → 2Na2O
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Малоактивные
металлы
o o to +3 -2
4Al + O2 → 2Al2O3
o o to
3Fe + 2O2 = Fe3O4
Слайд 12 o +1 -1
Zn + 2HCl → ZnCl2 + H2
Взаимодействие металлов с кислотами
o + +2 o
Zn + 2H → Zn + H2
o + 2+ o
2CH3COOH + Zn → (CH3COO)2Zn + H2
o + 2+ o
Zn + 2H → Zn + H2↑
Взаимодействие металлов с солями
Fe + CuSO4 → Cu↓ +FeSO4
o 2+ o 2+
Fe + Cu → Cu + Fe
(окислительно-восстановительная реакция)
o
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
o + 2+ o
Cu + 2Ag → Cu + Ag↓
Слайд 13Химические свойства металлов
1. Все металлы проявляют только восстановительные свойства
2. Атомы металлов
3. Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов.
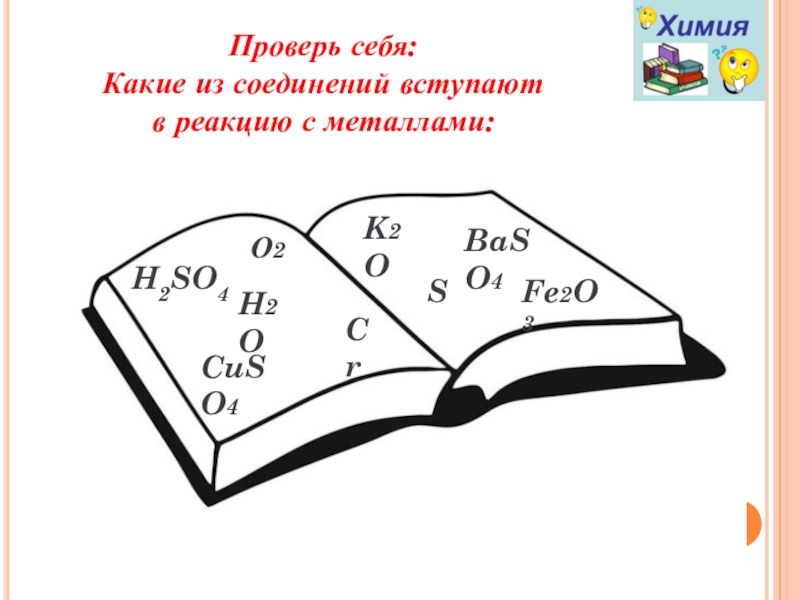
Слайд 15Проверь себя:
Какие из соединений вступают
в реакцию с металлами:
О2
K2O
CuSO4
H2O
S
BaSO4
Cr
Fe2O3