- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Металлы и их соединения (9 класс)
Содержание
- 1. Презентация по химии на тему Металлы и их соединения (9 класс)
- 2. Цели урока: 1. В игровой форме обобщить
- 3. Задачи урока: Образовательные: Систематизировать знания учащихся о
- 4. «Металлов много есть, но дело не
- 5. Тема урока «Металлы и их соединения»
- 6. Эпиграф урока:«Учиться, а время от времени повторять изученное, разве это не приятно»? Конфуций
- 7. Эпиграф урока«Просто знать – еще не все,
- 8. Этап I. РАЗМИНКАРешите альтернативный тест – выбор
- 9. 1.Активный щелочной металл. 2.Амфотерный металл.3.Мягкий металл, режется ножом.4.На
- 10. Взаимопроверка
- 11. Этап II. Положение металлов в ПСХЭ Д.И.Менделеева
- 12. ВСПОМНИТЕ:Как расположены металлы в ПСХЭ Д.И.Менделеева?
- 13. Этап III. Строение атомов металловСоставьте схемы строения
- 14. ПРОВЕРЬТЕ СЕБЯ:Строение атомов металлов в периодеСтроение атомов металлов в группе+11281Na+12282MgAl+13283+3+11+19LiNaK212812881
- 15. Общий вывод о строении атомов металлов: Для
- 16. Этап IV. Физические свойства металлов
- 17. Вспомните:Каковы общие физические свойства металлов? Поясните эти свойства, основываясь на представлениях о металлической связи.
- 18. Слайд 18
- 19. Этап V. Химические свойства металлов и их соединений
- 20. Вспомните:Все реакции с участием металлов являются окислительно
- 21. Положение металлов в электрохимическом ряду напряжений металлов
- 22. Тест «Химические свойства металлов»ВАРИАНТ 11. С водой
- 23. Тест «Химические свойства металлов»
- 24. ФИЗКУЛЬТМИНУТКА
- 25. СОСТАВЬТЕ И РЕШИТЕ ЦЕПОЧКУ ПРЕВРАЩЕНИЙ
- 26. Команда 1Сu → CuO → CuSO4 →
- 27. Проверьте себя:
- 28. Проверьте себя:
- 29. Этап VI. Конкурс капитанов«ОЧУМЕЛЫЕ РУЧКИ»
- 30. Задание проделайте химические реакции, подтверждающие качественный
- 31. Химические свойства соединений металловВспомните правила Т/Б!
- 32. Конкурс «Вопрос-ответ»
- 33. Вопрос 1. В какой металл упаковывают еду для космонавтов и конфеты для сладкоежек?
- 34. Вопрос 2. На долю этого металла приходится
- 35. Вопрос 3. Горькая или английская соль, в
- 36. Вопрос 4. Важнейшая соль, из которой
- 37. Вопрос 5. Академик А.Е.Ферсман писал, что при
- 38. Вопрос 6. Этот металл входит в состав
- 39. Вопрос 7. Я не менее красивый металл,
- 40. Вопрос 8. При недостатке этого металла нарушается
- 41. Вопрос 9. Этот металл входит в состав
- 42. Вопрос 10. Этот металл может исцелять. Если
- 43. Вопрос 11. Этот элемент является самым распространенным
- 44. Вопрос 12. Без хлорофилла не было бы
- 45. Вопрос 13. Соединение, представляющее собой сульфат металла,
- 46. Вопрос 14. Этот элемент входит в состав
- 47. ПРОВЕРИМ КАПИТАНОВ
- 48. реакции, подтверждающие наличие иона Al 3+ -
- 49. реакции, подтверждающие наличие иона Fe 3+ -
- 50. 2) реакции, подтверждающие наличие иона Cl- -
- 51. V. Домашнее задание.Повторить параграфы 4- 13
- 52. Продолжи любую фразу:1) Сегодня мне захотелось ...2) Самым
- 53. Подведение итогов. Уровень усвоения темы:1) Легко справился
- 54. СПАСИБО ВСЕМ ЗА УРОК!
Слайд 1МЕТАЛЛЫ И ИХ СОЕДИНЕНИЯ
Урок по неорганической химии в 9 классе.
Автор: Гвоздева
учитель химии МБОУ СОШ №6
г. Озеры Московской области
Слайд 2Цели урока:
1. В игровой форме обобщить полученные знания о металлах главных
2. Закрепить умения и навыки в составлении уравнений реакций, отражающих химические свойства металлов; в решении экспериментальных и расчетных задач различного типа.
3. Способствовать развитию способности работать в группах, принимать чужое мнение и аргументировать своё, коммуникативной компетентности учащихся.
4. Привить интерес к химии, расширить знания о биологическом значении металлов, показать связь изучаемой темы с жизнью.
Слайд 3Задачи урока:
Образовательные:
Систематизировать знания учащихся о металлах, повторить свойства, присущие
Совершенствовать умения составлять уравнения химических реакций
Развивающие:
Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Совершенствовать навыки химического эксперимента.
Способствовать развитию исследовательских навыков
Совершенствовать умения обобщать и делать выводы.
Воспитательные:
Выработать у учащихся аккуратность при работе с химическими реактивами.
Способствовать у учащихся воспитанию умения работать в коллективе.
Слайд 4 «Металлов много есть, но дело не в количестве: В команде
Слайд 6Эпиграф урока:
«Учиться, а время от времени повторять изученное, разве это не
Конфуций
Слайд 8Этап I. РАЗМИНКА
Решите альтернативный тест – выбор правильного ответа из множества.
I
II вариант - для алюминия
Слайд 91.Активный щелочной металл.
2.Амфотерный металл.
3.Мягкий металл, режется ножом.
4.На внешнем электронном уровне этого
5. Проявляет степень окисления +1.
6. Активно реагирует с водой при комнатной температуре.
7. Вступает в реакции при комнатной температуре после снятия защитной пленки.
8. При взаимодействии с кислородом образует пероксид.
9. Этот металл используют для восстановления металлов из их оксидов.
10. При взаимодействии с кислородом образует оксид.
11. Получают из бокситов и нефелинов.
12. Этот металл получают электролизом расплава его солей.
1 2 3 4 5 6 7 8 9 10 11 12
Слайд 12
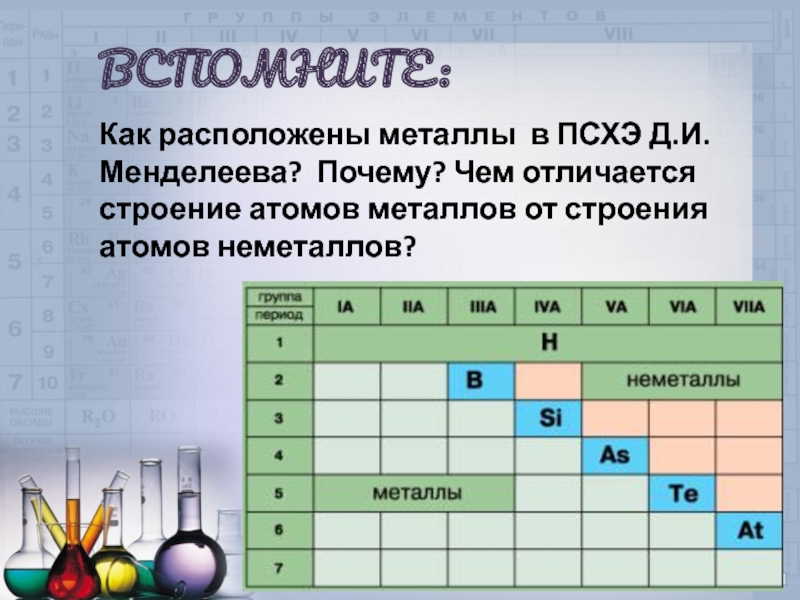
ВСПОМНИТЕ:
Как расположены металлы в ПСХЭ Д.И.Менделеева? Почему? Чем отличается строение
Слайд 13Этап III.
Строение атомов металлов
Составьте схемы строения электронных оболочек следующих атомов:
2 команда: б) лития, натрия, калия
Чем они отличаются? В чем особенности их строения?
Какой из металлов в каждой группе наиболее активен? Почему?
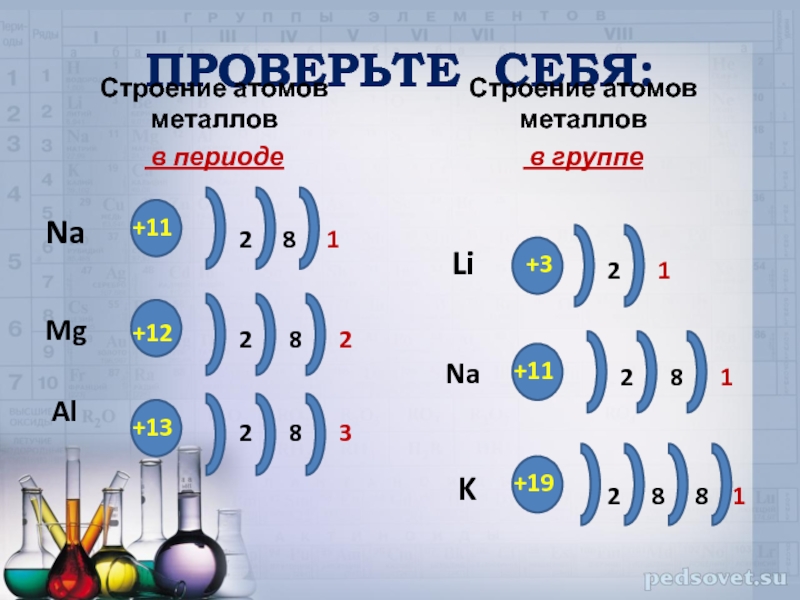
Слайд 14ПРОВЕРЬТЕ СЕБЯ:
Строение атомов металлов
в периоде
Строение атомов металлов
в группе
+11
2
8
1
Na
+12
2
8
2
Mg
Al
+13
2
8
3
+3
+11
+19
Li
Na
K
2
1
2
8
1
2
8
8
1
Слайд 15Общий вывод о строении атомов металлов:
Для атомов металлов характерно небольшое
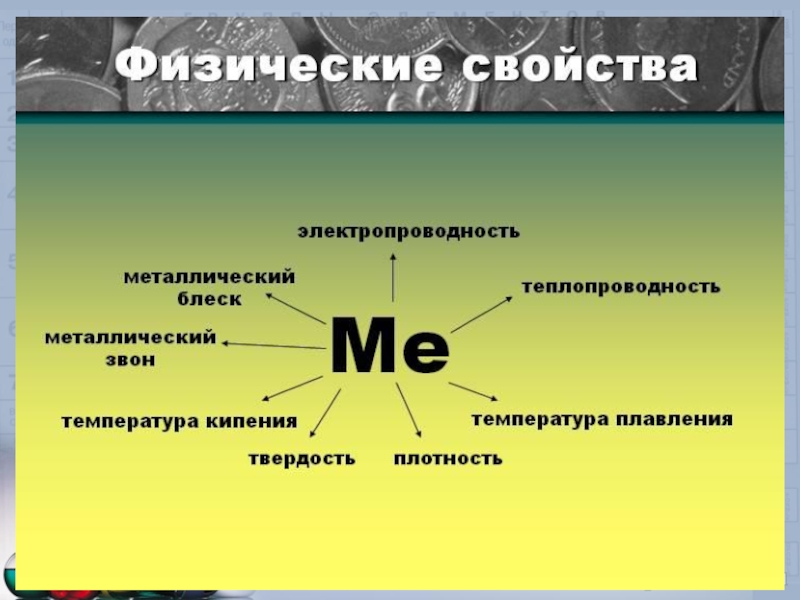
Слайд 17Вспомните:
Каковы общие физические свойства металлов? Поясните эти свойства, основываясь на представлениях
Слайд 20Вспомните:
Все реакции с участием металлов являются окислительно – восстановительными. Какова роль
Каковы химические свойства металлов? Перечислите, с какими веществами они взаимодействуют?
Почему разные металлы с одним и тем же веществом взаимодействуют по-разному?
Слайд 22Тест «Химические свойства металлов»
ВАРИАНТ 1
1. С водой с образованием растворимого гидроксида
а) К; б) Zn; в) Pb; г) Ag.
2. Какой из металлов энергичнее реагирует с кислородом:
а) Fe; б) Hg; в) Ag; г) Cu.
3. С соляной кислотой не будет взаимодействовать:
а) Fe; б) Al; в) Zn; г) Сu
4. С водным раствором хлорида меди (II) взаимодействует:
а) Ag; б) Au; в) Zn; г) Hg
ВАРИАНТ 2
1. При горении натрия на воздухе образуется:
а) Na2O; б) Na2O2; в) NaO2; г) NaОН.
2. С водным раствором сульфата железа (II) не взаимодействует :
а) Mg; б) Cu; в) Al; г) Zn
3. С соляной кислотой энергичнее всех будет взаимодействовать:
а) Al; б) Pb; в) Mg; г) Fe
4. С водным раствором гидроксида натрия взаимодействует:
а) Cu; б) Ca; в) Mg; г) Al.
Слайд 26Команда 1
Сu → CuO → CuSO4 → Cu(OH)2 → CuO →
Команда 2
Mg → MgCl2 → Mg(OH)2 → MgSO4 → MgCO3 → MgO
Для 5 реакции - расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. ( + еще 1 балл)
Для 3 реакции – запишите полное и сокращенное ионное уравнение реакции. (+ еще 1 балл)
Для 1 реакции - расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель. ( + еще 1 балл)
Для 2 реакции – запишите полное и сокращенное ионное уравнение реакции. ( + еще 1 балл)
Слайд 30Задание проделайте химические реакции, подтверждающие качественный состав следующих соединений: Капитан команды 1
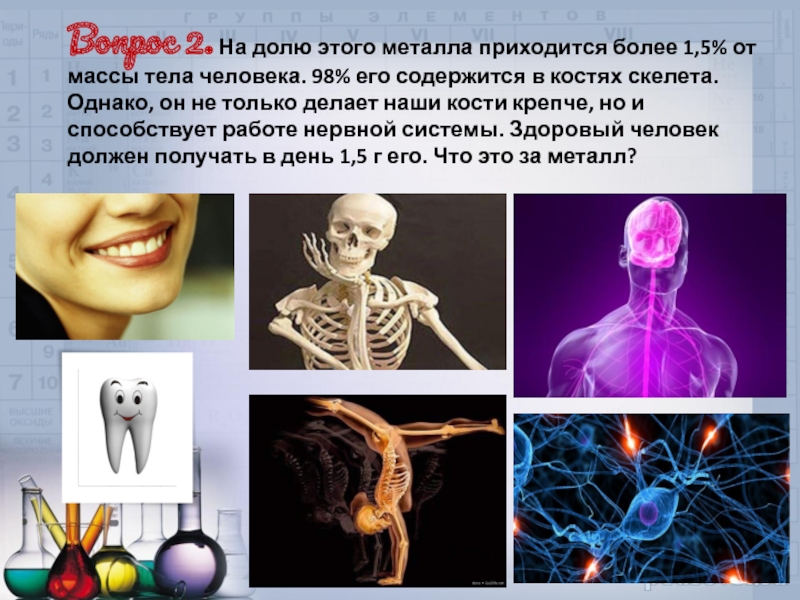
Слайд 34Вопрос 2. На долю этого металла приходится более 1,5% от массы
Слайд 35Вопрос 3. Горькая или английская соль, в состав которой входит этот
Слайд 36Вопрос 4. Важнейшая соль, из которой многочисленные морские животные (моллюски,
Слайд 37Вопрос 5. Академик А.Е.Ферсман писал, что при отсутствии этого металла «…
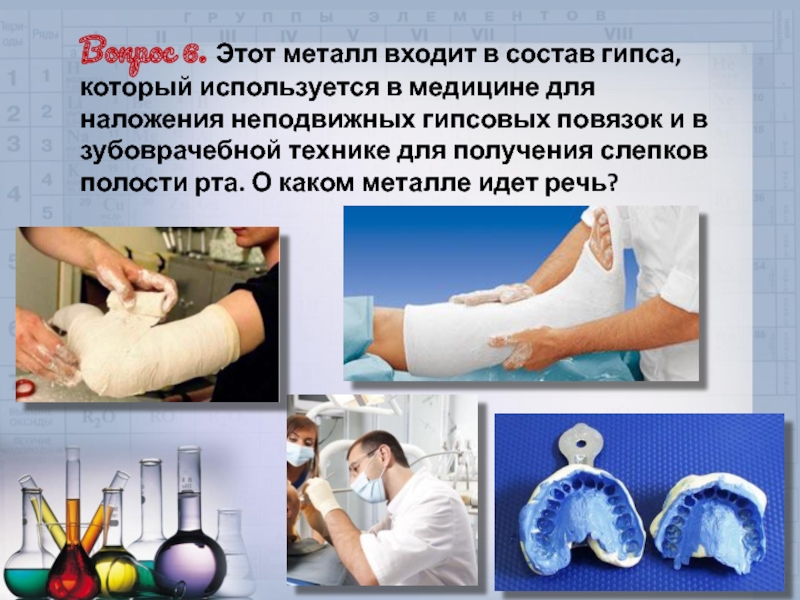
Слайд 38Вопрос 6. Этот металл входит в состав гипса, который используется в
Слайд 39Вопрос 7. Я не менее красивый металл, чем золото. Мой род
Слайд 40Вопрос 8. При недостатке этого металла нарушается обмен веществ у растений
Слайд 41Вопрос 9. Этот металл входит в состав физиологического раствора и питьевой
Слайд 42Вопрос 10. Этот металл может исцелять. Если хранить воду в сосудах,
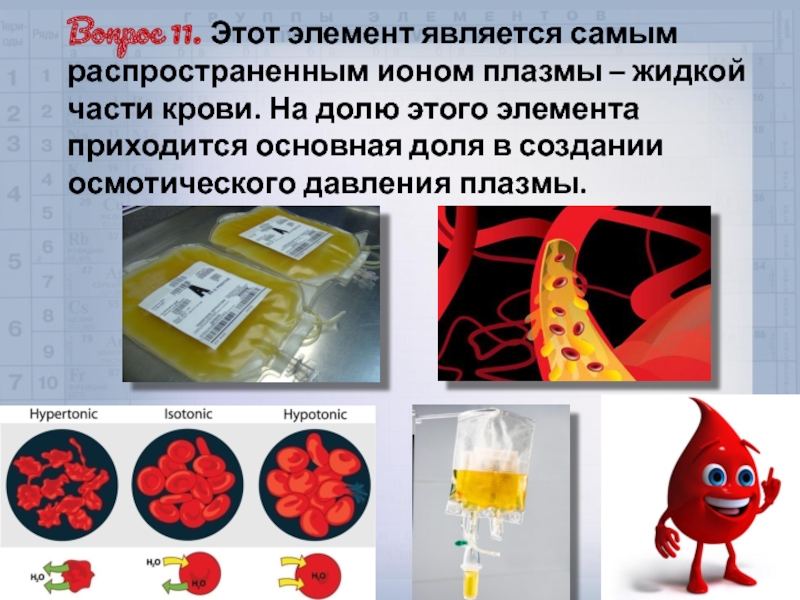
Слайд 43Вопрос 11. Этот элемент является самым распространенным ионом плазмы – жидкой
Слайд 44Вопрос 12. Без хлорофилла не было бы жизни, а без этого
Слайд 45Вопрос 13. Соединение, представляющее собой сульфат металла, помогает обнаруживать детали конструктора
Слайд 46Вопрос 14. Этот элемент входит в состав многих ферментов, оказывает стимулирующее
Слайд 48реакции, подтверждающие наличие иона Al 3+ - взаимодействие сульфата алюминия с
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
Al(OH)3 + NaOH = NaAlO2 + 2H2O
2) реакции, подтверждающие наличие иона SO42- - взаимодействие сульфата алюминия с водным раствором хлорида бария:
Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4
(выпадение белого осадка)
Слайд 49реакции, подтверждающие наличие иона Fe 3+ - взаимодействие хлорида железа (III)
FeCl3 + 3KNCS = Fe(NCS)3 + 3KCl
(Кроваво-красное окрашивание)
(можно вместо роданида калия или аммония взять желтую кровяную соль К4(Fe(CN)6):
3К4(Fe(CN)6) + 4 FeCl3 = Fe4(Fe(CN)6)3 +6KCl (темно-синий осадок – берлинская лазурь)
А можно – с водным раствором щелочи:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl (Бурый осадок)
Слайд 50
2) реакции, подтверждающие наличие иона Cl- - взаимодействие хлорида железа (III)
FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl
(белый творожистый осадок)
Слайд 52Продолжи любую фразу:
1) Сегодня мне захотелось ...
2) Самым интересным на уроке было...
3)
4) Сегодня я понял...
5) Теперь я могу ...
6) Сегодня я задумался....
7) Было трудно …
8) Меня удивило …
9) Я выполнял задания …
Слайд 53Подведение итогов. Уровень усвоения темы:
1) Легко справился с заданиями. К контрольной
2) Иногда испытывал затруднения. Необходимо повторить некоторые вопросы темы.
3) С большей частью заданий не справился. Перед контрольной работой нужно хорошо повторить всю тему.