Баймагамбетова Г.С.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Менделеевтің периодтық заңы
Содержание
- 1. Презентация по химии на тему Менделеевтің периодтық заңы
- 2. Дмитрий Иванович МенделеевӨмір сүру жылдары:27 қаңтар 1834 ж-1907жТуған жері:Тобольск губерниясы
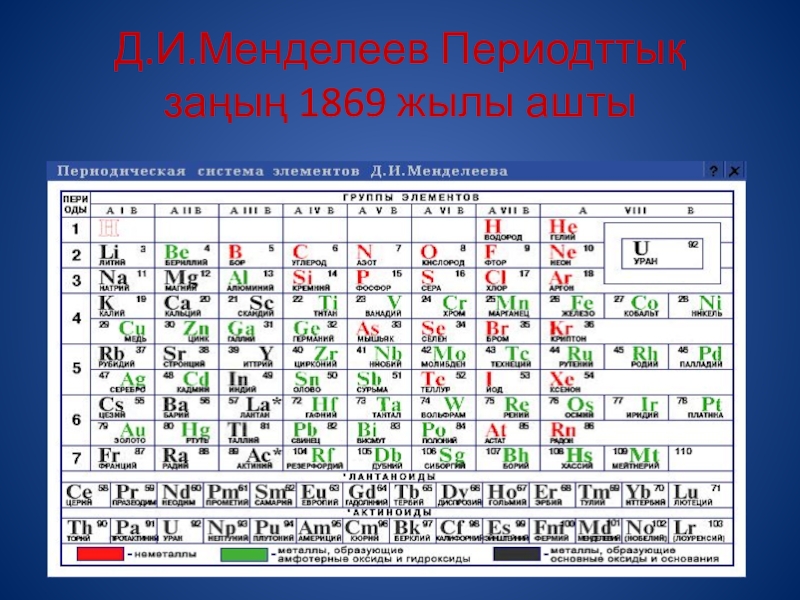
- 3. Д.И.Менделеев Периодттық заңың 1869 жылы ашты
- 4. Заңның шығуына себепші болған жағдайлар:Материалдың жиналуыОған дейінгі ғалымдардың жұмысы1860 ж. Карлсруэ қаласындағы химиктер съезіЖеке қасиеттері
- 5. Д.И.Менделеевке дейінгі ғалымдардың жұмысыЙ. Берцелиус (Металдар және
- 6. Д. Ньюлендстің Октав заңы
- 7. 1829жТРИАДАЛАРИоганДёрбенейрLi Na K6,9
- 8. Периодтар-химиялық элементтердің горизантальді орналасу қатары, 7 период
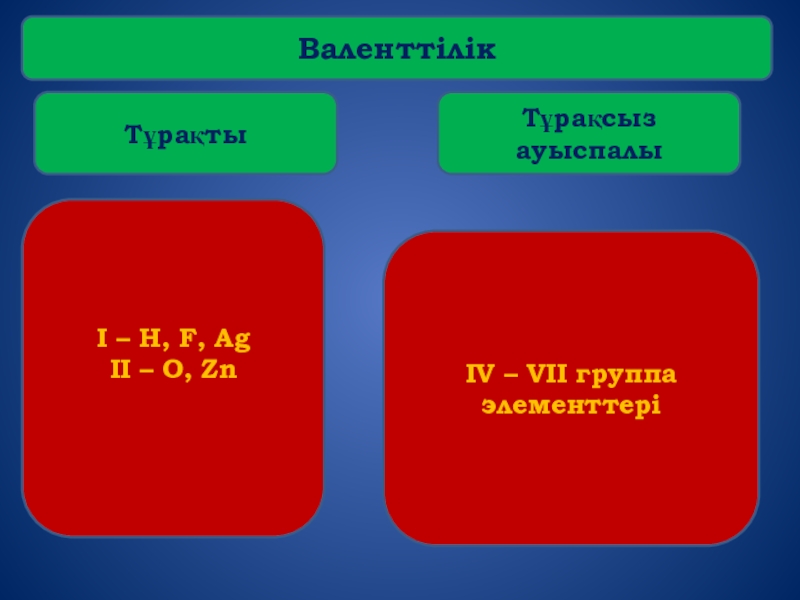
- 9. Валенттілік
- 10. Валенттілік дегеніміз-(лат. valentіa — күш) — атомның
- 11. Слайд 11
- 12. Валенттіліктің мәні берілген элементтің атомы ала
- 13. Элементтердің валенттілікіне қарап химиялық формулаларды жазуға болады.
- 14. Атомның негізгі (қозбаған) күйіндегі валенттілік оның сыртқы
- 15. Мысалы:
- 16. Валенттілік Тұрақты Тұрақсыз ауыспалы I – H,
- 17. соңы
Дмитрий Иванович МенделеевӨмір сүру жылдары:27 қаңтар 1834 ж-1907жТуған жері:Тобольск губерниясы
Слайд 2Дмитрий Иванович Менделеев
Өмір сүру жылдары:
27 қаңтар 1834 ж-1907ж
Туған жері:
Тобольск губерниясы
Слайд 4Заңның шығуына себепші болған жағдайлар:
Материалдың жиналуы
Оған дейінгі ғалымдардың жұмысы
1860 ж. Карлсруэ
қаласындағы химиктер съезі
Жеке қасиеттері
Жеке қасиеттері
Слайд 5Д.И.Менделеевке дейінгі ғалымдардың жұмысы
Й. Берцелиус (Металдар және бейметалдар)
И.В. Деберейнер (Триадлар)
Д.А.Р. Ньюлендс (Октавалар)
Л.Мейер
Слайд 7
1829ж
ТРИАДАЛАР
Иоган
Дёрбенейр
Li Na K
6,9 23,0
39,1
Ca Sr Ba
40,1 87,6 137,3
P As Sb
31,0 74,9 121,8
S Se Te
32,1 79,0 127,8
Cl Br I
35,5 79,9 126,9
(6,9+39,1):2 = 23,0
Слайд 8Периодтар-химиялық элементтердің горизантальді орналасу қатары, 7 период бар. Периодтар кіші-(І,ІІ,ІІІ) және
үлкен- (IV,V,VI), VII-аяқталмаған.
Әр период (Бірінші периодты санамағанда) металдан басталады (Li, Nа, К, Rb, Cs, Fr) және благородным газбен аяқталады (Не, Ne, Ar, Kr, Хе, Rn).
Әр период (Бірінші периодты санамағанда) металдан басталады (Li, Nа, К, Rb, Cs, Fr) және благородным газбен аяқталады (Не, Ne, Ar, Kr, Хе, Rn).
Слайд 10Валенттілік дегеніміз-(лат. valentіa — күш) — атомның басқа атомдарды немесе атомдар
тобын қосып алып химиялық байланыс құру қасиеті
Слайд 12 Валенттіліктің мәні берілген элементтің атомы ала алатын немесе орнын баса
алатын сутек атомдарының санымен өлшенеді.
Химияға валенттілік ұғымын 1853 ж. ағылшын химигі Э.Франкленд (1825 — 1899) енгізген
Химияға валенттілік ұғымын 1853 ж. ағылшын химигі Э.Франкленд (1825 — 1899) енгізген
Слайд 13Элементтердің валенттілікіне қарап химиялық формулаларды жазуға болады. Валенттілік теориясының дамуындағы жаңа
кезең атомның кванттық-механикалық теориясының жасалуымен байланысты. Валенттіліктің кванттық-механикалық теориясы бойынша элементтердің химиялық қасиеті және олардың валенттілік атомның сыртқы электрон қабатының құрылысына байланысты. Атомдар өзара әрекеттесіп химиялық байланыс түзулеріне тек сыртқы электрондық қабаттағы электрондар қатысады.
Слайд 14Атомның негізгі (қозбаған) күйіндегі валенттілік оның сыртқы электрондық қабатындағы жалқы (жұпсыз)
электрондар санына тең (яғни спиндері қанықпаған электрондар). Мысалы, инертті газдардың электрондарының бәрі жұпталған (жалқы электрондары жоқ), сондықтан олар нөл валентті, ал периодтық жүйенің І-тобындағы элементтер атомдарының сыртқы электрондық қабатында бір жалқы электрон болады, сондықтан олар бір валентті; ІІ-топ элементтері атомдарының сыртқы қабатында екі жалқы электрон бар, олар екі валентті, т.б.