- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кремний и его соединения (9 класс)
Содержание
- 1. Презентация по химии на тему Кремний и его соединения (9 класс)
- 2. Кремний как химический элементКремний Si – второй
- 3. Кремний как простое вещество Кристаллический кремнийтёмно-серое вещество
- 4. Аллотропные модификацииКремний как простое вещество Аморфный
- 5. ХИМИЧЕСКИЕ СВОЙСТВАПри стандартных условиях кремний химически инертен.Кремний
- 6. ХИМИЧЕСКИЕ СВОЙСТВА4. Кремний взаимодействует с концентрированными растворами
- 7. Соединения кремнияВодородное соединение – SiH4 Оксид кремния (IV) – SiO2 Кремниевая кислота – H2SiO3
- 8. Физические свойства: Бесцветный газ, ядовит, t°пл. =
- 9. Оксид кремния (IV) SiO2Оксид кремния (IV), или
- 10. Оксид кремния (IV) SiO2Халцедон Агат Яшма Сердолик
- 11. SiO2 – кислотный оксид. При сплавлении
- 12. ПолучениеКремний получают, восстанавливая его из оксида кремния
- 13. Физические свойства H2SiO3 – очень слабая (слабее
- 14. Химические свойстваПоскольку кремниевая кислота нерастворима в воде,
- 15. Соли кремниевой кислоты ПОЛУЧЕНИЕСиликаты можно получить сплавлением
- 16. Задание Осуществите превращения по схеме: Si → SiO2 → Na2SiO3 → H2SiO3 →SiO2
- 17. Источники ХИМИЯ – 9:Интернет-ресурсы: фото и рисунки;https://www.youtube.com/watch?v=7grm7heh9t0 – видео-опыт «Разложение кремниевой кислоты»
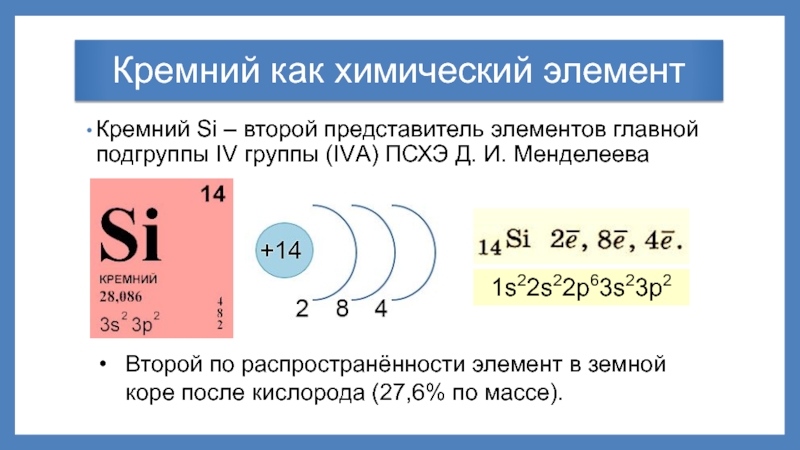
Слайд 2Кремний как химический элемент
Кремний Si – второй представитель элементов главной подгруппы
1s22s22p63s23p2
Второй по распространённости элемент в земной коре после кислорода (27,6% по массе).
Слайд 3Кремний как простое вещество
Кристаллический кремний
тёмно-серое вещество
с металлическим блеском,
большая твёрдость,
хрупок,
полупроводник;
ρ = 2,33 г/см3, t°пл. =1415°C; t°кип. = 2680°C,
имеет алмазоподобную структуру и образует прочные ковалентные связи,
инертен.
Аллотропные модификации
Слайд 4 Аллотропные модификации
Кремний как простое вещество
Аморфный кремний
бурый порошок,
гигроскопичен,
алмазоподобная
ρ = 2 г/см3,
более реакционноспособен.
Слайд 5ХИМИЧЕСКИЕ СВОЙСТВА
При стандартных условиях кремний химически инертен.
Кремний горит в кислороде, образуя
Будучи неметаллом, при нагревании кремний соединяется с металлами с образованием силицидов, например:
Кремний как простое вещество
Слайд 6ХИМИЧЕСКИЕ СВОЙСТВА
4. Кремний взаимодействует с концентрированными растворами щелочей, образуя силикаты и
5. Кремний взаимодействует с сильными окислителями, например, с кислотами, с образованием продуктов в степени окисления +4:
Si + 4HNO3 = SiO2 + 4NO2↑ + 2H2O
Кремний как простое вещество
Слайд 7Соединения кремния
Водородное соединение – SiH4
Оксид кремния (IV) – SiO2
Кремниевая
Слайд 8Физические свойства:
Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
Получение:
Mg2Si + 4HCl → 2MgCl2 + SiH4↑
Химические свойства:
1) Окисление: SiH4 + 2O2 t˚→ SiO2 + 2H2O
2) Разложение: SiH4 → Si + 2H2
Силан SiН4
Слайд 9Оксид кремния (IV) SiO2
Оксид кремния (IV), или диоксид кремния, или кремнезём
SiO2 твёрдое и тугоплавкое вещество t°пл.= 1728°C.
Не растворяется в воде и кислотах, кроме плавиковой.
Оксид кремния в природе:
Песок
Песок (обычный) представляет собой зерна кварца, которые в свою очередь являются формой существования кристаллического диоксида кремния в природе.
Слайд 10Оксид кремния (IV) SiO2
Халцедон
Агат
Яшма
Сердолик
Опал
Из разновидностей минералов
Причин этому две: распространённость и доступность кремня, а также его способность образовывать при сколе острые режущие края.
Слайд 11 SiO2 – кислотный оксид.
При сплавлении взаимодействует с основными оксидами,
ХИМИЧЕСКИЕ СВОЙСТВА
1. Реагирует с основными оксидами:
2. Взаимодействует при высоких температурах с щелочами с образованием солей кремниевой кислоты – силикатов:
3. Взаимодействует с карбонатами щелочных и щелочноземельных металлов:
Оксид кремния (IV) SiO2
Слайд 12Получение
Кремний получают, восстанавливая его из оксида кремния (IV) магнием или углеродом:
Применение
1.
2. Изготовление керамических изделий
3. Получение стекла
Оксид кремния (IV) SiO2
Слайд 13Физические свойства
H2SiO3 – очень слабая (слабее угольной), непрочная, в воде
Получение
Кремниевая кислота Н2SiO3
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Слайд 14Химические свойства
Поскольку кремниевая кислота нерастворима в воде, то не реагирует ни
В щелочах осадок растворяется благодаря действию гидроксид-анионов:
Кремниевая кислота Н2SiO3
При нагревании кремниевая кислота разлагается на оксид кремния (IV) и воду.
Слайд 15Соли кремниевой кислоты
ПОЛУЧЕНИЕ
Силикаты можно получить сплавлением оксида кремния (IV) с
Силикаты натрия и калия называют растворимым стеклом.
Их водные растворы - это хорошо известный силикатный клей.
ХИМИЧЕСКИЕ СВОЙСТВА
1) с кислотами
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
2) с солями
Na2SiO3 + CaCl2 = 2NaCl + CaSiO3↓
Качественная реакция на силикат-ионы:
SiO32- + H+ = H2SiO3↓