- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кремний
Содержание
- 1. Презентация по химии на тему Кремний
- 2. Строение атома кремния Е Е Si +14
- 3. Общая характеристика кремния по положению в периодической
- 4. До завершения внешнего уровня кремнию не хватает
- 5. Слайд 5
- 6. Кремний в природеВ свободном виде не встречается.
- 7. Один из типов природных соединений кремния –
- 8. Значение для живых организмовВажнейшее соединение кремния –
- 9. История открытия кремнияКремний был открыт в 1811
- 10. Получение кремнияВ лабораториях кремний получают, восстанавливая оксид
- 11. Кремний – простое
- 12. Физические свойстваПри кристаллизации из газовой фазы на
- 13. Оксид кремния (IV)Оксид кремния IV – кислотный
- 14. В соединениях кремний проявляет степени окисления
- 15. Взаимодействие с металламиКремний растворим в расплавах
- 16. Кремний взаимодействует с неметаллами, которые более электроотрицательны,
- 17. Со щелочами взаимодействует при малых количествах ионов
- 18. СИЛИЦИДЫТвёрдые вещества неустойчивые по отношению к водеи
- 19. Силикаты – соли кремниевой кислотыСиликаты можно получить
- 20. Кремниевая кислотаДействием на силикаты сильными кислотами(HNO3 ,
- 21. ПРИМЕНЕНИЕКремний применяют для полупроводниковых материалов, а также
- 22. При сплавлении кварцевого песка с углём
- 23. Силикатная промышленностьСиликатная промышленность – отрасль промышленности, занимающаяся
- 24. Фарфор – керамический материал, состоящий из каолина,
- 25. Керамика
Слайд 2Строение атома кремния
Е
Е
Si
+14
2e 8e
1s 2s 2p 3s 3p
2
2
2
2
6
Возбуждённое состояние
3s
3p
3d
3s
3p
3d
Слайд 3Общая характеристика кремния по положению в периодической системе
Порядковый номер – 14,
Номер периода III – 14 электронов движутся по трём энергетическим уровням.
Номер группы IV – на внешнем энергетическом уровне находятся 4 электрона.
Радиус атома больше чем у углерода – увеличивается способность к отдаче электронов.
Увеличиваются металлические и восстановительные свойства (в сравнении с углеродом).
C
Si Ge Sn Pb
Слайд 4До завершения внешнего уровня кремнию не хватает 4 электронов.
В соединениях
4Na + Si = Na4Si
Si0 + 4e- = Si-4 пр.Red ; Ox
Na0 - 1e- = Na+1 пр.Ox ; Red
Si + O2 = SiO2
Si0 – 4e- = Si+4 пр.Ox ; Red
2O0 + 2e- = 2O-2 пр.Red ; Ox
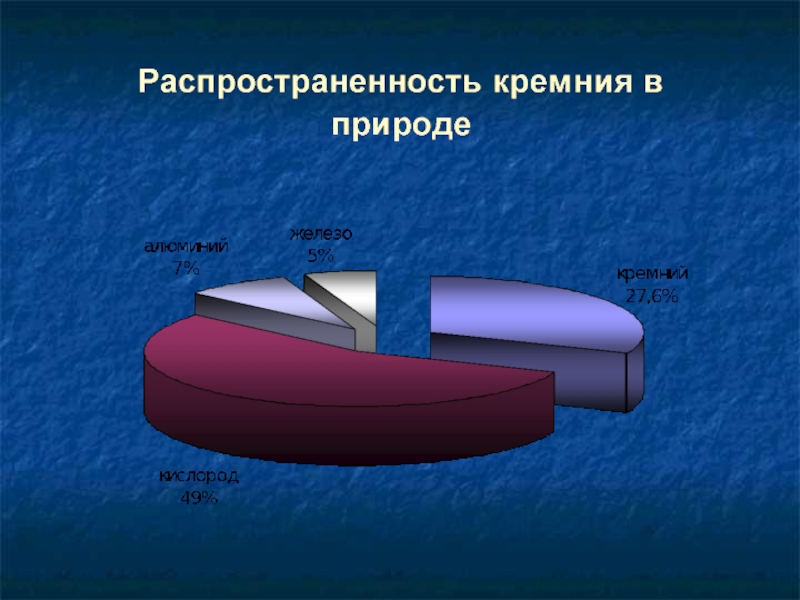
Слайд 6Кремний в природе
В свободном виде не встречается. Встречается,
преимущественно,
В виде SiO2 входит в состав растительных и животных организмов.
В природе образует минерал кварц, который
имеет разновидности, такие, как горный
хрусталь, агат, опал, яшма, халцедон, сердолик.
Слайд 7Один из типов природных соединений кремния – силикаты.
Среди них наиболее распространены
алюмосиликатам относятся гранит, глина, слюда.
К силикатам, не содержащим алюминий, относится асбест.
Слайд 8Значение для живых организмов
Важнейшее соединение кремния – оксид SiO2 необходим для
Он придаёт прочность стеблям растений и защитным покровам животных.
Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
У человека кремний придаёт гладкость и прочность костям
Слайд 9История открытия кремния
Кремний был открыт в 1811 году Гей – Люссаком
В 1825 году был получен чистый кремний шведским химиком Берцелиусом.
Слайд 10Получение кремния
В лабораториях кремний получают, восстанавливая оксид кремния SiO2 магнием.
SiO2 +
Si+4 + 4e- = Si0 пр. Red ; Ox
Mg0 - 2e- = Mg+2 пр. Ox ; Red
В промышленности получают в электрических печах, коксом восстанавливая SiO2 или разложением силана.
SiO2 + 2C = 2CO + Si (1900 0)
Si+4 + 4e- = Si0 пр. Red ; Ox
C0 - 2e- = C-2 пр. Ox ; Red
SiH4 = Si + 2H2 (400 0)
Si-4 - 4e- = Si0 пр. Ox ; Red
2H+1 + 1e- = 2H0 пр. Red ; Ox
Слайд 11 Кремний – простое вещество
В реакциях
В этом случае он взаимодействует с металлами и водородом.
В реакциях выступает в роли восстановителя:
В этом случае он будет взаимодействовать с более электроотрицательными веществами (O2 , Cl2 Br2 )
Кристаллическое вещество тёмно-серого цвета, полупроводник.
За счёт кристаллической решётки, он очень твёрдый.
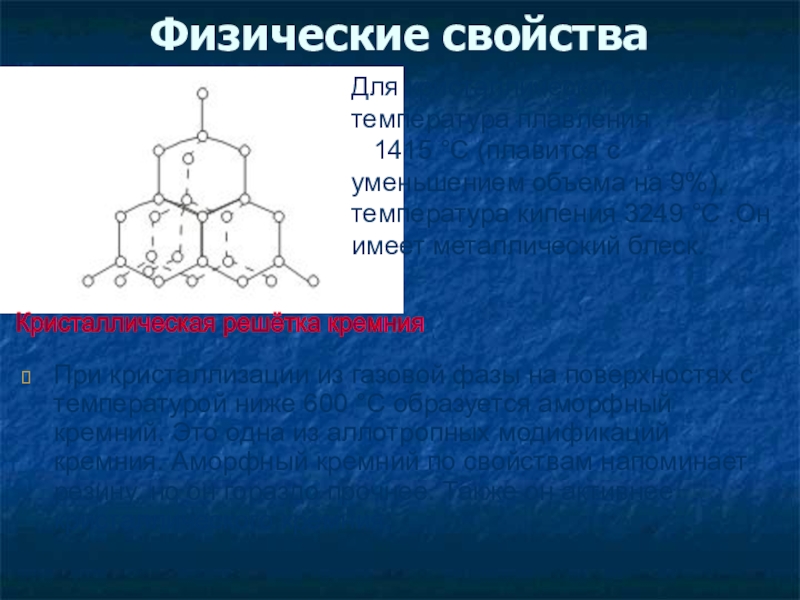
Слайд 12Физические свойства
При кристаллизации из газовой фазы на поверхностях с температурой ниже
Кристаллическая решётка кремния
Для кристаллического кремния температура плавления
1415 °С (плавится с уменьшением объема на 9%), температура кипения 3249 °С .Он имеет металлический блеск.
Слайд 13Оксид кремния (IV)
Оксид кремния IV – кислотный оксид, отличается от других
Обладает всеми свойствами кислотных оксидов: взаимодействует с основными оксидами и основаниями.
Отличается высокой температурой плавления и довольно низкой химической активностью. активностью.
Кристаллическая решетка
Оксида кремния (IV)
Слайд 14
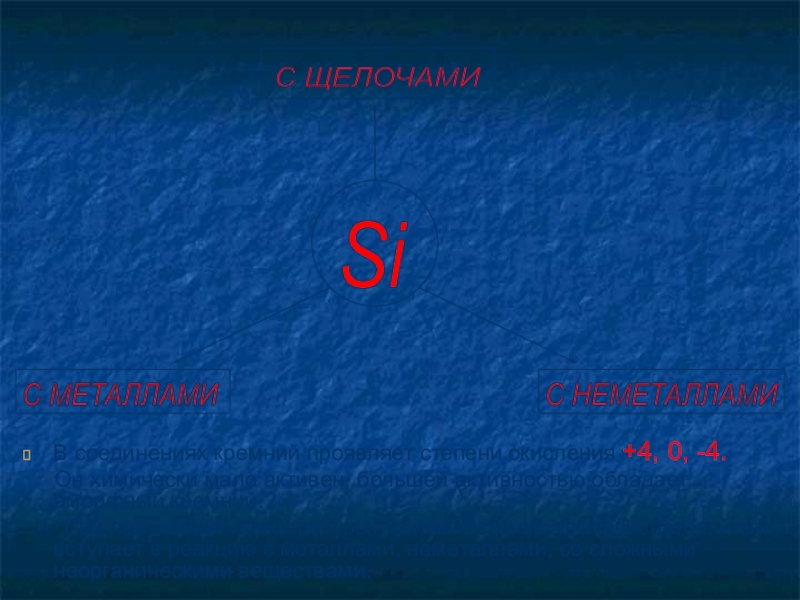
В соединениях кремний проявляет степени окисления +4, 0, -4.
При повышении температуры активность его увеличивается, и он вступает в реакцию с металлами, неметаллами, со сложными неорганическими веществами.
Si
С ЩЕЛОЧАМИ
С НЕМЕТАЛЛАМИ
С МЕТАЛЛАМИ
Слайд 15 Взаимодействие с металлами
Кремний растворим в расплавах металлов, причём с некоторыми
не реагирует, а с другими (Na, K, Ca и т.д.) – образует силициды
4Na + Si = Na4 Si – сплавление
Na0 - 1e- = Na+1 пр. Ox ; Red
Si0 + 4e- = Si-4 пр. Red ; Ox
Слайд 16Кремний взаимодействует с неметаллами, которые более электроотрицательны, и с галогенами.
Si0 – 4e- = Si+4 пр. Ox ; Red
2O0 + 2e- = 2O-2 пр. Red ; Ox
Si + 2Cl2 = SiCl4
Si0 – 4e- = Si+4 пр. Ox ; Red
2Cl0 + 1e- = 2Cl-1 пр. Red ; Ox
Взаимодействие с неметаллами
Слайд 17Со щелочами взаимодействует при малых количествах ионов ОН –
(Возможен гидролиз
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Si0 – 4e- = Si+4 пр. Ox ; Red
2H+1 + 1e- = 2H0 пр. Red ; Ox
Взаимодействие со щелочами
Слайд 18СИЛИЦИДЫ
Твёрдые вещества неустойчивые по отношению к воде
и растворам кислот, под действием
гидролизуют с выделением силана.
Mg2Si + 4H2O = Mg(OH)2↓ + SiH4↑
Mg2Si+ 4HCl = 2MgCl2 + SiH4
Mg2Si + 4H+ = 2Mg2+ + SiH4
Слайд 19Силикаты – соли кремниевой кислоты
Силикаты можно получить сплавлением диоксида кремния с
Силикаты натрия и калия называют растворимым стеклом.
Их водные растворы – хорошо известный силикатный клей.
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
Слайд 20Кремниевая кислота
Действием на силикаты сильными кислотами(HNO3 , H2SO4) получают кремниевую кислоту
При высыхании его образуется силикагель,
широко применяемый в качестве адсорбента – поглотителя других веществ.
Силикагель
Слайд 21ПРИМЕНЕНИЕ
Кремний применяют для полупроводниковых материалов, а также для кислотоупорных сплавов.
Из
Из каолина и нефелина получают алюминий. Из глины делают цветочные горшки и посуду.
Из песка делают стекло. Не менее важным продуктом является цемент.
Кремний используется в солнечных батареях.
Слайд 22При сплавлении кварцевого песка с углём
при высоких температурах образуется
Слайд 23Силикатная промышленность
Силикатная промышленность – отрасль промышленности, занимающаяся переработкой природных соединений кремния.
Область
оконное, ламповое, зеркальное и другие виды стекла.
Другим важным материалом, на основе соединений кремния,
является цемент. Его получают спеканием известняка и глины
в специальных печах.
Всем этим занимается силикатная промышленность, а ещё
производством кирпича, фарфора, фаянса.
Слайд 24Фарфор – керамический материал, состоящий из каолина, обычной глины, кварца и
Фаянс – керамический материал, отличный от фарфора тем, что содержит 85% глины, обладает высокой пористостью и водопоглощением.
Стекло – твёрдый силикатный материал, основными свойствами которого являются прозрачность и химическая стойкость. Стекло получают варкой шихты (смесь из песка, соды и известняка) в специальных печах.
Цемент – вяжущие вещества, употребляемые в строительстве для скрепления между собой твёрдых предметов. Цементы различают на воздушные и гидравлические. В технике цементом называют только гидравлические.
Слайд 25Керамика Стекло
строительная листовое быстротвердеющий
бытовая стеклоизделия расширяющийся
тонкая строительно- морозостойкий
техническая технические жаропрочный
изделия
Продукция силикатной промышленности