- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ковалентті байланыс
Содержание
- 1. Презентация по химии на тему Ковалентті байланыс
- 2. Иондық байланыс металл + бейметаллNa + 11 )2)8)1Cl + 17 )2)8)78+– Электростатикалық тартылыс Na+Cl-иондар
- 3. Иондық байланыстың қасиеттері Бағытталмаған, себебіэлектромагниттік өріс барлық бағытта тарайды қанықпаған, қаншасы сыйса, сонша ион тартылады
- 4. Сондықтан иондық байланысы бар заттардың барлығының молекулалық құрылысы болмайды.Кристалдық торы
- 5. бейметалл + бейметаллCl + 17 )2)8)7Коваленттік байланыс
- 6. N NКоваленттік байланыс бірнеше электрондардың жұптасуы арқылы
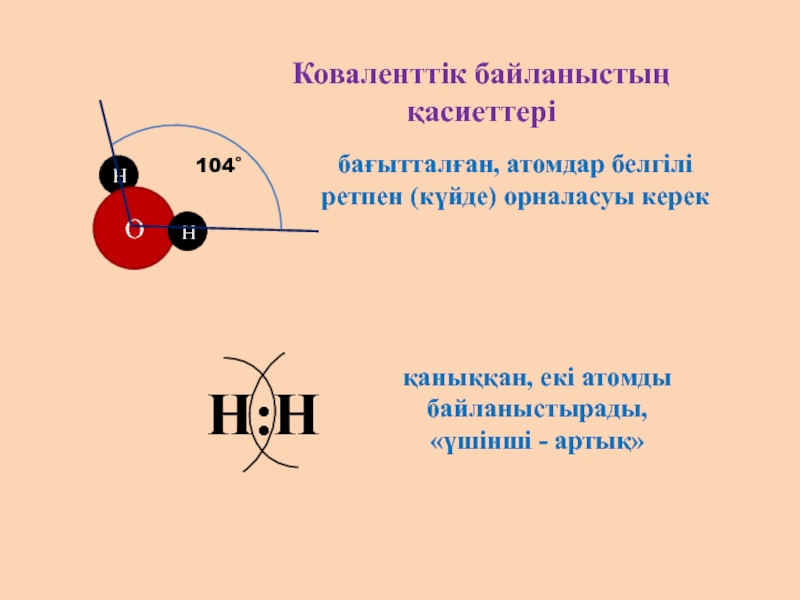
- 7. Коваленттік байланыстың қасиеттерібағытталған, атомдар белгілі ретпен (күйде) орналасуы керекқаныққан, екі атомды байланыстырады, «үшінші - артық»
- 8. Ковалентті байланысты бейнелеп көрсетудің әдістері электрондық схемасы (сызба)құрылымдық формулаларыОрбитальдар-дың қаптасуы (бүркесуі)электронды-графиктік схемалары (сызба)Н2НFF2Н-FН-HF-Fs-ss-pp-pH
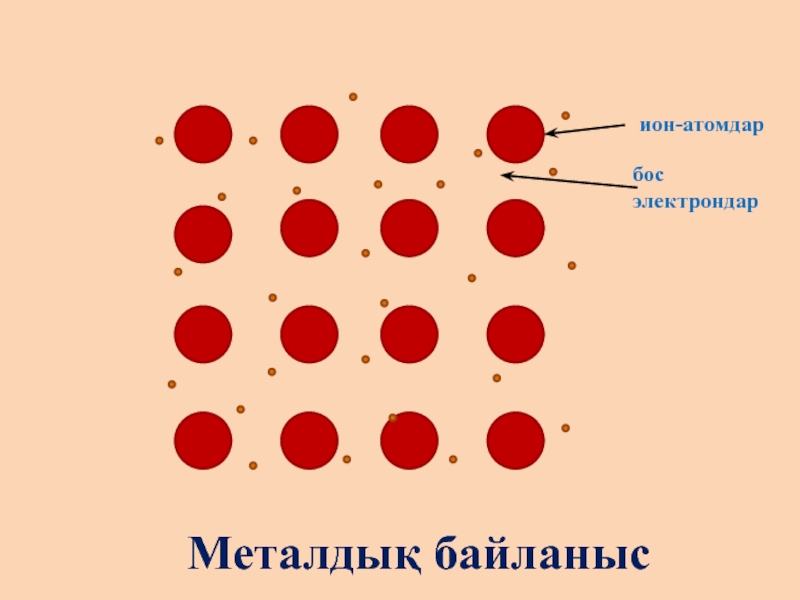
- 9. ++++++++++++++++ион-атомдарбос электрондарМеталдық байланыс
- 10. Заттардағы байланыс түрін қалай анықтауға болады? Химиялық
- 11. Берілген заттардағы химиялық байланыс түрін анықтаңдар:Н2, Na,
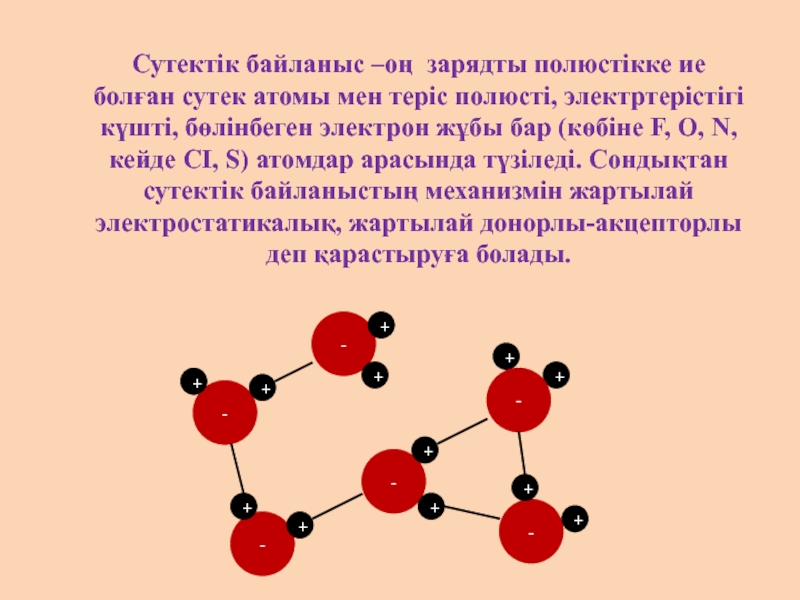
- 12. Сутектік байланыс –оң зарядты полюстікке ие болған сутек
Слайд 1Химиялық байланыс
Дайындаған: «Мұрагер» дарынды балалар мектебінің химия пәні мұғалімі Аплатинова
Слайд 2Иондық байланыс
металл + бейметалл
Na + 11 )2)8)
1
Cl + 17 )2)8)
7
8
+
–
Электростатикалық тартылыс
Na+
Cl-
иондар
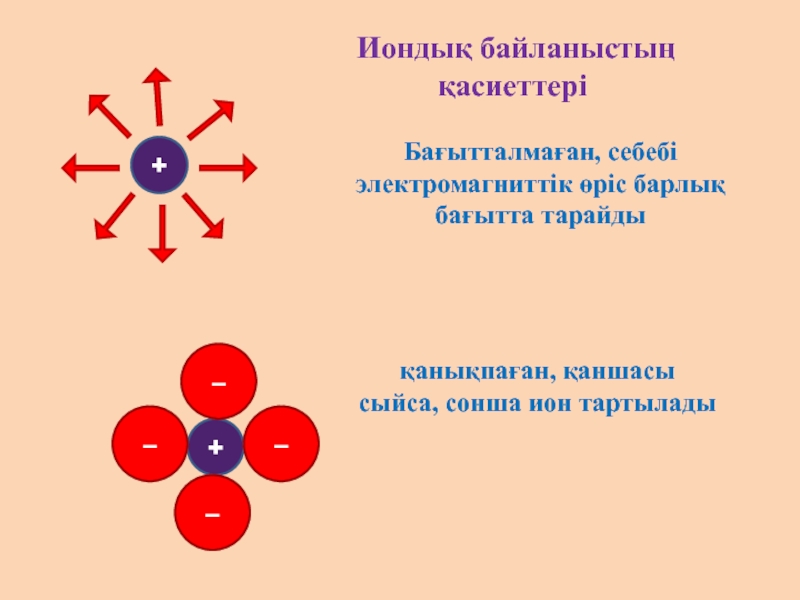
Слайд 3 Иондық байланыстың қасиеттері
Бағытталмаған, себебі
электромагниттік өріс барлық бағытта тарайды
қанықпаған,
Слайд 4Сондықтан иондық байланысы бар заттардың барлығының молекулалық құрылысы болмайды.
Кристалдық торы
Слайд 5
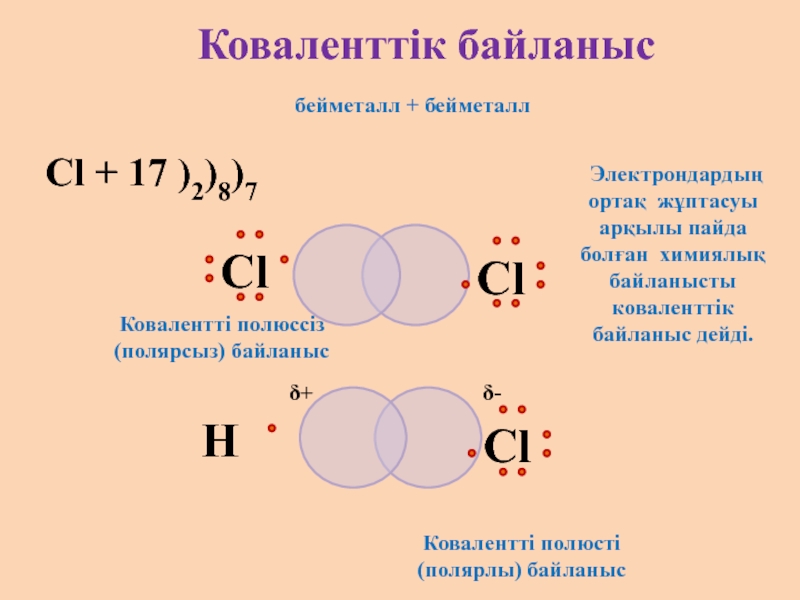
бейметалл + бейметалл
Cl + 17 )2)8)7
Коваленттік байланыс
Электрондардың ортақ жұптасуы арқылы
δ+
δ-
Ковалентті полюсті (полярлы) байланыс
Ковалентті полюссіз (полярсыз) байланыс
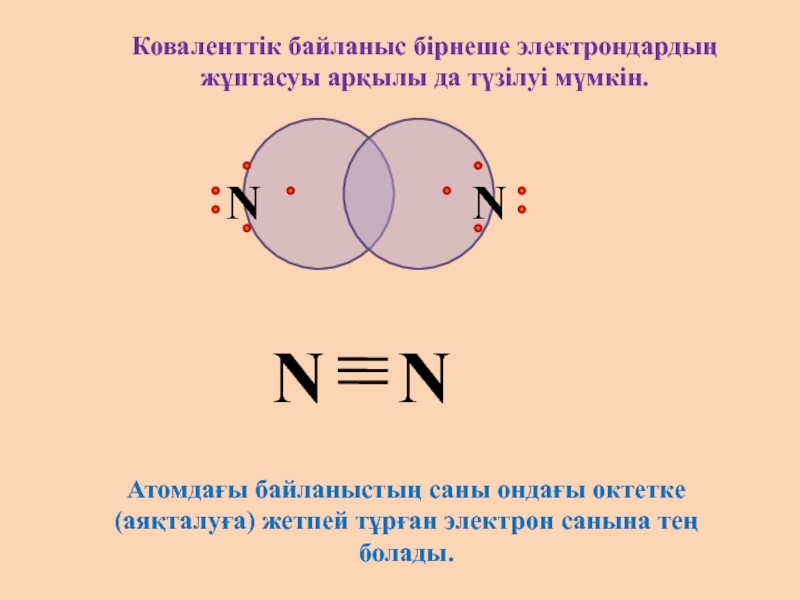
Слайд 6
N
N
Коваленттік байланыс бірнеше электрондардың жұптасуы арқылы да түзілуі мүмкін.
Атомдағы
Слайд 7Коваленттік байланыстың қасиеттері
бағытталған, атомдар белгілі ретпен (күйде) орналасуы керек
қаныққан, екі атомды
«үшінші - артық»
Слайд 8Ковалентті байланысты бейнелеп көрсетудің әдістері
электрондық схемасы (сызба)
құрылымдық формулалары
Орбитальдар-
дың қаптасуы (бүркесуі)
электронды-графиктік
Н2
НF
F2
Н-F
Н-H
F-F
s-s
s-p
p-p
H
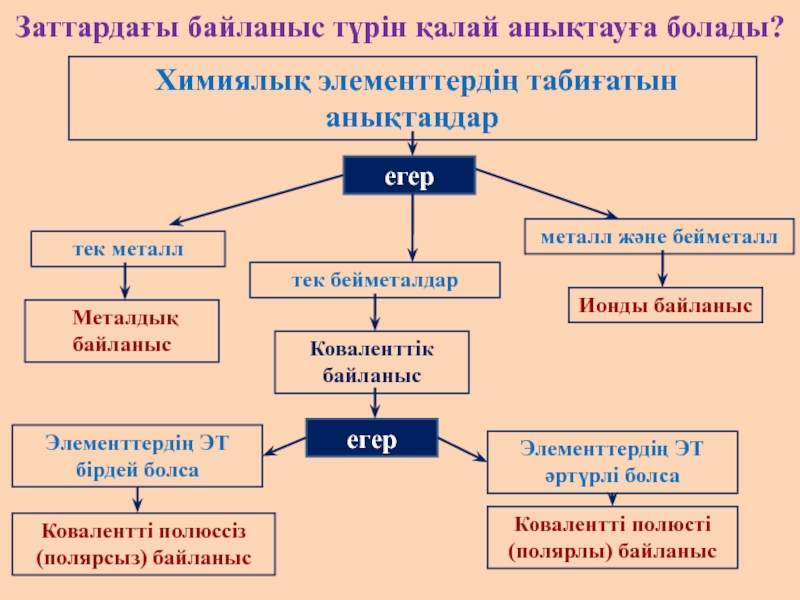
Слайд 10Заттардағы байланыс түрін қалай анықтауға болады?
Химиялық элементтердің табиғатын анықтаңдар
егер
тек металл
тек
металл және бейметалл
егер
Металдық байланыс
Коваленттік байланыс
Ионды байланыс
Ковалентті полюсті
(полярлы) байланыс
Ковалентті полюссіз (полярсыз) байланыс
Элементтердің ЭТ бірдей болса
Элементтердің ЭТ әртүрлі болса