- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ковалентная химическая связь
Содержание
- 1. Презентация по химии на тему Ковалентная химическая связь
- 2. Число непарных электронов внешнего энергетического уровня8 - № группы
- 3. СПОСОБНОСТЬ АТОМА, ПРИНИМАЮЩЕГО УЧАСТИЕ В КОВАЛЕНТНОЙ СВЯЗИ, ПРИТЯГИВАТЬ К СЕБЕ ОБЩУЮ ЭЛЕКТРОННУЮ ПАРУ, НАЗЫВАЕТСЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО,Ҳ)
- 4. Полярность ковалентной связиНЕПОЛЯРНАЯА : АЭлектронная плотность расположена
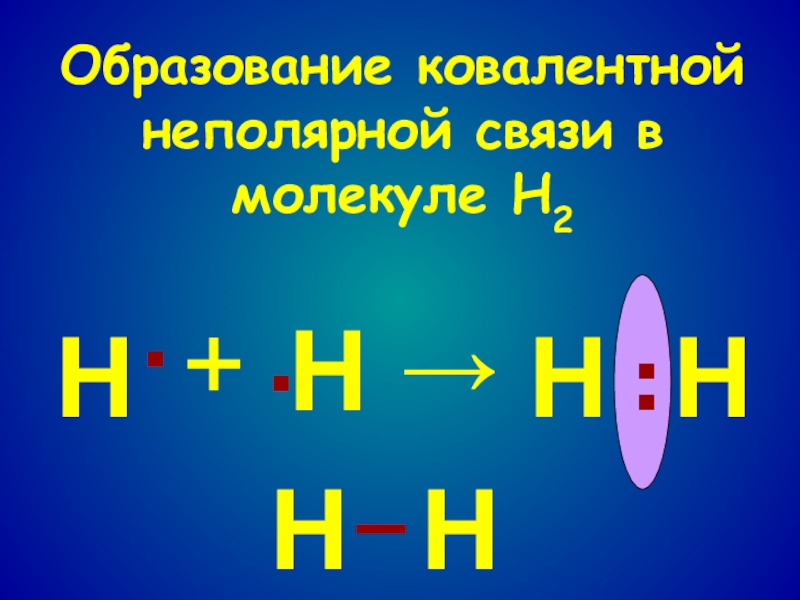
- 5. Образование ковалентной неполярной связи в молекуле Н2НННН····+→НН–
- 6. Образование ковалентной неполярной связи в молекуле Cl2ClClClCl····························+→ClCl–
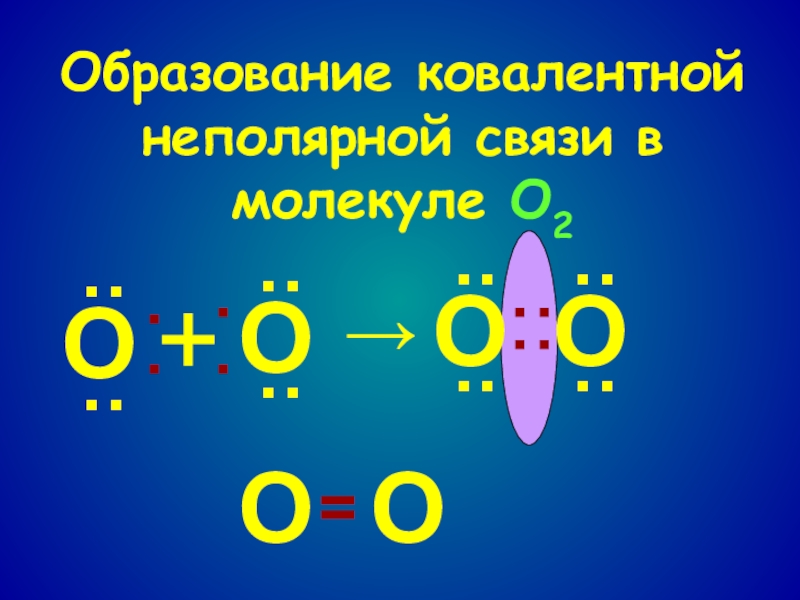
- 7. Образование ковалентной неполярной связи в молекуле O2О················ООО········→+ОО=
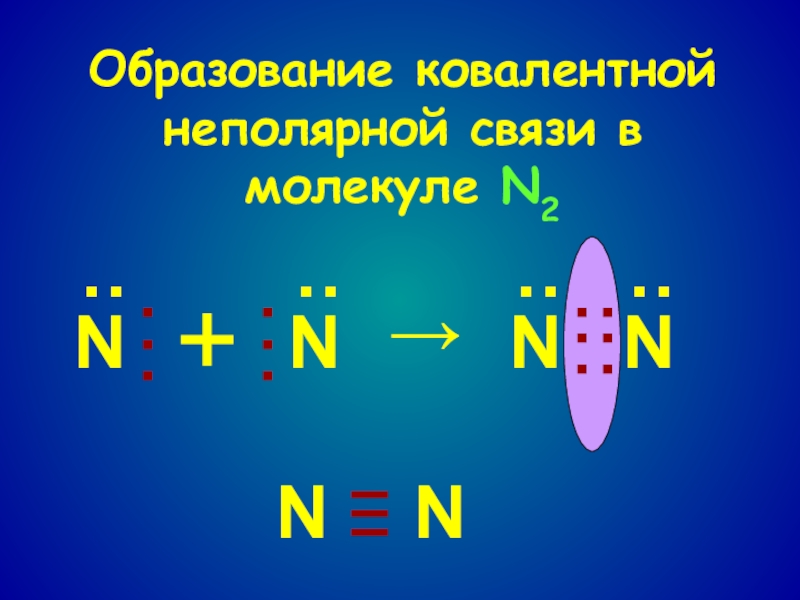
- 8. Образование ковалентной неполярной связи в молекуле N2NNNN····················+→NN–––
- 9. ПОЛЯРНАЯА :ВА→ВАδ+ Вδ-Д И П О
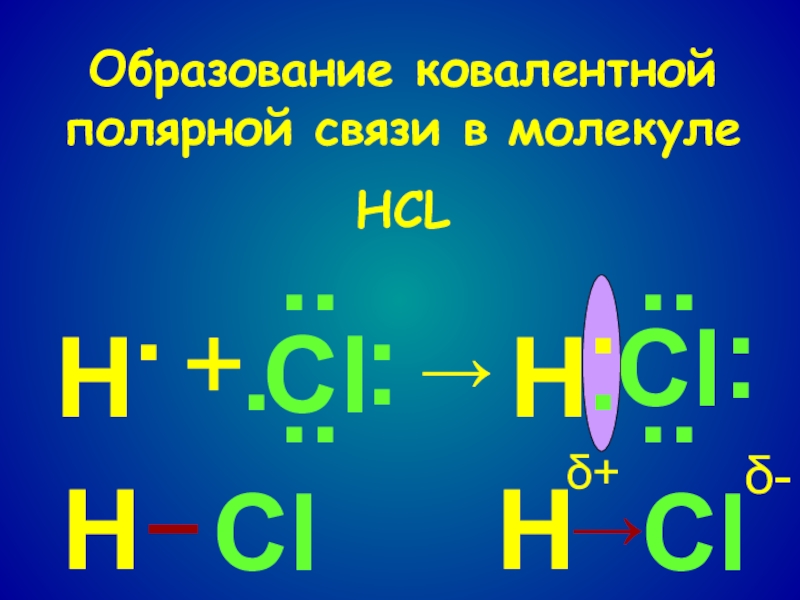
- 10. Образование ковалентной полярной связи в молекулеHCLНCl········+→НCl······НClClН→–δ+δ-··
Число непарных электронов внешнего энергетического уровня8 - № группы
Слайд 1
Ковалентная связь
Механизм образования ковалентной связи
А
·
+
А
·
→
А
А
· ·
· ·
Образование общей электронной пары
Слайд 3СПОСОБНОСТЬ АТОМА, ПРИНИМАЮЩЕГО УЧАСТИЕ В КОВАЛЕНТНОЙ СВЯЗИ, ПРИТЯГИВАТЬ К СЕБЕ ОБЩУЮ
ЭЛЕКТРОННУЮ ПАРУ, НАЗЫВАЕТСЯ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО,Ҳ)
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО,Ҳ)
Слайд 4Полярность ковалентной связи
НЕПОЛЯРНАЯ
А : А
Электронная плотность расположена симметрично относительно ядер связанных
атомов ( чаще, когда связаны одинаковые атомы –неметаллы).
Слайд 6
Образование ковалентной неполярной связи в молекуле Cl2
Cl
Cl
Cl
Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
+
→
Cl
Cl
–
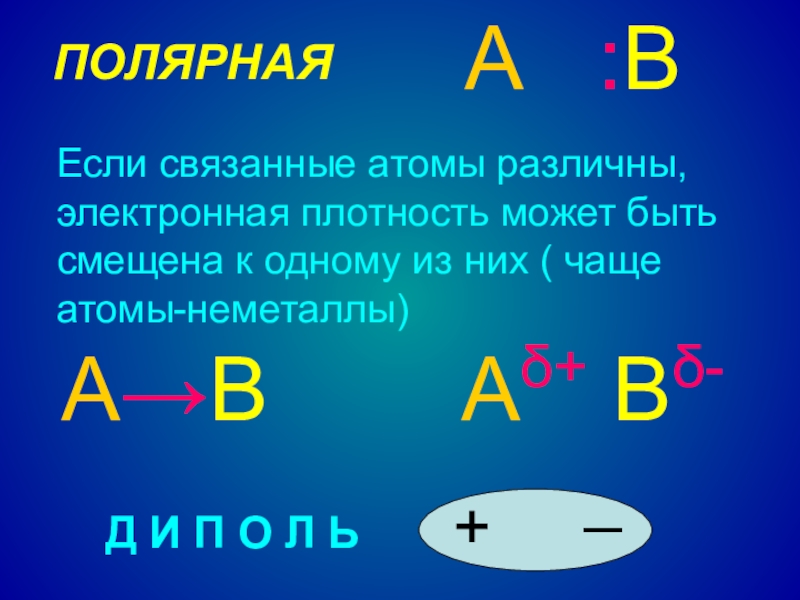
Слайд 9ПОЛЯРНАЯ
А :В
А→В
Аδ+ Вδ-
Д И П О Л Ь
+
_
Если связанные атомы
различны, электронная плотность может быть смещена к одному из них ( чаще атомы-неметаллы)