- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия металлов 11 класс
Содержание
- 1. Презентация по химии на тему Коррозия металлов 11 класс
- 2. «Ржа ест железо» - гласит русская народная пословица. «Коррозия – рыжая крыса, грызёт металлический лом.»
- 3. 1. Коррозия – это процесс самопроизвольного разрушения
- 4. Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в годЕще более значимы косвенные потери
- 5. Делийская железная колонна Эйфелева башня Высота 7,
- 6. Виды коррозии
- 7. Коррозия По виду коррозионной средыПо характеруразрушенияПо процессамГазоваяЖидкостная
- 8. По виду коррозионной среды
- 9. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 10. По характеру разрушений
- 11. Сплошная коррозияРавномерная Неравномерная
- 12. Местная коррозияЯзвенная Точечная Пятнами
- 13. Причины возникновения местной коррозииСоль на дорогахМорская водаМежкристаллитная коррозия
- 14. По процессам
- 15. Химическая коррозияХимическая коррозия – самопроизвольное разрушение металлов
- 16. Электрохимическая коррозияЭлектрохимическая коррозия металлов – самопроизвольный процесс
- 17. Защита металлов от коррозии
- 18. Применение ингибиторовИнгибиторы - это вещества, способные замедлять
- 19. Нанесение защитных покрытийПластмасса Краска ЛакГрунтовкаСмолаЭмаль Масло
- 20. Покрытие антикоррозионным металломХромирование Никелирование Оцинковка
- 21. Позолота Покрытие антикоррозионным металломЛужение Покрытие алюминием
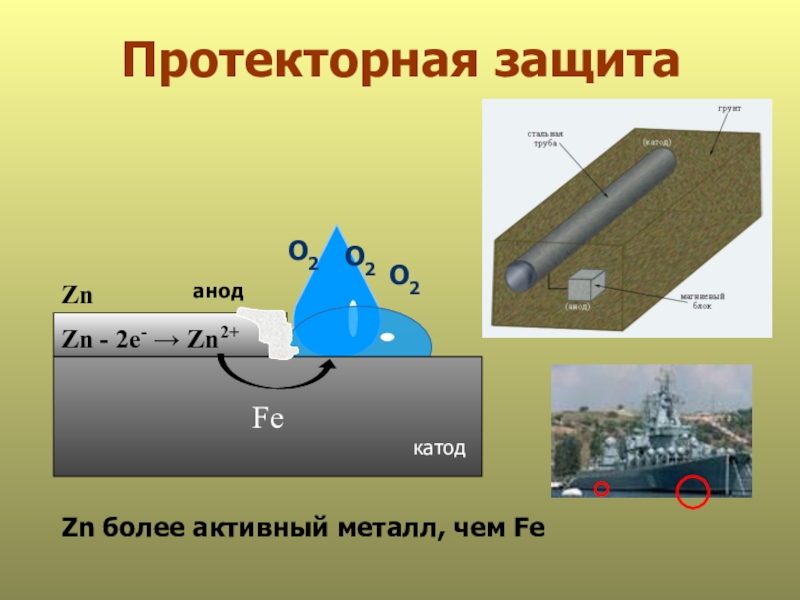
- 22. Протекторная защита анодFeО2О2Zn - 2е- → Zn2+катодZn более активный металл, чем FeZnО2
- 23. Усиление коррозии SnанодкатодFe - 2е- → Fe2+FeFe более активный металл, чем Sn О2О2О2
- 24. Слайд 24
- 25. Материальный ущербПотери металловПорча изготовленных из металлов изделий
- 26. Затраты на ремонт, замену деталей судов, автомобилей,
- 27. Утечка нефти, газов из разрушенных коррозией трубопроводовЗагрязнение
- 28. 1 стакан: Fe + H2O2 стакан: Fe
- 29. Стакан№1.Железо слабо прокорродировало, в чистой воде коррозия
- 30. Стакан№3.Железный гвоздь в контакте с медной проволокой,
- 31. Задача 1Сантехника попросили поставить водопроводный кран, на
- 32. Задача 2Человек поставил на зуб золотую коронку,
Слайд 2«Ржа ест железо» - гласит русская народная пословица.
«Коррозия – рыжая
Слайд 31. Коррозия – это процесс самопроизвольного разрушения металла под действием окружающей
2. Коррозия– это процесс перехода металла в то природное, естественное состояние, в котором
мы встречаем его в земной коре.
Слайд 4Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 5Делийская
железная колонна
Эйфелева башня
Высота 7, 2 м, вес около
Возраст 1600 лет
Красили 18 раз,
отчего ее масса 9000 т
каждый раз увеличивалась
на 70 т (в сумме - 1260 т)
Слайд 7Коррозия
По виду
коррозионной среды
По характеру
разрушения
По процессам
Газовая
Жидкостная
Атмосферная
Почвенная
Сплошная
Местная
Химическая
Электрохимическая
Межкристаллитная
Блуждающими токами
Слайд 15Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа
повышенных температурах или в жидких не электролитах.
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
Газовая
В жидких
не электролитах
В нефти
В сере
В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
Слайд 16Электрохимическая коррозия
Электрохимическая коррозия металлов – самопроизвольный
процесс разрушения металлов в среде
2Fe + O2 + 2H2O = 2Fe(OH)2
Me – ne = Me +n
Fe - 2е- → Fe2+
О2
О2
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
О2
Слайд 18Применение ингибиторов
Ингибиторы - это вещества,
способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
Слайд 26Затраты на ремонт, замену деталей судов, автомобилей, аппаратуры, приборов, коммуникаций во
Экомический ущерб
Слайд 27Утечка нефти, газов из разрушенных коррозией трубопроводов
Загрязнение окружающей среды
Отрицательное воздействие на
Экологические последствия
Слайд 281 стакан: Fe + H2O
2 стакан: Fe + р-р NaCl
3 стакан:
4 стакан: Fe, Zn + р-р NaCl
5 стакан: Fe + р-р (NaCl + NaOH)
Факторы, влияющие на скорость коррозии
( лабораторные опыты)
Слайд 29Стакан№1.
Железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как
Стакан№2.
Скорость коррозии выше, чем в первом случае, следовательно, NaCl увеличивает скорость коррозии.
Что наблюдали:
Слайд 30Стакан№3.
Железный гвоздь в контакте с медной проволокой, опущенный в раствор NaCl
Стакан№4.
В контакте с цинком железо не корродирует.
Стакан№5.
Железный гвоздь, опущенный в раствор NaCl, к которому добавили NaOH, не корродирует.
Слайд 31Задача 1
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии
Слайд 32Задача 2
Человек поставил на зуб золотую коронку, по истечении
некоторого времени
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?