4.пирит
А2. Восстановителем железа из железной руды является
1.угарный газ 2.кокс 3.водород 4. все перечисленные вещества
А3. Чугун получают в специальных печах –
1.домна 2.печь обжига 3.мартеновские печи 4.колонна синтеза
А4. Сырьем для производства стали является:
1.железная руда 2.пирит 3.чугун 4.известняк
А5. Роль флюса при доменном производстве выполняет
1.пирит 2.угарный газ 3.известняк 4.уголь
А6. Примеси в железной руде образуют
1.шлаки 2.флюс 3.чугун 4.кокс
А7. Суть доменного процесса
1.образование олеума 2.восстановление металла из руды
3.окисление железа 4.взаимодействие железа с серой
А8. Чугун плавится при температуре
1.1500 0С 2.800 0С 3.1000 0С 4.1300 0С
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия металлов и сплавов, как фактор загрязнения окружающей среды
Содержание
- 1. Презентация по химии на тему Коррозия металлов и сплавов, как фактор загрязнения окружающей среды
- 2. Коды правильных ответовА1 – 1;А 2 –
- 3. Коррозия металлов и сплавов как результат
- 4. Слайд 4
- 5. Мозговой штурмРебята, как вы считаете, о какой загадке идёт речь?
- 6. Металлы имеют большое значение в нашей жизни.
- 7. Слайд 7
- 8. 31 января 1951г.обрушился железнодорожный мост в Квебеке(Канада),введенный
- 9. 1 группа.Дают определение коррозииВыясняют виды коррозии2 группа.Способы защиты от коррозии
- 10. КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или
- 11. ВИДЫ КОРРОЗИИХИМИЧЕСКАЯ – это разрушение металлов и
- 12. Химическая коррозия
- 13. ВИДЫ КОРРОЗИИЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое
- 14. Электрохимическая коррозияКоррозия происходит в токопроводящей среде (в
- 15. В результате коррозии железо ржавеет. Этот процесс
- 16. Гидроксид железа(III) очень неустойчив, быстро теряет воду
- 17. Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
- 18. Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
- 19. Значительно усиливает коррозию повышение температуры
- 20. Зимой для удаления снега и льда с
- 21. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИНанесение защитных покрытий
- 22. За неделю до этого урока мы с
- 23. Слайд 23
- 24. РЕФЛЕКСИЯЧтобы предотвратить глобальные катастрофы на судах, фабриках
- 25. Кучи вскрытых консервных банок, остающихся после ухода
- 26. Ответ:Можно консервные банки изготавливать из двух
- 27. Слайд 27
- 28. ПОЗНАВАТЕЛЬНАЯ ЗАДАЧА. Близ Дели высится огромная
- 29. Основной причиной стойкости колонны из Дели к
- 30. Слайд 30
- 31. Спасибо за внимание!
- 32. Источники информацииХимия 11 класс: Учеб. для общеобразоват.
- 33. Источники информацииhttp://smolchess.ru/otdelka-i-materialy/osnovnye-sposoby-borby-s-korroziej-metallov.htmlhttp://vasi.net/community/all/2012/08/28/kak_zashhitit_instrument_ot_rzhavchiny.htmlhttp://lori.ru/344835http://lori.ru/64545http://nnm.ru/blogs/Fortunato1991/o_tom_kak_rzhavye_gvozdi_prevratilis_v_biznes_so_100-milliardnym_oborotom/http://chemistry.ru/course/content/chapter7/section/paragraph5/theory.htmlhttp://transtim.narod.ru/zaschita_kuzova_avtomobilya_ot_korrozii_/ustroistvo_elektrohimicheskoi_zaschiti_ot_korrozii_kuzova_avtomobilya_/fotografii_ustanovlenoi_zaschiti_na_avtomobile/
Коды правильных ответовА1 – 1;А 2 – 1; А3 – 1; А4 – 3; А5 – 3; А6 – 1; А7 – 2; А8 – 1.
Слайд 3 Коррозия металлов и сплавов как результат и фактор загрязнения окружающей
среды, меры по предупреждению коррозии.
Урок химии в 9 классе
Слайд 6Металлы имеют большое значение в нашей жизни. Нет той области, где
бы мы их не применяли. Поэтому я хочу вас познакомить с предметом, чаще всего применяемый человеком. Без него не обходится ни один строительный процесс.
Слайд 831 января 1951г.обрушился железнодорожный мост в Квебеке(Канада),введенный в эксплуатацию в 1947г.
В
1964г.рухнуло одно из самых высотных сооружений в мире-400 метровая антенная мечта в Гренландии.
Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
Что же объединяет эти примеры?(разрушение металлических изделий)
Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
Что же объединяет эти примеры?(разрушение металлических изделий)
Слайд 10 КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом
(сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы.
Химический энциклопедический словарь
Слайд 11ВИДЫ КОРРОЗИИ
ХИМИЧЕСКАЯ – это разрушение металлов и сплавов в результате их
химического взаимодействия с веществами окружающей среды.
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Защитная оксидная пленка на поверхности алюминия
Рыхлая пленка на поверхности железа, приводящая к разрушению металла
Слайд 12Химическая коррозия
0 +4 0 t +3 +6 -2
2 Fe+ 3 SO2 + 3 O2 ? Fe2(SO4)3
0 0 t +3 -1
2 Fe + 3 Cl2 ? 2 FeCl3
0 0 t +2 -2
2 Zn + O2 ? 2 ZnO
Коррозия происходит в непроводящей ток среде.
Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т.д.)
2 Fe+ 3 SO2 + 3 O2 ? Fe2(SO4)3
0 0 t +3 -1
2 Fe + 3 Cl2 ? 2 FeCl3
0 0 t +2 -2
2 Zn + O2 ? 2 ZnO
Коррозия происходит в непроводящей ток среде.
Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т.д.)
Слайд 13ВИДЫ КОРРОЗИИ
ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое сопровождается возникновением электрического тока
в воде или среде другого электролита.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Химические процессы – это окисление корродируемого металла, отдача электронов.
Электрические процессы – перенос электронов с одного участка изделия к другому.
Слайд 14Электрохимическая коррозия
Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри
системы электрического тока.
Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
Слайд 15В результате коррозии железо ржавеет. Этот процесс очень сложен и включает
несколько стадий. Его можно описать суммарным уравнением:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3
Слайд 16Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид
железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
Слайд 17
Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
Слайд 20Зимой для удаления снега и льда с тротуаров используют техническую соль.
Образующиеся растворы создают благоприятную среду для электрохимической коррозии подземных коммуникаций и деталей автомобилей.
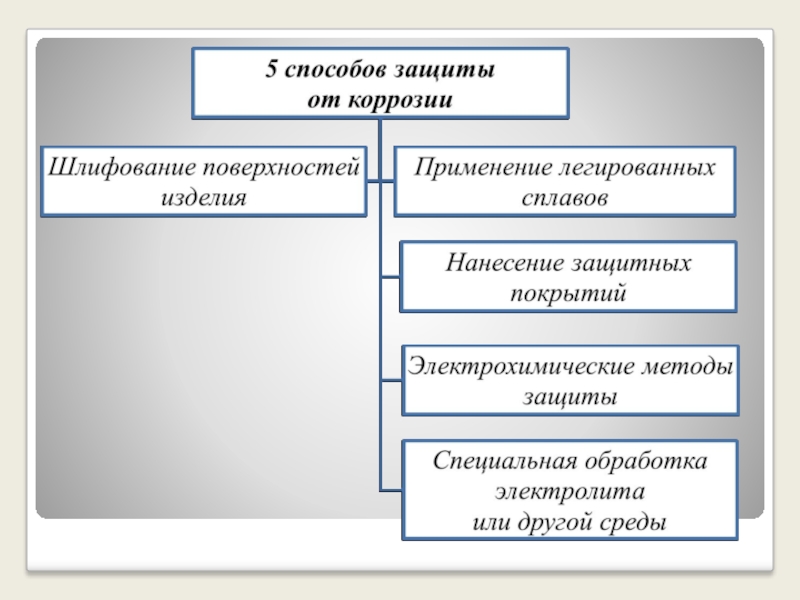
Слайд 21СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Нанесение защитных покрытий (лаки, краски,
эмали);
Покрытие другим металлом (позолота, серебрение, хромирование, цинкование);
Создание и использование антикоррозионных сплавов
Введение в среду ингибиторов, снижающих агрессивность среды;
Протекторная защита
Покрытие другим металлом (позолота, серебрение, хромирование, цинкование);
Создание и использование антикоррозионных сплавов
Введение в среду ингибиторов, снижающих агрессивность среды;
Протекторная защита
Слайд 22
За неделю до этого урока мы с вами ребята сделали опыты,
а сегодня посмотрим результаты. Перед вами четыре пронумерованных стакана. В стакане №1 железо слабо прокорродировало, в чистой воде коррозия идет медленнее, т.к. вода слабый электролит. Это химическая коррозия.
В стакане №2 – тоже химическая коррозия, но скорость выше, т.к. вместо чистой воды мы взяли раствор хлорида натрия. Следовательно, это вещество усиливает коррозию
В стакане №3 железный гвоздь находится в контакте с медной проволокой и опущен в раствор хлорида натрия. Скорость коррозии очень велика, образовалось много ржавчины. Во-первых, NaCI – сильно коррозийная среда для железа. Во-вторых, железо более активный металл, находится в контакте с медью (менее активным металлом). В стакане №4 железный гвоздь опущен в раствор хлорида натрия, к которому добавили раствор гидроксида натрия. Коррозия практически отсутствует. Следовательно, гидроксид натрия замедлил коррозию, а ионы являются замедлителями коррозии, т.е. ингибиторами
В стакане №2 – тоже химическая коррозия, но скорость выше, т.к. вместо чистой воды мы взяли раствор хлорида натрия. Следовательно, это вещество усиливает коррозию
В стакане №3 железный гвоздь находится в контакте с медной проволокой и опущен в раствор хлорида натрия. Скорость коррозии очень велика, образовалось много ржавчины. Во-первых, NaCI – сильно коррозийная среда для железа. Во-вторых, железо более активный металл, находится в контакте с медью (менее активным металлом). В стакане №4 железный гвоздь опущен в раствор хлорида натрия, к которому добавили раствор гидроксида натрия. Коррозия практически отсутствует. Следовательно, гидроксид натрия замедлил коррозию, а ионы являются замедлителями коррозии, т.е. ингибиторами
Слайд 24
РЕФЛЕКСИЯ
Чтобы предотвратить глобальные катастрофы на судах, фабриках и заводах, нужно упорно
изучать методы защиты от этой проблемы. И в то же время необходимо найти применение коррозии металлов. Одним из направлений может быть ее применение для разрушения конструкций в труднодоступных местах. Разрушение металлов и сплавов можно применить как один из способов борьбы с космическим мусором. Если бы железо, подобно серебру и золоту, не ржавело, то мы не существовали бы, и ни одно растение не зеленело бы на Земле. Растворённая в воде его ржавчина составляет часть пищи растенийи придаёт им зеленый цвет. Та же «ржавчина» снабжает железом нашу кровь и придаёт ей красный цвет.
Слайд 25
Кучи вскрытых консервных банок, остающихся после ухода туристов, являются ныне настоящим
экологическим бедствием. Говорят подножье Эвереста буквально усеяно остатками трапез альпинистов. И в наших лесах подчас больше медленно «гниющих» консервных банок, чем грибов. Как бороться с этой напастью? Жесть ржавеет очень медленно, скажем, в горах консервная жестянка разложится только через 50-60лет. И здесь- то вот коррозия могла бы стать уже не бедствием, а сущим благом.
Предложите способ, как её подстегнуть, как ускорить её слабые электрохимические силы?
Предложите способ, как её подстегнуть, как ускорить её слабые электрохимические силы?
Слайд 26
Ответ:
Можно консервные банки изготавливать из двух разных металлов, а пространство
между ними заполнять гигроскопической солью, жадно поглощающей влагу из воздуха. Если банка оказывается на земле, то постепенно в пространство между слоями металлов (например алюминием и железом) проникнет влага, соль растворится, превратиться в электролит, возникнет готовый гальванический элемент. И тогда электрохимическая коррозия «сгрызёт» такую банку за несколько недель. Останется лишь кучка мелкой металлической пыли.
Слайд 28
ПОЗНАВАТЕЛЬНАЯ ЗАДАЧА.
Близ Дели высится огромная железная колонна, ставящая в
тупик современных учёных, которые не могут определить способ её изготовления, предохраняющий железо от окисления и других атмосферных явлений. Колонна стоит уж 15 веков, и , вероятно простоит ещё больше. Как вы считаете, в чём её феномен?
Слайд 29
Основной причиной стойкости колонны из Дели к атмосферной коррозии является явление пассивации металлов —
на её поверхности имеется образовавшаяся естественным путём плёнка оксида, предотвращающая дальнейшее развитие коррозии. Вторичными причинами являются повышенное содержание в металле колонны примеси фосфора и низкая влажность воздуха в Дели. К электрохимической коррозии колонна менее устойчива — часть, вкопанная в землю, подверглась значительной коррозии
Слайд 32Источники информации
Химия 11 класс: Учеб. для общеобразоват. учреждений / О.С.Габриелян, Г.Г.Лысова.
– 4-е изд., стереотип. - М.: Дрофа, 2004.
Картинки для презентации:
http://www.korobov.ru/articles/6227/
http://www.stroim-s-umom.ru/zh/rzhavchina-nash-obshhij-vrag/
http://auto60.ru/ArticleDetail.aspx?id=47
http://www.everest-expo.ru/page31.html
http://volpcar.ru/stati/zashchita-kuzova-ot-korrozii.html
http://dic.academic.ru/dic.nsf/ruwiki/19752
http://900igr.net/fotografii/khimija/Korrozija-metallov/019-Korrozija-metallov.html
http://lozhki-vilki.ru/posuda-iz-nerzhavejushhej-stali/kak-vybrat-posudu-iz-nerzhavejushhej-stali
Картинки для презентации:
http://www.korobov.ru/articles/6227/
http://www.stroim-s-umom.ru/zh/rzhavchina-nash-obshhij-vrag/
http://auto60.ru/ArticleDetail.aspx?id=47
http://www.everest-expo.ru/page31.html
http://volpcar.ru/stati/zashchita-kuzova-ot-korrozii.html
http://dic.academic.ru/dic.nsf/ruwiki/19752
http://900igr.net/fotografii/khimija/Korrozija-metallov/019-Korrozija-metallov.html
http://lozhki-vilki.ru/posuda-iz-nerzhavejushhej-stali/kak-vybrat-posudu-iz-nerzhavejushhej-stali