- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия
Содержание
- 1. Презентация по химии на тему Коррозия
- 2. Яхта «Зов моря»
- 3. Колосс Родосский
- 4. Рухнувший мост в Квебеке
- 5. Антенная мачта
- 6. Коррозия металлов. Способы защиты от коррозии.
- 7. Цель урока:Сформировать представление о коррозии металлов как
- 8. ЗНАТЬ – ЗНАЧИТ ПОБЕДИТЬ!А.Н. Несмеянов
- 9. Коррозия – от лат. corrodere - разъедать
- 10. Слайд 10
- 11. Слайд 11
- 12. Коррозия – это процесс самопроизвольного разрушения материалов и изделий из них под химическим воздействием окружающей среды.
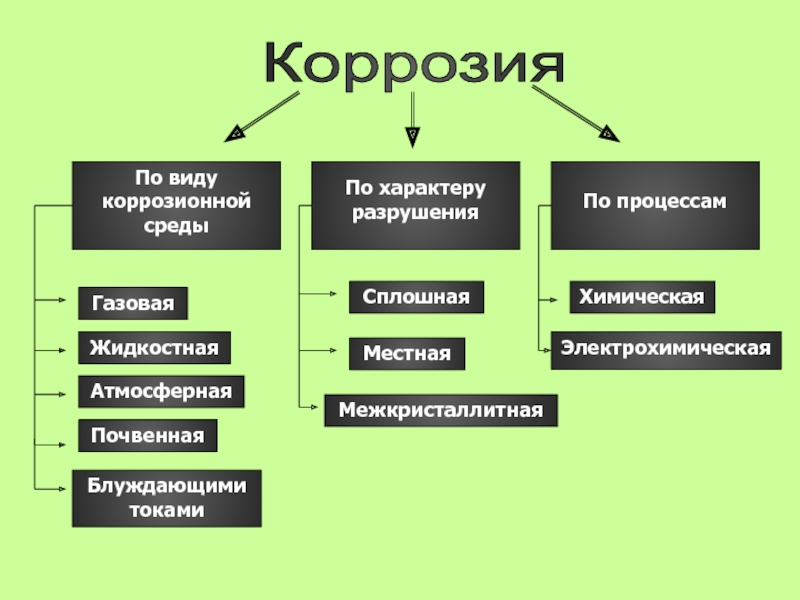
- 13. Виды коррозии
- 14. Коррозия По виду коррозионной средыПо характеруразрушенияПо процессамГазоваяЖидкостная
- 15. По виду коррозионной среды
- 16. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 17. По характеру разрушений
- 18. Сплошная коррозияРавномерная Неравномерная
- 19. Местная коррозияЯзвенная Точечная Пятнами
- 20. По механизму возникновения
- 21. Химическая коррозияХимическая коррозия – самопроизвольное разрушение металлов
- 22. Электрохимическая коррозияЭлектрохимическая коррозия – самопроизвольный процесс разрушения
- 23. Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в годЕще более значимы косвенные потери
- 24. Слайд 24
- 25. 1 стакан: Fe + H2O2 стакан: Fe
- 26. Защита металлов от коррозии«Просто знать – ещё не всё, знания нужно уметь использовать»Гёте
- 27. Нанесение защитных покрытийПластмасса Краска ЛакГрунтовкаСмолаЭмаль Масло
- 28. Покрытие антикоррозионным металломХромирование Никелирование Оцинковка
- 29. Позолота Покрытие антикоррозионным металломЛужение Покрытие алюминием
- 30. Нержавеющие сталиCrCoNiCu
- 31. Применение ингибиторовИнгибиторы - это вещества, способные замедлять
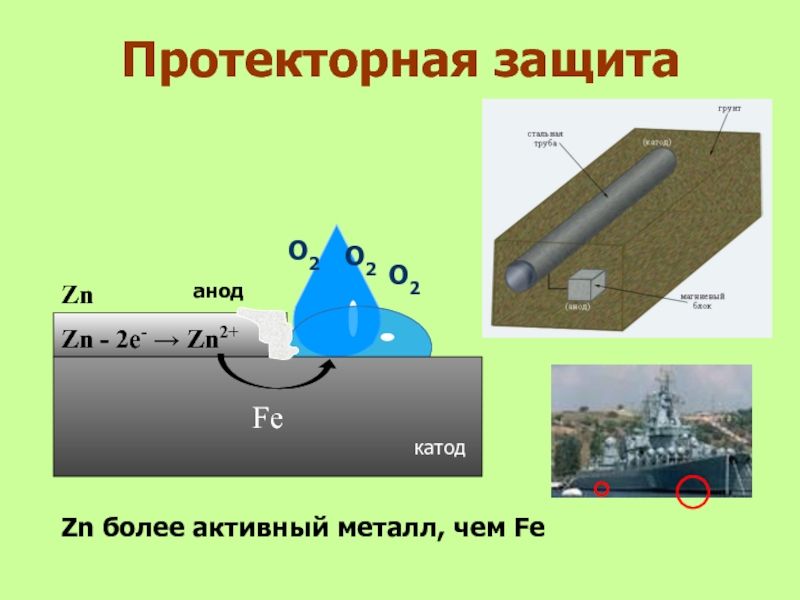
- 32. Протекторная защита анодFeО2О2Zn - 2е- → Zn2+катодZn более активный металл, чем FeZnО2
- 33. Делийская железная колонна Высота 7, 2 м, вес около 6,5 тонн Возраст 1600 лет
- 34. Тренировочный тест1. Слово “коррозия” в переводе с
- 35. 4. Разрушение металла, находящегося в контакте с
- 36. 7. Вещества, замедляющие процесс коррозии называются:
- 37. 10. По характеру разрушений выделяют:
- 38. Ключ к тесту1 – б
- 39. Домашнее задание& 13(с. 46-52 - & 7
Слайд 7Цель урока:
Сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, ее
Слайд 12Коррозия – это процесс самопроизвольного разрушения материалов и изделий из них
Слайд 14Коррозия
По виду
коррозионной среды
По характеру
разрушения
По процессам
Газовая
Жидкостная
Атмосферная
Почвенная
Сплошная
Местная
Химическая
Электрохимическая
Межкристаллитная
Блуждающими токами
Слайд 21Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа
повышенных температурах или в жидких неэлектролитах.
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
Газовая
В жидких
неэлектролитах
В нефти
В сере
В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
Слайд 22Электрохимическая коррозия
Электрохимическая коррозия – самопроизвольный
процесс разрушения металлов в среде электролитов
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Me – ne = Me +n
Fe - 3е- → Fe3+
О2
О2
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
О2
Слайд 23Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 251 стакан: Fe + H2O
2 стакан: Fe + р-р NaCl
3 стакан:
4 стакан: Fe, Zn + р-р NaCl
5 стакан: Fe + р-р (NaCl + NaOH)
Факторы, влияющие на скорость коррозии
( лабораторные исследования)
Слайд 31Применение ингибиторов
Ингибиторы - это вещества,
способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
Слайд 34Тренировочный тест
1. Слово “коррозия” в переводе с латинского означает:
б) разъедать;
в) ржаветь.
2. Требуется скрепить железные детали. Каким металлом целесообразно воспользоваться
а) медью;
б) цинком;
в) свинцом.
3. Окисление металла в среде неэлектролита:
а) электрохимическая коррозия;
б) язвенная коррозия;
в) химическая коррозия.
Слайд 354. Разрушение металла, находящегося в контакте с другим металлом в присутствии
а) газовая коррозия;
б) электрохимическая коррозия;
в) химическая коррозия.
5. Эмалирование это:
а) защитное неметаллическое покрытие металла;
б) электрохимический метод защиты металлов от коррозии;
в) способ придания красоты металлическому изделию.
6. Легирование это:
а) специальное введение в сплав элементов, замедляющих процесс коррозии;
б) покрытие железного листа слоем олова;
в) создание контакта с более активным металлом.
Слайд 367. Вещества, замедляющие процесс коррозии называются:
а) протекторы;
в) ингибиторы.
8. Присоединение к защищаемому металлу другого, более активного металла называется:
а) металлопокрытие;
б) контактная защита;
в) протекторная защита.
9. Процесс ржавления металла можно наблюдать при коррозии:
а) железа;
б) алюминия;
в) цинка.
Слайд 3710. По характеру разрушений выделяют:
а) повсеместную коррозию;
в) разрозненную.
11. Некоторые металлы не подвергаются коррозии, т.к. они покрыты:
а) защитным покрытием;
б) водонепроницаемым покрытием;
в) оксидной плёнкой.
12. Для протекания электрохимической коррозии необходимо наличие:
а) воздуха;
б) раствора электролита;
в) органического растворителя.
Слайд 39Домашнее задание
& 13(с. 46-52 - & 7 выучить), упр. № 1,
Дополнительное задание № 1: Склёпаны 2 металла. Укажите, какой из металлов подвергается коррозии а) Mn – Al; б) Sn – Bi
Дополнительное задание № 2: Образец латуни (медь + цинк) массой 200 грамм с массовой долей меди 60 % обработали избытком соляной кислоты. Определите объём газа, который выделится (н.у.)