«Коррозия – рыжая крыса,
грызет металлический лом» В. Шефнер
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коррозия (10 класс)
Содержание
- 1. Презентация по химии на тему Коррозия (10 класс)
- 2. У металлов есть враг, который
- 3. Проблема защиты металлов от коррозии
- 4. В III до нашей
- 5. В 20 годы ХХ в.
- 6. Что является символом Парижа? –Эйфелева
- 7. Тема: «Коррозия металлов. Способы защиты от коррозии»
- 8. В результате изучения темы ,вы будете способны:1.Рассмотреть
- 9. ЗНАТЬ – ЗНАЧИТ ПОБЕДИТЬ!А.Н. Несмеянов
- 10. Коррозия – разрушение металлов и
- 11. Слайд 11
- 12. Слайд 12
- 13. Коррозия (от лат. Corrodere - разъедать) –
- 14. Причины возникновения коррозии Химические и электрохимические процессы
- 15. Виды коррозии
- 16. ЭлектрохимическаяКоррозияХимическая
- 17. Химическая коррозия Разрушение металлов и сплавов в
- 18. Электрохимическая коррозияРазрушение металлов в среде электролита с
- 19. Сущность коррозии. Коррозия состоит из двух
- 20. Закономерности коррозии: 1. Если
- 21. Закономерности коррозии: 2. Скорость коррозии тем
- 22. Скорость коррозии больше, чем дальше
- 23. По виду коррозионной среды
- 24. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 25. Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в годЕще более значимы косвенные потери
- 26. Слайд 26
- 27. Способы защиты от коррозии
- 28. Одним из наиболее распространенных способов
- 29. Широко распространенным способом защиты металлов
- 30. В повседневной жизни человек чаще
- 31. Эйфелева башня Каждые 7 лет Эйфелеву башню,
- 32. Создание сплавов с антикоррозионными свойствами.
- 33. Памятник Ю. А. Гагарину Памятник Ю. А. Гагарину облицован пластинками из титанового сплава, не подвергающегося коррозии
- 34. Ингибиторы – вещества, замедляющие или предотвращающие коррозию.Ингибиторы
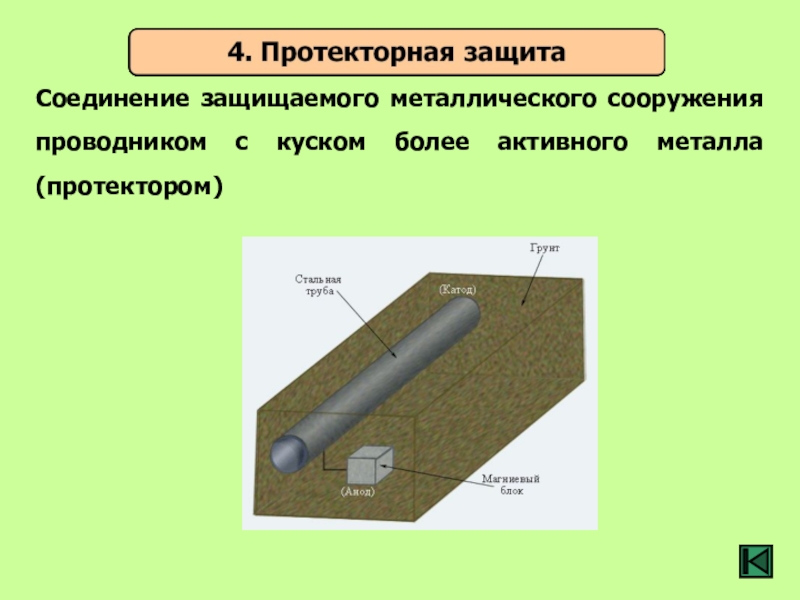
- 35. Соединение защищаемого металлического сооружения проводником с куском более активного металла (протектором)
- 36. Последствия коррозии1. Материальные потери;2. Уменьшение надежности работы
- 37. Тренировочный тест1. Слово “коррозия” в переводе с
- 38. 4. Разрушение металла, находящегося в контакте с
- 39. 7. Вещества, замедляющие процесс коррозии называются:
- 40. 10. Некоторые металлы не подвергаются коррозии, т.к.
- 41. Творческие задачи 1. Скульптуры из бронзы создавались
- 42. 2. Почему поверхность статуи, отлитой из бронзы,
- 43. 4. В III до нашей эры на
- 44. Домашнее задание§ … упр. № …Дополнительное задание
Слайд 2 У металлов есть враг, который приводит к огромным безвозвратным
Слайд 3 Проблема защиты металлов от коррозии возникла почти в самом
Слайд 4 В III до нашей эры на острове Родос
Колосс Родосский считался одним из семи чудес света, однако просуществовал всего 66 лет и рухнул во время землетрясения. У Колосса Родосского бронзовая оболочка была
смонтирована на
железном каркасе.
Под действием влажного,
насыщенного солями
средиземноморского воздуха
железный каркас разрушился.
Слайд 5 В 20 годы ХХ в. по заказу одного миллионера
Слайд 6 Что является символом Парижа? –Эйфелева башня. Она неизлечима больна,
её красили 18 раз, отчего её масса 9000 т каждыйраз увеличивается на 70 т.
Слайд 8В результате изучения темы ,вы будете способны:
1.Рассмотреть понятие – коррозия
2. Ознакомиться
коррозии.
Слайд 10 Коррозия – разрушение металлов и сплавов под воздействием окружающей
Слайд 13Коррозия (от лат. Corrodere - разъедать) – самопроизвольное разрушение металлов и
«Ржа ест железо» - русская народная поговорка
Ржавление – коррозия железа и
его сплавов
Ежегодно в мире разрушается
около ¼ произведенного
железа
Слайд 14Причины возникновения коррозии
Химические и электрохимические процессы окисления, происходящие на поверхности
Слайд 17Химическая коррозия
Разрушение металлов и сплавов в результате их химического взаимодействия
Происходит окисление металла без возникновения в цепи электрического тока
На поверхности металла образуется оксидная пленка
Например: образование железной окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
3Fe + 2O2 → Fe3O4
Слайд 18Электрохимическая коррозия
Разрушение металлов в среде электролита с возникновением внутри системы электрического
Химические процессы: окисление коррозируемого металла, отдача электронов
Электрические процессы: перенос электронов с одного участка к другому
Слайд 19Сущность коррозии.
Коррозия состоит из двух процессов: химического – это
Слайд 20Закономерности коррозии:
1. Если соединены два разных металла, то
Слайд 21Закономерности коррозии:
2. Скорость коррозии тем больше, чем дальше друг
Слайд 22
Скорость коррозии больше, чем дальше друг от друга расположены
более активный металл разрушается, предохраняя менее активный от коррозии
Слайд 25Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 28 Одним из наиболее распространенных способов защиты металлов от коррозии
Слайд 29 Широко распространенным способом защиты металлов от коррозии является покрытие
Слайд 30 В повседневной жизни человек чаще всего встречается с покрытиями
Слайд 31Эйфелева башня
Каждые 7 лет Эйфелеву башню, в целях защиты от коррозии,
Слайд 32 Создание сплавов с антикоррозионными свойствами. Для этого в основной
Слайд 33Памятник Ю. А. Гагарину
Памятник Ю. А. Гагарину облицован пластинками из
Слайд 34Ингибиторы – вещества, замедляющие или предотвращающие коррозию.
Ингибиторы коррозии вводят в замкнутые
Например: для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
!!! Для замедления коррозии вводятся ингибиторы, то есть меняется состав среды
Слайд 35Соединение защищаемого металлического сооружения проводником с куском более активного металла (протектором)
Слайд 36Последствия коррозии
1. Материальные потери;
2. Уменьшение надежности работы оборудования;
3.Простой производства из-за замены
Слайд 37Тренировочный тест
1. Слово “коррозия” в переводе с латинского означает:
б) разъедать;
в) ржаветь.
2. Требуется скрепить железные детали. Каким металлом целесообразно воспользоваться
а) медью;
б) цинком;
в) свинцом.
3. Окисление металла в среде неэлектролита:
а) электрохимическая коррозия;
б) язвенная коррозия;
в) химическая коррозия.
б
в
б
Слайд 384. Разрушение металла, находящегося в контакте с другим металлом в присутствии
а) газовая коррозия;
б) электрохимическая коррозия;
в) химическая коррозия.
5. Эмалирование это:
а) защитное неметаллическое покрытие металла;
б) электрохимический метод защиты металлов от коррозии;
в) способ придания красоты металлическому изделию.
6. Легирование это:
а) специальное введение в сплав элементов, замедляющих процесс коррозии;
б) покрытие железного листа слоем олова;
в) создание контакта с более активным металлом.
б
а
а
Слайд 397. Вещества, замедляющие процесс коррозии называются:
а) протекторы;
в) ингибиторы.
8. Присоединение к защищаемому металлу другого, более активного металла называется:
а) металлопокрытие;
б) контактная защита;
в) протекторная защита.
9. Процесс ржавления металла можно наблюдать при коррозии:
а) железа;
б) алюминия;
в) цинка.
в
в
а
Слайд 40
10. Некоторые металлы не подвергаются коррозии, т.к. они покрыты:
б) водонепроницаемым покрытием;
в) оксидной плёнкой.
11. Для протекания электрохимической коррозии необходимо наличие:
а) воздуха;
б) раствора электролита;
в) органического растворителя.
12. Для протекания химической коррозии необходимо наличие:
а) воздуха;
б) раствора электролита;
в) органического растворителя.
а
б
а
Слайд 41Творческие задачи
1. Скульптуры из бронзы создавались еще в глубокой древности.
Слайд 422. Почему поверхность статуи, отлитой из бронзы, содержащей даже незначительное количество
3. Стоматологи не рекомендуют рядом со стальной коронкой (Fе) ставить золотую (Аu). Объясните их позицию с точки зрения протекающих процессов.
Слайд 434. В III до нашей эры на острове Родос был построен
Слайд 44Домашнее задание
§ …
упр. № …
Дополнительное задание № 1: Склёпаны 2
Дополнительное задание № 2: Образец латуни (медь + цинк) массой 200 грамм с массовой долей меди 60 % обработали избытком соляной кислоты. Определите объём газа, который выделится (н.у.)