- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Концентрация растворов
Содержание
- 1. Презентация по химии на тему Концентрация растворов
- 2. Концентрация — величина, характеризующая количественный состав раствора.
- 3. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не
- 4. На практике часто приходится иметь дело с
- 5. Во-вторых, многие химические реакции проводят в растворах.
- 6. Другой пример: если залить в аккумулятор раствор,
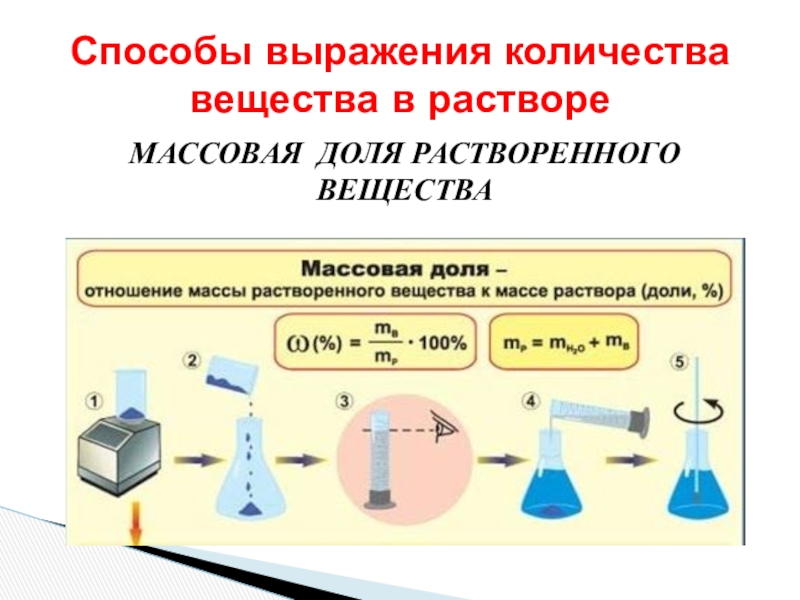
- 7. МАССОВАЯ ДОЛЯ РАСТВОРЕННОГО ВЕЩЕСТВАСпособы выражения количества вещества в растворе
- 8. Пример. Для лечения гипертонической болезни (повышенное давление)
- 9. Как же приготовить 25%-ный раствор? Надо взвесить
- 10. Задачи1) В растворе массой 100 г содержится
- 11. 2) Вычислите массы соли и воды, необходимые
- 12. Сколько граммов сульфата меди необходимо смешать с
- 13. Молярная концентрация веществаМолярная концентрация С – это отношение количества
- 14. Единица молярной концентрации – моль/л. Зная число
- 15. Последовательность приготовления молярного раствора хлорида натрия (1моль/л
- 16. Мерная колба представляет собой сосуд с тонкой
- 17. Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М.
- 18. Задачи:Раствор объемом 500 мл содержит NaOH массой
- 19. 2) Вычислить массу хлорида натрия NaCl, содержащегося
- 20. Каждый способ выражения концентрации раствора удобен в
- 21. Решите задачи:1) В воде массой 120 г
- 22. 4) В 100 мл раствора содержится 0,98
Концентрация — величина, характеризующая количественный состав раствора.
Слайд 1Концентрация растворов. Правила приготовления растворов
Автор: Дъячук Л.В.
ГАПОУ НСО «Барабинский медицинский колледж»
Слайд 3Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества
растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Слайд 4На практике часто приходится иметь дело с растворами, имеющими строго заданное содержание в
них растворенного вещества.
Примеры:
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Примеры:
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Слайд 5Во-вторых, многие химические реакции проводят в растворах. И здесь ошибки могут
приводить к печальным результатам. Например, если фотограф ошибется при растворении проявителя, то фотографии либо не проявятся, либо будут испорчены.
Слайд 6Другой пример: если залить в аккумулятор раствор, в котором содержание серной
кислоты будет меньше или больше требуемого, то аккумулятор либо не будет работать, либо выйдет из строя.
Слайд 8Пример. Для лечения гипертонической болезни (повышенное давление) применяют 25%-ный раствор сульфата
магния MgSO4. Это означает, что в 100 г такого раствора содержится 25 г MgSO4. Здесь выделено слово “раствора”. Действительно, если мы взвесим 25 г сульфата магния и просто растворим в 100 г воды, то нужного нам раствора не получим.
Слайд 9Как же приготовить 25%-ный раствор? Надо взвесить на весах 25 г
безводного сульфата магния и отмерить мензуркой 75 мл воды (либо взвесить на весах 75 г воды, что одно и то же). Затем сульфат магния надо высыпать в воду и перемешать до полного растворения. Получится 100 г раствора (25 г + 75 г = 100 г), в котором массовая доля сульфата магния составляет точно 25 %.
Слайд 10Задачи
1) В растворе массой 100 г содержится хлорид бария массой 20
г. Какова массовая доля хлорида бария в растворе?
Д а н о:
m(р-ра) = 100 г;
m(ВаСl2) = 20 г.
____________________
Найти: w%(ВаСl2)
Решение:
Массовая доля ВаСl2 равна отношению его массы к общей массе раствора:
w(BaCl2)=m(ВаСl2)/m(р-ра)=20г/100г=0,2 или 20%
Ответ: w%(ВаСl2)=0,2 или 20%
Д а н о:
m(р-ра) = 100 г;
m(ВаСl2) = 20 г.
____________________
Найти: w%(ВаСl2)
Решение:
Массовая доля ВаСl2 равна отношению его массы к общей массе раствора:
w(BaCl2)=m(ВаСl2)/m(р-ра)=20г/100г=0,2 или 20%
Ответ: w%(ВаСl2)=0,2 или 20%
Слайд 112) Вычислите массы соли и воды, необходимые для приготовления 300 г.
раствора с массовой долей соли 15 %.
Дано:
m(р-ра) = 300 г.
W (соли) = 15%
Найти: m (соли), m (воды)
Решение:
m (соли) = W (соли)* m(р-ра) / 100% = 300*15/100= 45 г.
m (воды) = 300 – 45 = 255 г. Ответ: m (соли) = 45 г.; m (воды) = 255 г.
Дано:
m(р-ра) = 300 г.
W (соли) = 15%
Найти: m (соли), m (воды)
Решение:
m (соли) = W (соли)* m(р-ра) / 100% = 300*15/100= 45 г.
m (воды) = 300 – 45 = 255 г. Ответ: m (соли) = 45 г.; m (воды) = 255 г.
Слайд 12Сколько граммов сульфата меди необходимо смешать с 450 г. воды, чтобы
получить раствор с массовой долей 10 %?
Дано:
m (воды) = 450 г.
W (соли) = 10 %
Найти: m (соли)
Решение:
m (соли) = W (соли)* m(р-ра) / 100% = 10% * 500 г./ 100% = 50 г.
Ответ: масса сульфата меди равна 50 г.
Дано:
m (воды) = 450 г.
W (соли) = 10 %
Найти: m (соли)
Решение:
m (соли) = W (соли)* m(р-ра) / 100% = 10% * 500 г./ 100% = 50 г.
Ответ: масса сульфата меди равна 50 г.
Слайд 13Молярная концентрация вещества
Молярная концентрация С – это отношение количества растворенного вещества v (в
молях) к объему раствора V в литрах.
Слайд 14Единица молярной концентрации – моль/л. Зная число молей вещества в 1
л раствора, легко отмерить нужное количество молей для реакции с помощью подходящей мерной посуды.
Слайд 15Последовательность приготовления молярного раствора хлорида натрия (1моль/л NaCl): а) берут мерную
колбу емкостью 1 л; б) помещают в колбу навеску кристаллического NaCl. в) в колбу добавляют немного дистиллированной воды, растворяют кристаллы и доливают раствор водой до метки 1 л, после чего тщательно перемешивают.
Слайд 16Мерная колба представляет собой сосуд с тонкой шейкой, на которой по
стеклу нанесена кольцеобразная метка. Если заполнить мерную колбу жидкостью до метки, то ее объем составит ровно 1 л. Возьмем такую колбу и приступим к приготовлению нужного нам раствора NaCl.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5. Следовательно, молярная масса NaCl (масса 1 моль) равна 58,5 г. Взвесим это количество NaCl на весах и поместим кристаллы в мерную колбу. Затем добавим немного воды и растворим кристаллы, покачивая колбу. Когда вся соль растворится, дольем раствор водой до метки. Мерные колбы делают таким образом, что объем раствора достигает точно 1 л, когда водный мениск (уровень воды, слегка изогнутый силами поверхностного натяжения) касается метки своей нижней частью. После этого раствор аккуратно перемешаем.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5. Следовательно, молярная масса NaCl (масса 1 моль) равна 58,5 г. Взвесим это количество NaCl на весах и поместим кристаллы в мерную колбу. Затем добавим немного воды и растворим кристаллы, покачивая колбу. Когда вся соль растворится, дольем раствор водой до метки. Мерные колбы делают таким образом, что объем раствора достигает точно 1 л, когда водный мениск (уровень воды, слегка изогнутый силами поверхностного натяжения) касается метки своей нижней частью. После этого раствор аккуратно перемешаем.
Слайд 17Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М. Например, раствор концентрации 1
М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ. Раствор концентрации 0,1 М содержит 0,1 моль вещества на литр раствора и называется ДЕЦИМОЛЯРНЫМ. Растворы концентрации 0,01 М (или 0,01 моль на литр) иногда называют САНТИМОЛЯРНЫМИ.
Слайд 18Задачи:
Раствор объемом 500 мл содержит NaOH массой 5 г. Определить молярную
концентрацию этого раствора.
Д а н о:
V(р-ра)=500мл, или 0,5 л
m(NaOH )=5г;
____________________
Найти: C(NaOH )
Решение:
1. Вычислим число моль в 5 г NaOH :
ⱱ(NaOH)=m(NaOH)/M(NaOH); ⱱ =5г/40г/моль=0,125 моль
2. Определим молярную концентрацию раствора:
C=ⱱ (NaOH)/V(р-ра);
C=0,125 моль/0,5=0,25моль/л;
Ответ:C=0,25моль/л;
Д а н о:
V(р-ра)=500мл, или 0,5 л
m(NaOH )=5г;
____________________
Найти: C(NaOH )
Решение:
1. Вычислим число моль в 5 г NaOH :
ⱱ(NaOH)=m(NaOH)/M(NaOH); ⱱ =5г/40г/моль=0,125 моль
2. Определим молярную концентрацию раствора:
C=ⱱ (NaOH)/V(р-ра);
C=0,125 моль/0,5=0,25моль/л;
Ответ:C=0,25моль/л;
Слайд 192) Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200
мл, если его молярная концентрация 2 моль/л.
Д а н о
V(р-ра)=200мл, или 0,2 л
C(NaCl )=2 моль/л
Найти: m(NaCl )
Решение:
1. Вычислим число моль m(NaCl ), которое содержится в растворе объёмом 0,2л:
C= ⱱ (NaCl)/V(р-ра); ⱱ(NaCl)=С·V(р-ра);
ⱱ(NaCl)=2моль/л·0,2л=0,4 моль
2. Вычислим массу NaCl:
m(NaCl)=M(NaCl) * ⱱ(NaCl); M(NaCl)=58,5г/моль
m(NaCl)=58,5г/моль·0,4 моль=23,4г NaCl
Ответ:m(NaCl)=23,4г
Д а н о
V(р-ра)=200мл, или 0,2 л
C(NaCl )=2 моль/л
Найти: m(NaCl )
Решение:
1. Вычислим число моль m(NaCl ), которое содержится в растворе объёмом 0,2л:
C= ⱱ (NaCl)/V(р-ра); ⱱ(NaCl)=С·V(р-ра);
ⱱ(NaCl)=2моль/л·0,2л=0,4 моль
2. Вычислим массу NaCl:
m(NaCl)=M(NaCl) * ⱱ(NaCl); M(NaCl)=58,5г/моль
m(NaCl)=58,5г/моль·0,4 моль=23,4г NaCl
Ответ:m(NaCl)=23,4г
Слайд 20Каждый способ выражения концентрации раствора удобен в зависимости от цели, которую
преследует химик или технолог.
Процентные концентрации более удобны в технике, медицине, экологии. Молярные концентрации чаще встречаются в лабораторной практике.
Процентные концентрации более удобны в технике, медицине, экологии. Молярные концентрации чаще встречаются в лабораторной практике.
Слайд 21Решите задачи:
1) В воде массой 120 г растворили 30 г сахара.
Какова массовая доля растворённого вещества в полученном растворе?
2) Какова масса соляной кислоты в растворе массой 200 г с массовой долей 35%?
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора.
2) Какова масса соляной кислоты в растворе массой 200 г с массовой долей 35%?
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора.
Слайд 224) В 100 мл раствора содержится 0,98 г серной кислоты. Определите
молярную концентрацию данного раствора.
5) Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора?
5) Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора?