- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Контроль результатов обучения химии.
Содержание
- 1. Презентация по химии на тему Контроль результатов обучения химии.
- 2. 1. Формы контроля. 2. Виды контроля. 3.
- 3. Благодаря контролю знаний и умений школьников реализуется
- 4. ПО СПОСОБУ ОРГАНИЗАЦИИ В УЧЕБНОМ ПРОЦЕССЕ ФОРМЫ КОНТРОЛЯ ИНДИВИДУАЛЬНАЯ ГРУППОВАЯ ФРОНТАЛЬНАЯ ДИФФЕРЕНЦИРОВАННАЯ
- 5. ПО СПОСОБУ ПОДАЧИ ИНФОРМАЦИИФОРМЫ КОНТРОЛЯ УСТНАЯ ПИСЬМЕННАЯ ЭКСПЕРИМЕНТАЛЬНАЯ КОМПЬЮТЕРНАЯ
- 6. ВИДЫ КОНТРОЛЯ ПРЕДВАРИТЕЛЬНЫЙ ТЕКУЩИЙ ТЕМАТИЧЕСКИЙ ЗАКЛЮЧИТЕЛЬНЫЙ
- 7. ОБЪЕМ ЗНАНИЙ И УМЕНИЙ КАЧЕСТВО
- 8. • полноту ответа • правильность ответа
- 9. ИНДИВИДУАЛЬНЫЙ ОПРОС ЗНАНИЙ ПРОВОДИТСЯ ДЛЯ:ИНДИВИДУАЛЬНЫЙ КОНТРОЛЬ ЗНАНИЙпроверки
- 10. - последующее за ответом рецензирование - исправление
- 11. Тема «Основания» в 8-м классеПРИМЕРЫ КАРТОЧЕК ДЛЯ
- 12. K а р т о ч к
- 13. «Kакая группа атомов химических элементов всегда входит
- 14. «K какому типу химических реакций относится реакция
- 15. ПОДГОТОВИТЕЛЬНЫЙ ЭТАПЗачет – это особая форма организации
- 16. • возрастных особенностей учащихся • степени подготовленности
- 17. Классический зачет предусматривает выявление уровня знаний, умений
- 18. - член комиссии - наблюдатель - советчик
- 19. 1. Предмет изучения органической химии. 2. Предпосылки
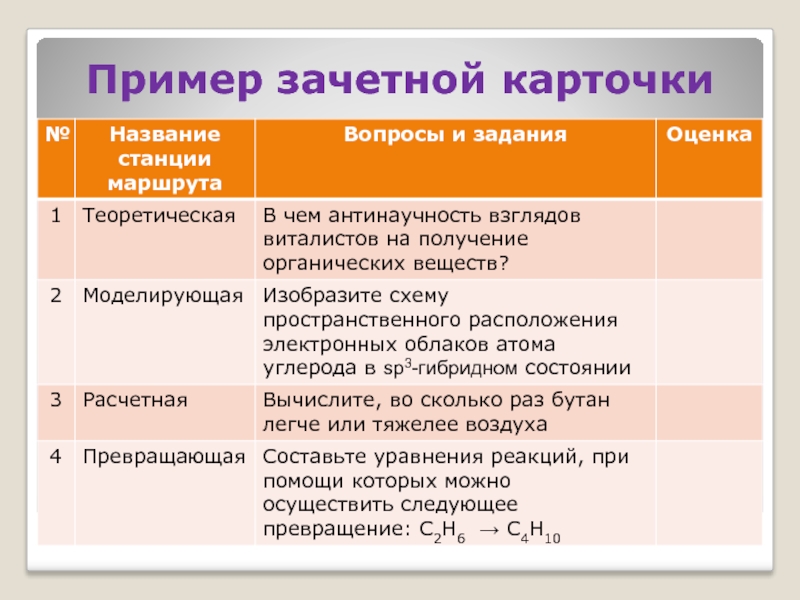
- 20. Пример зачетной карточки
- 21. дает представление об уровне знаний и интеллектуальных
- 22. «1» – полный ответ «0» – отсутствие
- 23. Составьте химическое уравнение взаимодействия оксида меди (I)
- 24. - запись химических формул исходных веществ
- 25. Раздел «Основные классы неорганических соединений» в 8-м
- 26. - запись условия задачи - составление уравнения
- 27. - от 96 до 100% работы ставить
- 28. - кратковременна (10–15 мин) - проводится с
- 29. - вопросы по теме, написанные на
- 30. ТЕСТЫ – это краткие стандарти-зированные задания, по
- 31. - тест выборки - тест
- 32. ТЕСТ ВЫБОРКИСамый распространенный химический элемент в
- 33. ТЕСТ ДОПОЛНЕНИЯ 1. Молекула озона состоит из
- 34. ТЕСТ ГРУППИРОВАНИЯ1. Из предложенного перечня выпишите формулы
- 35. ТЕСТ РАНЖИРОВАНИЯ1. Расположите следующие химические элементы в
- 36. ТЕСТ СЛИЧЕНИЯ1. По названию вещества установите, к какому классу неорганических веществ оно принадлежит.
- 37. 2. Установите соответствие между названием химической реакции и ее сутью.
- 38. 3. Установите соответствие между формулой соединения и видом химической связи в нем.
- 39. 1. Укажите число неспаренных электронов в возбужденном
- 40. 5. Какие химические превращения произойдут при помещении
- 41. АЛЬТЕРНАТИВНЫЕ ТЕСТОВЫЕ ЗАДАНИЯФОРМА ОТВЕТАС ПОМОЩЬЮ СЛОВС ПОМОЩЬЮ ЗНАКОВ«да» или «нет»«правильно» или «неправильно»«+» и «^»
- 42. а) предельный углеводород; б) в молекуле
- 43. 1) относится к неметаллам; 2) второй по
- 44. 1) Относится к оксидам. 2) Бесцветен. 3)
Слайд 21. Формы контроля. 2. Виды контроля. 3. Методы устного контроля результатов обучения.
ПЛАН ЛЕКЦИИ
Слайд 3Благодаря контролю знаний и умений школьников реализуется обратная связь от учеников
Слайд 4ПО СПОСОБУ ОРГАНИЗАЦИИ В УЧЕБНОМ ПРОЦЕССЕ
ФОРМЫ КОНТРОЛЯ
ИНДИВИДУАЛЬНАЯ
ГРУППОВАЯ
ФРОНТАЛЬНАЯ
Слайд 7ОБЪЕМ ЗНАНИЙ И УМЕНИЙ
КАЧЕСТВО ЗНАНИЙ
Необходимо учитывать степень достижения целей
научность
осознанность
систематичность
конкретность
прочность
связь с жизнью
Слайд 8• полноту ответа • правильность ответа • логику изложения материала • понимание изученного •
УЧИТЕЛЬ РЕГИСТРИРУЕТ:
Слайд 9ИНДИВИДУАЛЬНЫЙ ОПРОС ЗНАНИЙ ПРОВОДИТСЯ ДЛЯ:
ИНДИВИДУАЛЬНЫЙ КОНТРОЛЬ ЗНАНИЙ
проверки домашнего задания
подготовки к восприятию
закрепления и совершенствования знаний
проверки усвоения нового материала
Слайд 10- последующее за ответом рецензирование
- исправление допущенных ошибок
- дополнение
Во время
Слайд 11Тема «Основания» в 8-м классе
ПРИМЕРЫ КАРТОЧЕК ДЛЯ УСТНОГО ОПРОСА
K а р
Какие вещества называют основаниями?
2. Составьте формулы гидроксида бария
и гидроксида хрома (III).
3. Kакие химические превращения
происходят с нерастворимыми
основаниями при нагревании?
Составьте химическое уравнение,
характеризующее это свойство оснований.
Слайд 12 K а р т о ч к а 2 1. Kак классифицируют
Слайд 13«Kакая группа атомов химических элементов всегда входит в состав формул оснований?» «Kак
НАВОДЯЩИЕ ВОПРОСЫ
Слайд 14«K какому типу химических реакций относится реакция нейтрализации?» «Kак можно отличить раствор
ДОПОЛНИТЕЛЬНЫЕ ВОПРОСЫ
Слайд 15ПОДГОТОВИТЕЛЬНЫЙ ЭТАП
Зачет – это особая форма организации устной проверки знаний, умений
отбор зачетных тем
определение формы зачета
выбор ассистентов и работа с ними
оформление стенда в классе с вопросами и другой информацией по теме зачета
Зачету предшествует обобщающий урок
по избранной учителем теме.
Слайд 16• возрастных особенностей учащихся • степени подготовленности класса • от задач, ставящихся перед
ВЫБОР ФОРМЫ ПРОВЕДЕНИЯ ЗАЧЕТА ЗАВИСИТ ОТ:
Слайд 17Классический зачет предусматривает выявление уровня знаний, умений и навыков учащихся во
Зачет по типу экзамена принимают несколько комиссий, в состав каждой из которых входят хорошо успевающие ученики из класса.
Групповой зачет предполагает разделение сдающих его учеников на группы по уровню подготовленности.
Для проведения кругового зачета необходимо создать комиссию экзаменаторов, причем каждый из ее членов должен принимать зачет только по одному вопросу.
Для приема зачета по маршруту необходимо создать несколько аттестационных комиссий.
Слайд 18- член комиссии
- наблюдатель
- советчик
- эксперт в конфликтной ситуации
РОЛЬ УЧИТЕЛЯ НА
ОТБОР ЗАЧЕТНОГО МАТЕРИАЛА
задания дифференцированные, а также не только теоретические, но и практические.
Слайд 191. Предмет изучения органической химии. 2. Предпосылки теории строения органических веществ. 3. Основные
Зачетное занятие «Теория химического строения органических веществ» и «Предельные углеводороды»
Слайд 21дает представление об уровне знаний и интеллектуальных умений школьников по какому-либо
КОНТРОЛЬНАЯ РАБОТА
В контрольную работу рекомендуется включать разнообразные задания:
обобщающие вопросы
качественные задачи
расчетные химические задачи
цепочки превращений веществ
тестовые задания
графические задания
Слайд 22«1» – полный ответ «0» – отсутствие ответа «1/2» – неполный ответ «–» –
В каждом контрольном задании необходимо выделить элементы содержания и отметить правильность их выполнения по следующей шкале:
Слайд 23Составьте химическое уравнение взаимодействия оксида меди (I) с углеродом при нагревании,
ЗАДАНИЕ
в контрольной работе для 9-го класса после изучения раздела «Металлы»
Слайд 24- запись химических формул исходных веществ и продуктов реакции; - определение степеней
ЭЛЕМЕНТЫ СОДЕРЖАНИЯ ЗАДАНИЯ
Слайд 25Раздел «Основные классы неорганических соединений» в 8-м классе
Письменные контрольные работы обычно
Расчетная задача: «Сколько граммов соли образовалось при взаимодействии необходимого количества гидроксида натрия с 126 г 30%-го раствора азотной кислоты?»
Слайд 26- запись условия задачи - составление уравнения реакции - вычисление массы растворен- ного
ЭЛЕМЕНТЫ СОДЕРЖАНИЯ
ПРИ РЕШЕНИИ ЗАДАЧИ
Слайд 27- от 96 до 100% работы ставить за контрольную работу оценку
П.А.Глориозов предлагает следующую систему оценивания:
Слайд 28- кратковременна (10–15 мин) - проводится с целью проверки знаний по конкретной
САМОСТОЯТЕЛЬНАЯ ПРОВЕРОЧНАЯ РАБОТА ПО ХИМИИ
В отличие от контрольных работ содержание самостоятельных проверочных работ может быть дифференцировано по уровню сложности.
Слайд 29- вопросы по теме, написанные на доске или на индивидуальных карточках -
ФОРМЫ ПРОВЕДЕНИЯ САМОСТОЯТЕЛЬНЫХ ПРОВЕРОЧНЫХ РАБОТ
Слайд 30ТЕСТЫ – это краткие стандарти-зированные задания, по результатам выполнения которых можно
ТЕСТОВЫЙ КОНТРОЛЬ ЗНАНИЙ ПО ХИМИИ
Слайд 31- тест выборки - тест дополнения - тест
ВИДЫ ТЕСТОВЫХ ЗАДАНИЙ
Слайд 32ТЕСТ ВЫБОРКИ
Самый распространенный
химический элемент в земной коре:
а)
б) водород
в) кислород
г) алюминий
2. Число электронов на последнем энергетическом уровне в атоме азота равно:
а) 7
б) 14
в) 3
г) 5
Слайд 33ТЕСТ ДОПОЛНЕНИЯ
1. Молекула озона состоит из … атомов кислорода. (Ответ
2. Предельный одноатомный спирт, образующий с метанолом простой эфир состава С3Н8О, называется ........................... . (Запишите название спирта по систематической номенклатуре в соответствующем падеже.)
3. Закончите схему превращения:
... + KОН = KСl + Н2О.
Слайд 34ТЕСТ ГРУППИРОВАНИЯ
1. Из предложенного перечня выпишите формулы кислот:
СаО, Н2СО3, Сu(ОН)2, Н3РО4,
H2O, HI, KNO3, Cl2O7, HNO3.
2. Выпишите в две колонки названия чистых веществ и смесей: морская вода, крахмал, сахар, молоко, серебро, уксусная кислота, туман, кислород.
3. В приведенном списке формул веществ подчеркните одной чертой формулы алкенов:
С2Н6, С3Н6, С3Н8, С2Н2, С2Н4О, С2Н4, С5Н10, С2Н4О2.
Слайд 35ТЕСТ РАНЖИРОВАНИЯ
1. Расположите следующие химические элементы в порядке убывания радиусов их
K, Fr, Cs, Li, Na, Rb.
2. Расположите перечисленные вещества в ряд по мере усиления их кислотных свойств: фенол, этанол, 2,4,6-тринитрофенол.
Слайд 36ТЕСТ СЛИЧЕНИЯ
1. По названию вещества установите, к какому классу неорганических веществ
Слайд 391. Укажите число неспаренных электронов в возбужденном атоме углерода.
ТЕСТ НАПОМИНАНИЯ
2.
3. Kакова реакция среды раствора сульфата железа (III)?
4. Напишите уравнения реакций (с указанием условий их проведения), позволяющих осуществить следующие превращения:
Слайд 405. Какие химические превращения произойдут при помещении небольшого кусочка лития в
Составьте химические уравнения происходящих процессов, опишите внешние признаки реакций.
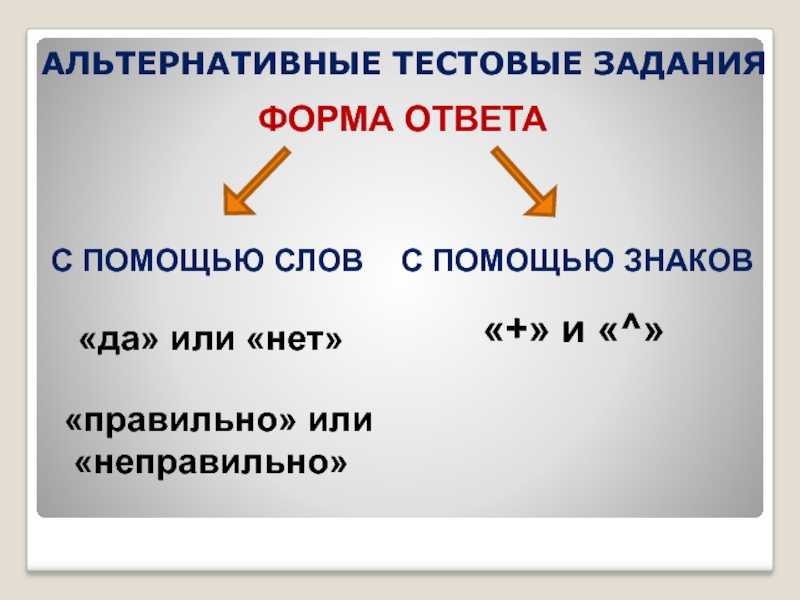
Слайд 41АЛЬТЕРНАТИВНЫЕ ТЕСТОВЫЕ ЗАДАНИЯ
ФОРМА ОТВЕТА
С ПОМОЩЬЮ СЛОВ
С ПОМОЩЬЮ ЗНАКОВ
«да» или «нет»
«правильно» или
«+» и «^»
Слайд 42а) предельный углеводород; б) в молекуле 4 атома водорода; в) бесцветный газ; г)
1. Определите с помощью слов «да» и «нет» истинность или ложность следующих утверждений об этилене:
Ответ. а) Нет; б) да; в) да; г) нет; д) да; е) нет; ж) да; з) нет; и) нет.
Слайд 431) относится к неметаллам; 2) второй по распространенности химический элемент в
2. Графически подтвердите или опровергните с помощью знаков «+» – «да» и «–» – «нет» приведенные ниже высказывания о сере:
Слайд 441) Относится к оксидам. 2) Бесцветен. 3) В молекуле между атомами ковалентные
3. Используя знаки «^» — «да» и «–» — нет», охарактеризуйте угарный газ
(I вариант) и углекислый газ (II вариант).