- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему классификация неорганических веществ
Содержание
- 1. Презентация по химии на тему классификация неорганических веществ
- 2. Слайд 2
- 3. Классификация неорганических веществ. Выполнила Рудакова Анастасия Андреевна
- 4. - (от лат. Allos – другой tropos
- 5. 1.Отличия по внешним признакам
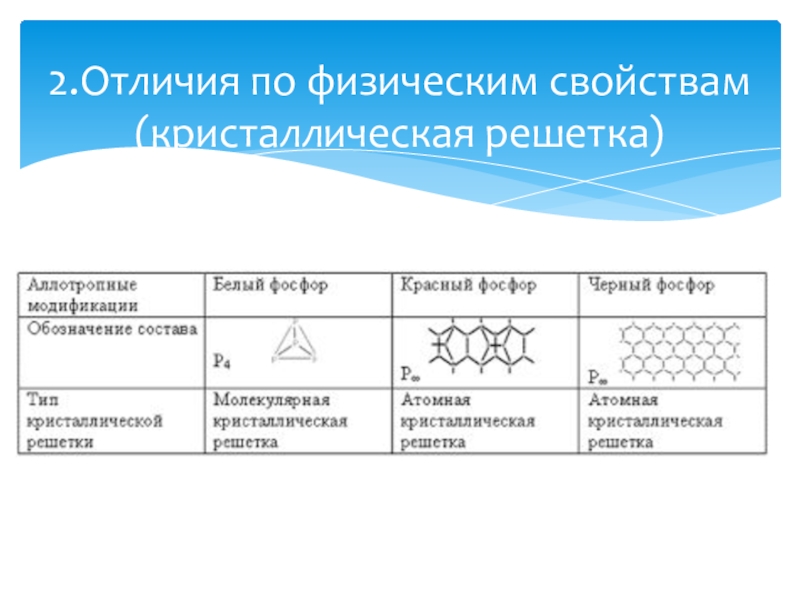
- 6. 2.Отличия по физическим свойствам (кристаллическая решетка)
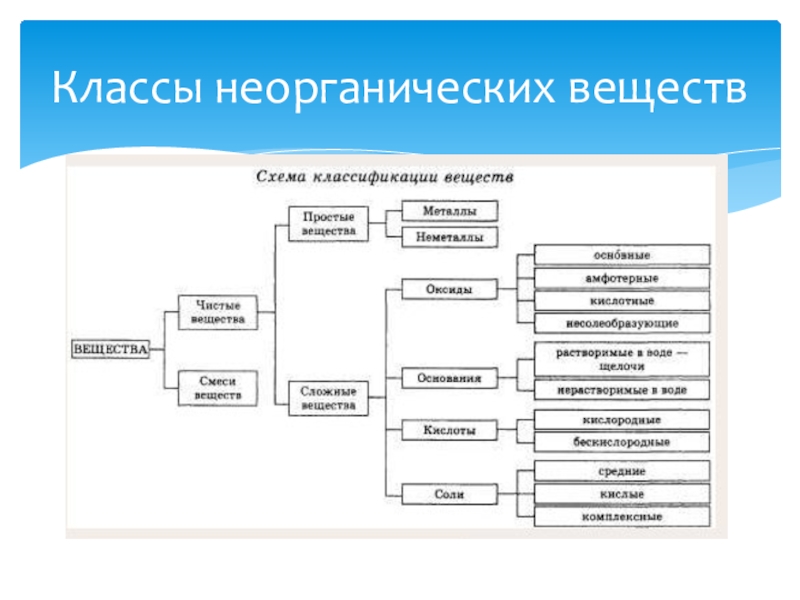
- 7. Классы неорганических веществ
- 8. Оксиды-это сложные вещества, состоящие из двух элементов,
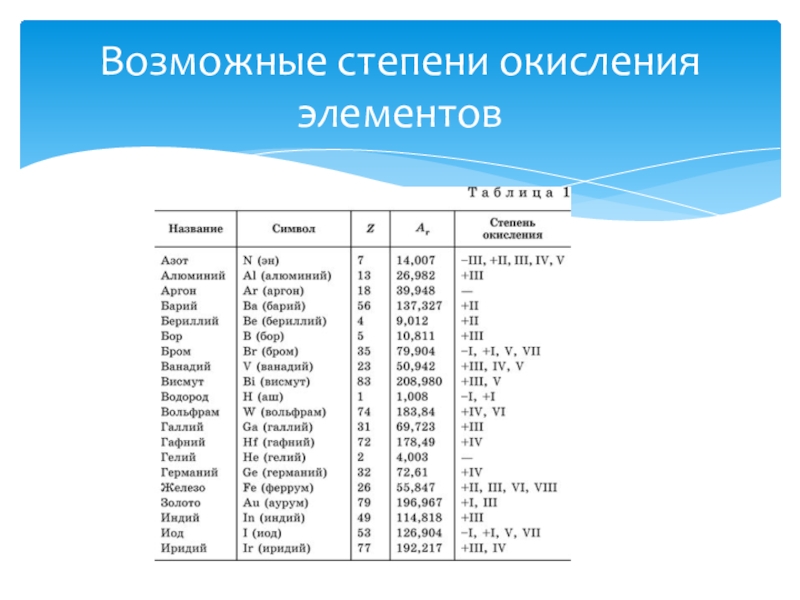
- 9. Возможные степени окисления элементов
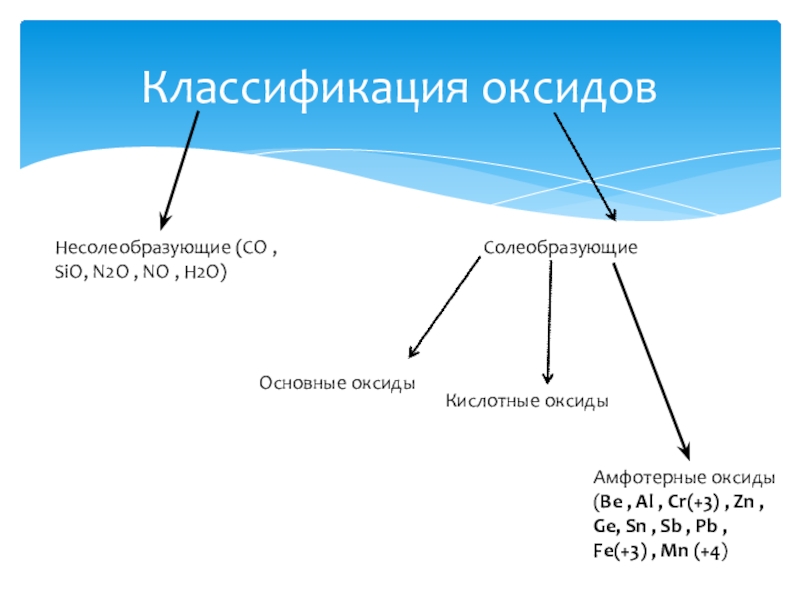
- 10. Классификация оксидовНесолеобразующие (CO , SiO, N2O ,
- 11. -это сложные вещества состоящие из атома Металла
- 12. 1.По числу гидроксид (OH) групп:-однокислотные (NaOH ,
- 13. -это сложные вещества , состоящие из атомов
- 14. 1.По основности:-одноосовные ( HCl , HI ,
- 15. Название кислоты:Название элемента в И.П. + “о”
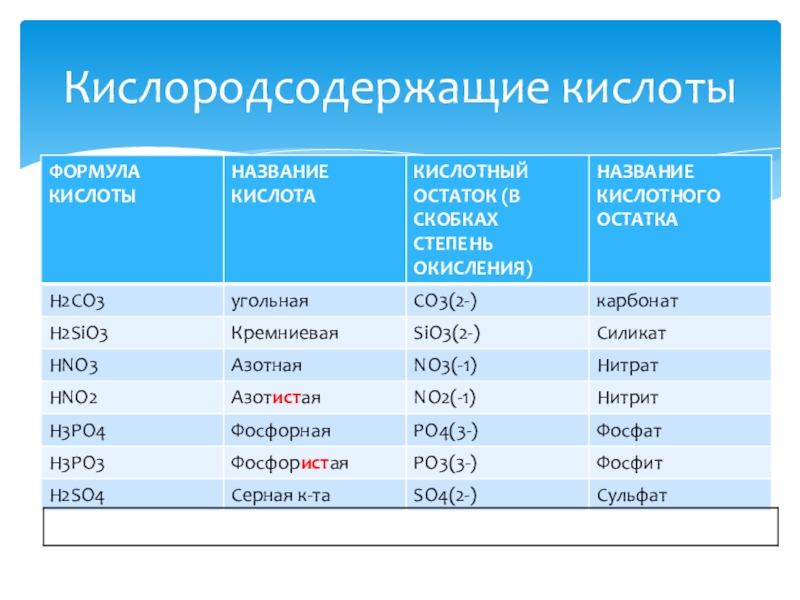
- 16. Кислородсодержащие кислоты
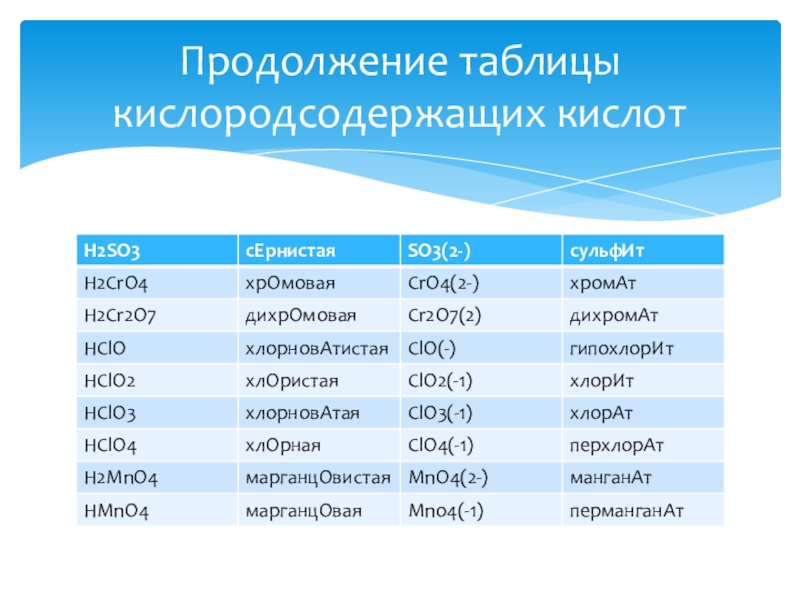
- 17. Продолжение таблицы кислородсодержащих кислот
- 18. Это сложное вещество, состоящие из атома Металла и кислотного остатка.KCl , Na2SO4 , LiI и т.п.СОЛЬ
- 19. НазваниеНазвание кислотного остатка + название металла в
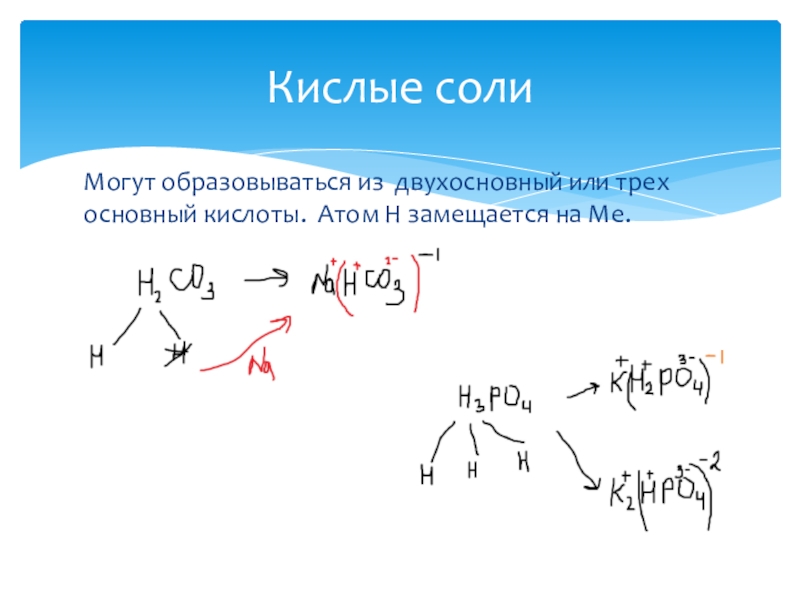
- 20. Могут образовываться из двухосновный или трех основный кислоты. Атом Н замещается на Ме.Кислые соли
- 21. “гидро/дигидро” + название кислотного остатка + название
- 22. Образуются из многокислотных оснований. ОН группа замещается на кислотный остаток.Основные соли
- 23. “гидроксо/дигидроксо” + название кислотного остатка + название
- 24. 1.Учить все2.Сделать А6, А27 (В1) (прислать за
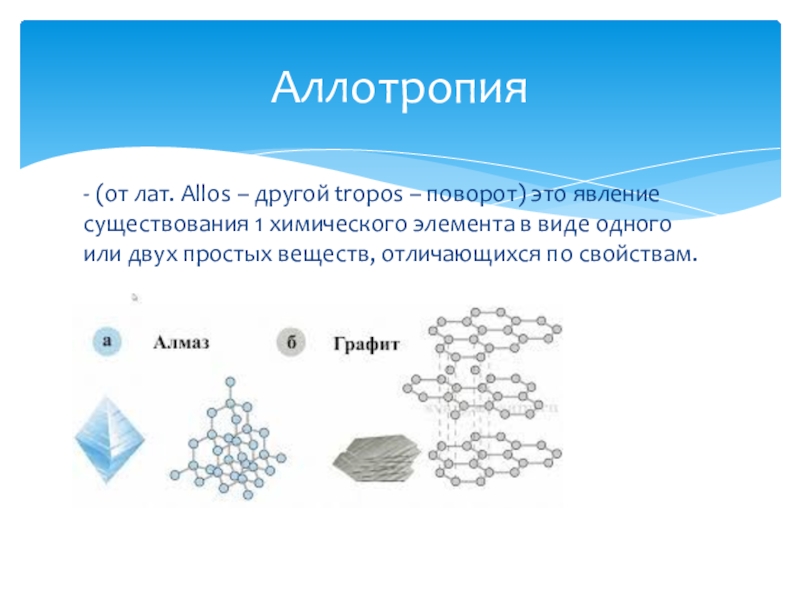
Слайд 4- (от лат. Allos – другой tropos – поворот) это явление
Аллотропия
Слайд 8Оксиды
-это сложные вещества, состоящие из двух элементов, один из которых кислород
На первом месте всегда пишется атом с НАИМЕНЬШИМ значением электроотрицательности.
Пример: Na и О Натрий слабее кислорода и пишется на первом месте. Na2O
НАЗВАНИЕ
“оксид”+название элемента в Р.П. + Валентность элемента римскими цифрами, если элемент проявляет несколько степеней окисления.
Na2O- оксида натрия
FeO – оксид железа (ll)
Слайд 10Классификация оксидов
Несолеобразующие (CO , SiO, N2O , NO , H2O)
Солеобразующие
Основные оксиды
Кислотные
Амфотерные оксиды (Be , Al , Cr(+3) , Zn , Ge, Sn , Sb , Pb , Fe(+3) , Mn (+4)
Слайд 11-это сложные вещества состоящие из атома Металла и ОН (-1) группы.
Название
“гидроксид” + название Металла в Р.П. + валентность элемента римскими цифрами, если может иметь несколько степеней окисления.
KOH- гидроксид калия
Cu(OH)2 – гидроксид меди (ll)
Гидроксиды (основания)
Слайд 121.По числу гидроксид (OH) групп:
-однокислотные (NaOH , KOH , LiOH и
-двухкислотные ( Fe(OH)2 , Cu(OH)2 , Ca(OH)2 и т.п.)
-трехкислотные (Al(OH)3 , Bi(OH)3 и т.п.)
2.По растворимости:
-растворимые в воде основания (щелочи) -нерастворимые
3.Амфотерные
Истинные
Классификации основания.
Слайд 13-это сложные вещества , состоящие из атомов водорода и кислотного остатка
Н2SO4
SO4(2-)- кислотный остаток, степень его окисления определяется количеством водорода в молекуле кислоты.
КИСЛОТЫ
Слайд 141.По основности:
-одноосовные ( HCl , HI , HBr, HNO3 и т.п.)
-двухосновные
-трехосновные ( H3PO4 и т.п.)
2.По содержанию атома кислорода в кислотном остатке
-бескислородные
-кислородсодержащие
Классификация
Слайд 15Название кислоты:
Название элемента в И.П. + “о” + “водородная кислота”
HBr –
HCl – хлороводородная кислота
Название кислотного остатка:
Название элемента в И.П. + “ид”
SCN(-1) - роданид
CN(-1)- цианид
C – карбид
Р – фосфид
S- сульфид
Si – силицид
Остальное по таблице Менделеева.
Тривиальные названия некоторых кислот:
HCl – соляная кислота
HF- плавиковая кислота
HCN – синильная кислота
Бескислородные кислоты
Слайд 18Это сложное вещество, состоящие из атома Металла и кислотного остатка.
KCl ,
СОЛЬ
Слайд 19Название
Название кислотного остатка + название металла в Р.П. + валентность металла,
LiCl – хлорид лития
FeSO4 – сульфат железа (ll)
Нормальные (средние ) соли
Слайд 20Могут образовываться из двухосновный или трех основный кислоты. Атом Н замещается
Кислые соли
Слайд 21“гидро/дигидро” + название кислотного остатка + название Ме в Р.П. +
NaHCO3 – гидрокарбонат натрия
KH2PO4 – дигидрофосфат калия
FeHPO4 – гидрофосфат железа (определить какая валентность у железа?)
Название кислых солей
Слайд 22Образуются из многокислотных оснований. ОН группа замещается на кислотный остаток.
Основные соли
Слайд 23“гидроксо/дигидроксо” + название кислотного остатка + название металла в Р.П. +
CaOHCl – гидроксохлорид кальция
(CaOH)2SO4 – гидроксосульфат кальция
Fe(OH)2NO3 – дигидроксонитрат железа (lll)
Название основной соли
Слайд 241.Учить все
2.Сделать А6, А27 (В1) (прислать за день в vk или
3.Незнайка тема 5 (если есть ошибки прислать в вк за день до занятия)
дз