- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Классификация химических реакций
Содержание
- 1. Презентация по химии на тему: Классификация химических реакций
- 2. ЦЕЛИ УРОКА:- Повторить, углубить и обобщить
- 3. «Осень. Обсыпается весь наш бедный сад,
- 4. - Какие явления могут происходить с веществами?- В чем разница между физическими и химическими явлениями?
- 5. это процессы, в результате которых из одних
- 6. В печени человека протекает около 20 000 000 химических
- 7. РЕАКЦИИ ВОКРУГ НАС Основные, базовые химические процессы организма
- 8. Признаки химических реакций:Образование осадкаПоявление запахаВыделение или поглощение энергииВыделение газаИзменение окраски
- 9. Сущность химических реакций:Сущность химических реакций сводится к
- 10. Сущность химических реакций:В 1748 году русским ученым
- 11. Идут химические реакции – и самолет поднимается
- 12. Химические реакции
- 13. Химические реакции
- 14. Химические реакции
- 15. По числу и составу реагирующих и
- 16. I. По числу и составу реагирующих и
- 17. I. По числу и составу реагирующих и
- 18. I. По числу и составу реагирующих и
- 19. I. По числу и составу реагирующих и
- 20. Получение кислорода из перманганата калия:Классификацияхимических реакций
- 21. I. По числу и составу реагирующих и
- 22. Взаимодействие натрия с водой:Классификацияхимических реакций
- 23. I. По числу и составу реагирующих и
- 24. II. По изменению степеней окисления химических элементов:1.
- 25. III. По использованию катализатора:1. Некаталитические реакции –
- 26. III. По использованию катализатора:1. Каталитические реакции –
- 27. Разложение пероксида водорода:Классификацияхимических реакций
- 28. IV. По направлению:1. Необратимые реакции протекают в
- 29. V. По механизму:1. Радикальные реакции – идут
- 30. V. По механизму:2. Ионные реакции – идут
- 31. VI. По тепловому эффекту:1. Экзотермические реакции протекают
- 32. VI. По тепловому эффекту:2. Эндотермические реакции протекают
- 33. VII. По виду энергии, инициирующей реакцию:Фотохимические реакции
- 34. VIII. По фазовому составу:1. Гетерогенные реакции –
- 35. Восстановление оксида меди (II) водородом:Классификацияхимических реакций
- 36. VIII. По фазовому составу:2. Гомогенные реакции –
- 37. 1.Прокалите медную проволоку в пламени спиртовки 2.Взаимодействие
- 38. Реакция, уравнение которой2СО → СО2 + С
- 39. Реакция, уравнение которойN2 + O2 →2NO -
- 40. Реакция, уравнение которой2SO2(г) + O2(г) ↔SO3(г)относится к
- 41. Реакция, уравнение которой катN2(г)
- 42. Решить задачу:При восстановлении железа из 100 г
- 43. Ответ: Тепловой эффект реакции восстановления железа алюминием
- 44. Независимо от того, между какими веществами –
- 45. Я всё это знал; Чувствовал себя уверенно;Чувствовал
- 46. Домашнее задание:Выучить параграф 11, выполнить упражнение 3, решить задачу 1 на стр. 48Классификацияхимических реакций
Слайд 2 ЦЕЛИ УРОКА:
- Повторить, углубить и обобщить сведения о химических реакциях.
-
- Выявить единство и взаимосвязь химических превращений между органическими и неорганическими веществами.
- Формировать умения логически мыслить, -составлять схемы, делать выводы.
Слайд 3
«Осень. Обсыпается весь наш бедный сад,
Листья пожелтелые по
Лишь вдали красуются, там на дне долин,
Кисти ярко-красные вянущих рябин.»
(А.К.Толстой)
Во время грозы образовался озон.
Железный гвоздь, лежавший на влажной земле, покрылся ржавчиной.
Что объединяет эти явления?
Что лежит в их основе?
Слайд 4
- Какие явления могут происходить с веществами?
- В чем разница
Слайд 5это процессы, в результате которых из одних веществ образуются другие, отличающиеся
Химические реакции -
Слайд 6В печени человека протекает около 20 000 000 химических реакций
Ежесекундно в организме человека
РЕАКЦИИ ВОКРУГ НАС
Слайд 7РЕАКЦИИ ВОКРУГ НАС
Основные, базовые химические процессы организма проявляются во взаимодействии кислоты
Человек с рН-уровнем крови 7,35 являющимся для него нормой, таким образом является щелочным живым существом.
Слайд 8Признаки химических реакций:
Образование осадка
Появление запаха
Выделение или поглощение энергии
Выделение газа
Изменение окраски
Слайд 9Сущность химических реакций:
Сущность химических реакций сводится к разрыву связей в исходных
Слайд 10Сущность химических реакций:
В 1748 году русским ученым М.В.Ломоносовым – закон сохранения
Кем была установлена эта
закономерность?
Слайд 11Идут химические реакции – и самолет поднимается в воздух, льется в
Только за последние годы химиками созданы сотни новых видов изделий и материалов, и не меньше прогрессивных, оригинальных технологических процессов.
Слайд 12 Химические реакции
в сельском хозяйстве
Среди наиболее
Слайд 13 Химические реакции
в промышленности:
Созданы новые
Слайд 14 Химические реакции
в промышленности и быту:
Освоена технология получения полиизопренового каучука. Это позволило заметно снизить расход натурального каучука в шинной промышленности, сэкономить огромные деньги.
Весьма интересны результаты в области защиты металлов от коррозии. Привлекательность созданных покрытий еще и в том, что приготовляются они из недорогих и недефицитных компонентов.
Слайд 15 По числу и составу реагирующих и образующихся веществ
По изменению
По использованию катализатора
По направлению
По механизму
По тепловому эффекту
По виду энергии, инициирующей реакцию
По фазовому составу
Классификация
химических реакций
Слайд 16I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие без
В неорганической химии к таким реакциям относят процессы получения аллотропных модификаций одного химического элемента, например:
Классификация
химических реакций
Sn (белое олово) Sn (серое олово)
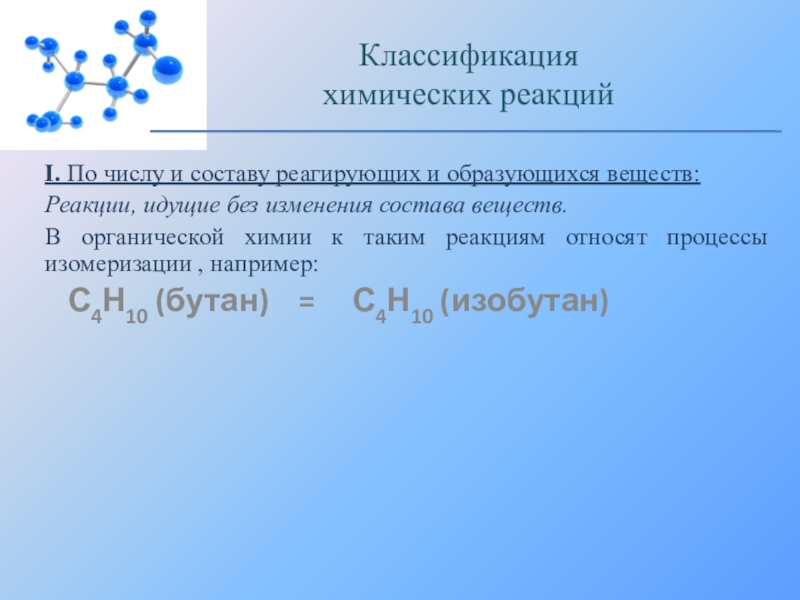
Слайд 17I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие без
В органической химии к таким реакциям относят процессы изомеризации , например:
С4Н10 (бутан) = С4Н10 (изобутан)
Классификация
химических реакций
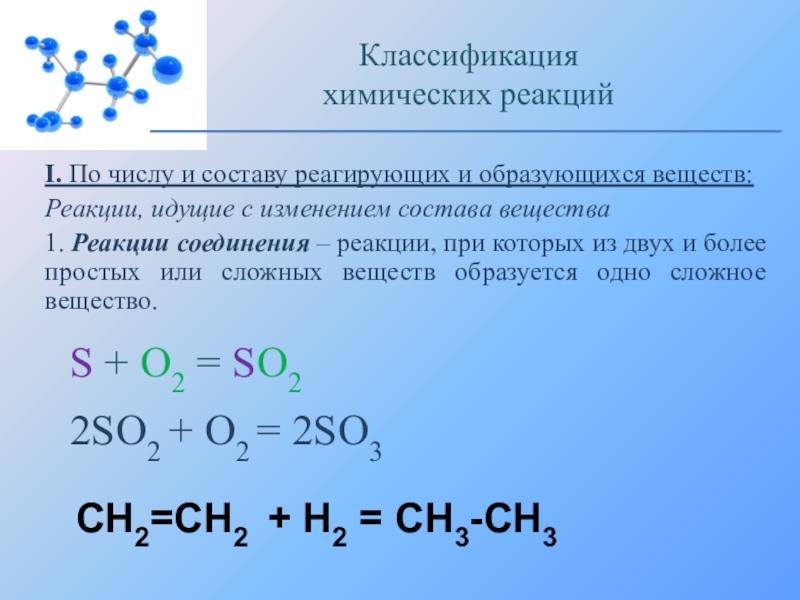
Слайд 18I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с
1. Реакции соединения – реакции, при которых из двух и более простых или сложных веществ образуется одно сложное вещество.
Классификация
химических реакций
S + O2 = SO2
2SO2 + O2 = 2SO3
CH2=CH2 + H2 = CH3-CH3
Слайд 19I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с
2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Классификация
химических реакций
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2
2 CH4 = C2H2 + 3H2
Слайд 21I. По числу и составу реагирующих и образующихся веществ:
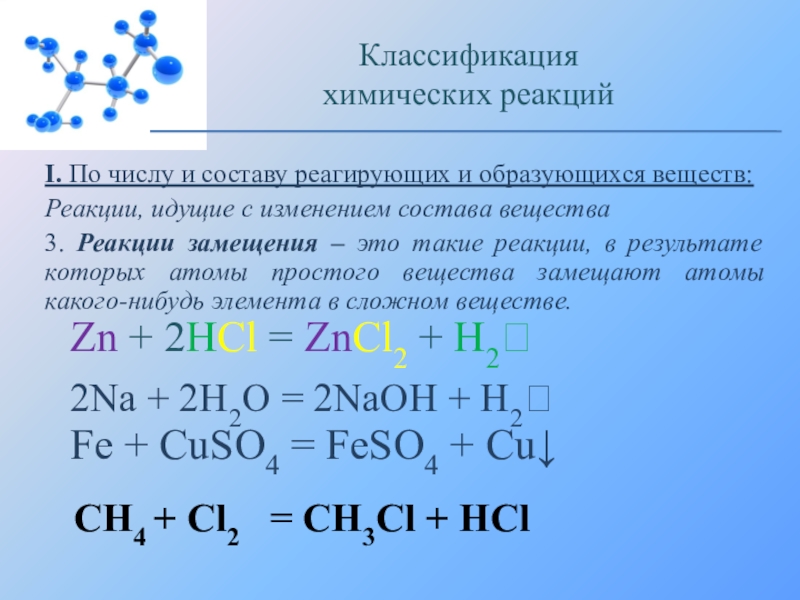
Реакции, идущие с
3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
Классификация
химических реакций
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Fe + CuSO4 = FeSO4 + Cu↓
СН4 + Сl2 = CH3Cl + HCl
Слайд 23I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с
4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Классификация
химических реакций
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH + HNO3 = NaNO3 + H2O
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
CH3 – COOH + NaOH =
CH3 – COONa + H2O
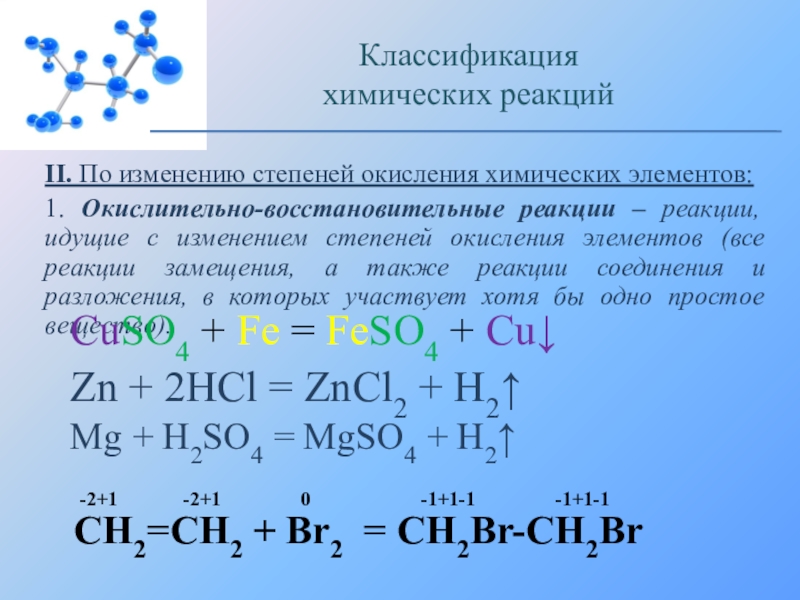
Слайд 24II. По изменению степеней окисления химических элементов:
1. Окислительно-восстановительные реакции – реакции,
Классификация
химических реакций
CuSO4 + Fe = FeSO4 + Cu↓
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
CH2=CH2 + Br2 = CH2Br-CH2Br
-2+1 -2+1 0 -1+1-1 -1+1-1
Слайд 25III. По использованию катализатора:
1. Некаталитические реакции – реакции, идущие без участия
Классификация
химических реакций
2HgO = 2Hg + O2↑
t
Слайд 26III. По использованию катализатора:
1. Каталитические реакции – реакции, идущие с участием
Классификация
химических реакций
2H2O2 = 2H2O + O2↑
MnO2
Слайд 28IV. По направлению:
1. Необратимые реакции протекают в данных условиях только в
Классификация
химических реакций
Ba(ClO2)2 + H2SO4 = 2HClO2 + BaSO4↓
2. Обратимые реакции в данных условиях протекают одновременно в двух направлениях:
3H2 + N2 2NH3
N2O4 2NO2
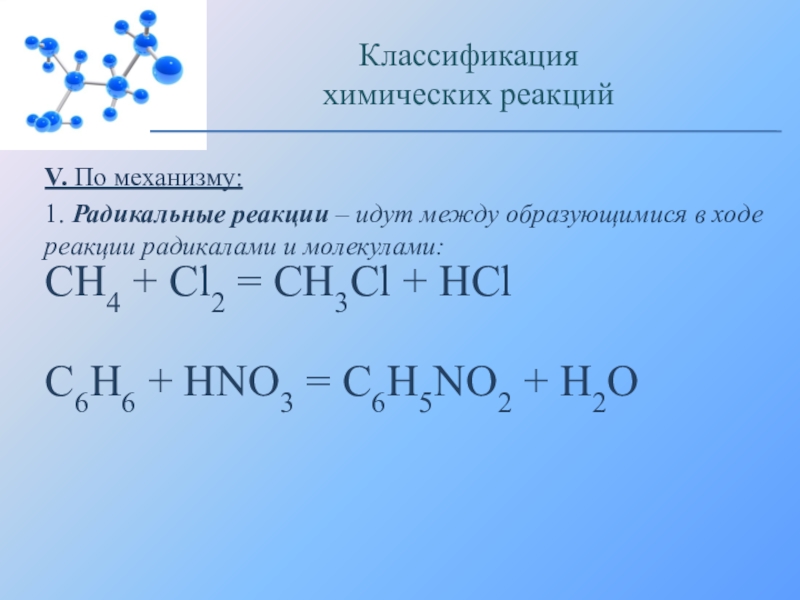
Слайд 29V. По механизму:
1. Радикальные реакции – идут между образующимися в ходе
Классификация
химических реакций
CH4 + Cl2 = CH3Cl + HCl
C6H6 + HNO3 = C6H5NO2 + H2O
Слайд 30V. По механизму:
2. Ионные реакции – идут между уже имеющимися или
Классификация
химических реакций
C2H4 + HBr = C2H5Br
Слайд 31VI. По тепловому эффекту:
1. Экзотермические реакции протекают с выделением энергии:
Классификация
химических реакций
4P
Слайд 32VI. По тепловому эффекту:
2. Эндотермические реакции протекают с поглощением энергии:
Классификация
химических реакций
N2
2HgO = 2Hg↓ + O2↑ - Q кДж
Слайд 33VII. По виду энергии, инициирующей реакцию:
Фотохимические реакции инициируются световой энергией.
Радиационные реакции
Электрохимические реакции инициируются электрическим током (электролиз).
Термохимические реакции инициируются тепловой энергией (все эндотермические реакции и множество экзотермических).
Классификация
химических реакций
Слайд 34VIII. По фазовому составу:
1. Гетерогенные реакции – реакции, в которых реагирующие
Классификация
химических реакций
CuO↓ + H2↑ = Cu↓ + H2O
Слайд 36VIII. По фазовому составу:
2. Гомогенные реакции – реакции, в которых реагирующие
Классификация
химических реакций
2 СО↑ + О₂↑ = 2 СО₂↑
Слайд 371.Прокалите медную проволоку в пламени спиртовки
2.Взаимодействие цинка с соляной кислотой.
3.
4. Взаимодействие хлорида бария с сульфатом натрия.
5. Взаимодействие карбоната натрия с соляной кислотой.
6. Взаимодействие уксусной кислоты с гидроксидом натрия.
Напишите уравнения реакций и классифицируйте их по разным признакам.
Проделайте следующие опыты:
Слайд 38Реакция, уравнение которой
2СО → СО2 + С + Q
относится к
А) соединения, экзотермическим
Б) разложения, экзотермическим
В) соединения, эндотермическим
Г) разложения, эндотермическим
Классификация
химических реакций
Слайд 39Реакция, уравнение которой
N2 + O2 →2NO - Q
относится к реакциям:
А)
Б) соединения, экзотермическим
В) разложения, эндотермическим
Г) разложения, экзотермическим
Классификация
химических реакций
Слайд 40Реакция, уравнение которой
2SO2(г) + O2(г) ↔SO3(г)
относится к реакциям:
А) соединения, необратимым, гетерогенным
Б)
В) соединения, обратимым, гомогенным
Г) обмена, необратимым, гетерогенным
Классификация
химических реакций
Слайд 41Реакция, уравнение которой
кат
N2(г) + 3H2(г) ↔ 2NH3(г)
относится
А) каталитическим, замещения, гомогенным
Б)некаталитическим, соединения, гетерогенным
В) каталитическим, соединения, гомогенным
Г) некаталитическим, замещения, гетерогенным
Классификация
химических реакций
Слайд 42Решить задачу:
При восстановлении железа из 100 г оксида железа (III) алюминием
Классификация
химических реакций
Слайд 43Ответ:
Тепловой эффект реакции восстановления железа алюминием из оксида равен 761,
Классификация
химических реакций
Слайд 44Независимо от того, между какими веществами – органическими или неорганическими –
ВЫВОД:
Слайд 45Я всё это знал;
Чувствовал себя уверенно;
Чувствовал не очень уверенно;
Узнал
Часть материала оказалась для меня новой;
Было не очень интересно;
На уроке было интересно!
Классификация
химических реакций
Слайд 46Домашнее задание:
Выучить параграф 11, выполнить упражнение 3, решить задачу 1 на
Классификация
химических реакций