- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Теория электролитической диссоциации
Содержание
- 1. Презентация Теория электролитической диссоциации
- 2. Теория электролитической
- 3. СодержаниеЭлектролиты и неэлектролитыТеория электролитической диссоциации Механизм электролитической
- 4. Все вещества по отношению к электрическому
- 5. 1 ЭлектролитыНеэлектролиты
- 6. ++++----АнионыКатионыАнодКатод-+Электролиты
- 7. АнодКатод-+Неэлектролиты
- 8. 2.Электролитическая диссоциацияАррениус Сванте Август Шведский
- 9. Существенный вклад в развитие ТЭД внесли русские
- 10. Электролитическая диссоциация – процесс распада электролита на
- 11. 3. Ионы непрерывно движутся. Происходит ассоциация - притяжение
- 12. ++--++--РастворКристалл-+++--++---+NaCl → Na+ + Cl - Механизм электролитической диссоциации веществ с ионной связьюГидратированные ионыН2О
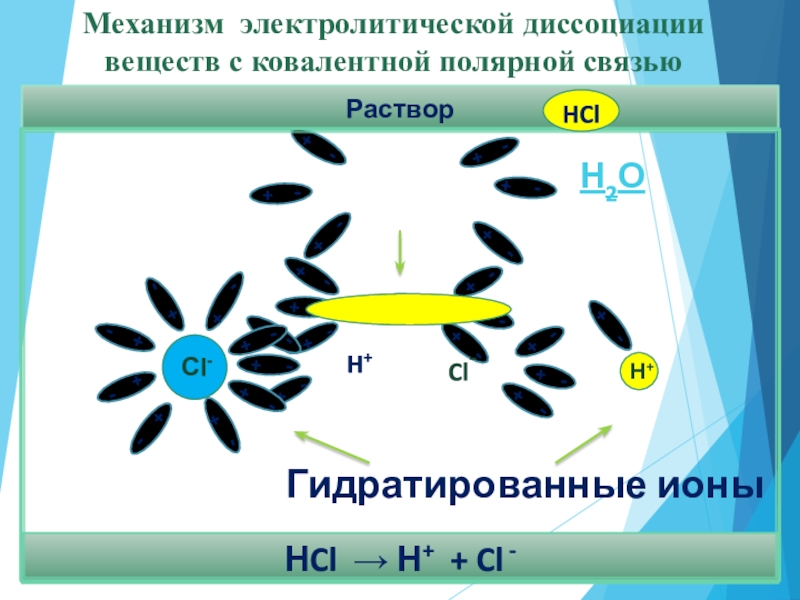
- 13. РастворНCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связьюН2ОГидратированные ионы
- 14. Степень электролитической диссоциации (α) - отношение числа
- 15. Константа диссоциации – отношение произведения концентрации продуктов диссоциации к концентрации недиссоциированных молекул.
- 16. 2.Сильные и слабые электролитыHCl+++Сильные и слабыеРис.6.
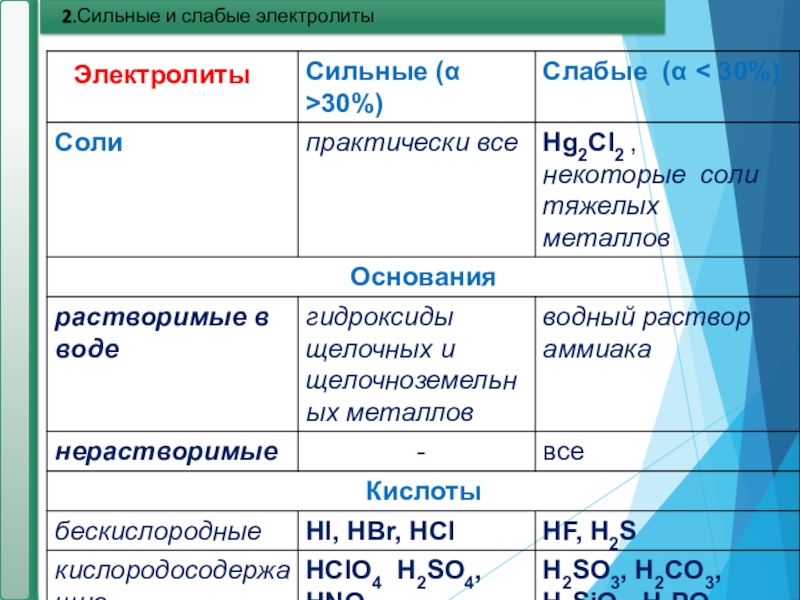
- 17. 2.Сильные и слабые электролитыЭлектролиты
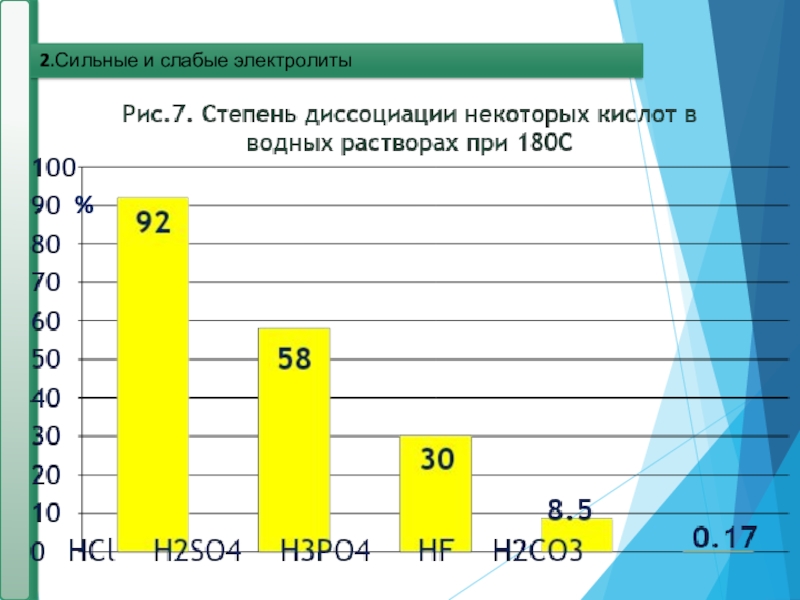
- 18. 2.Сильные и слабые электролиты%
- 19. 6. О значении электролитов для
- 20. Характерные симптомы дефицита химических элементов в организме человека подробнее
Слайд 2
Теория электролитической диссоциации (ТЭД).
Презентация подготовлена
Преподавателем химии
Финансово-технологического
Колледжа СГАУ м. Н.И. Вавилова
Ковальчук Е.Я.
Саратов
Слайд 3Содержание
Электролиты и неэлектролиты
Теория электролитической диссоциации
Механизм электролитической диссоциации
веществ с ионной
Механизм электролитической диссоциации
веществ с ковалентной полярной связью
Сильные и слабые электролиты
Количественная оценка диссоциации
О значении электролитов для живых организмов
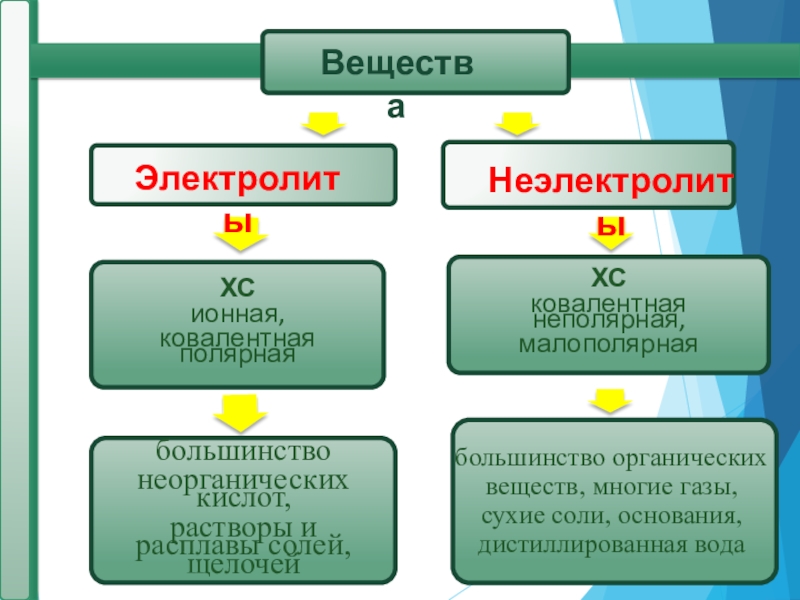
Слайд 4 Все вещества по отношению к электрическому току можно разделить на
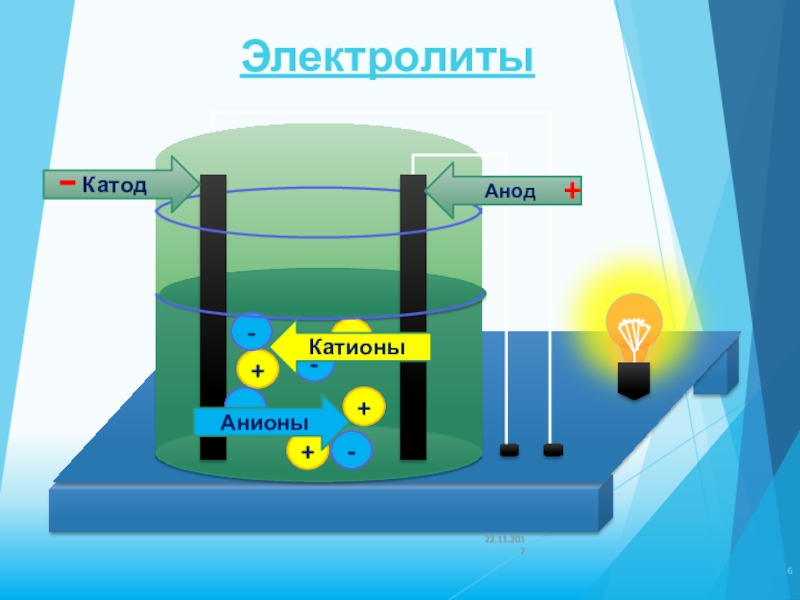
Электролиты – вещества, растворы и расплавы которых проводят электрический ток.
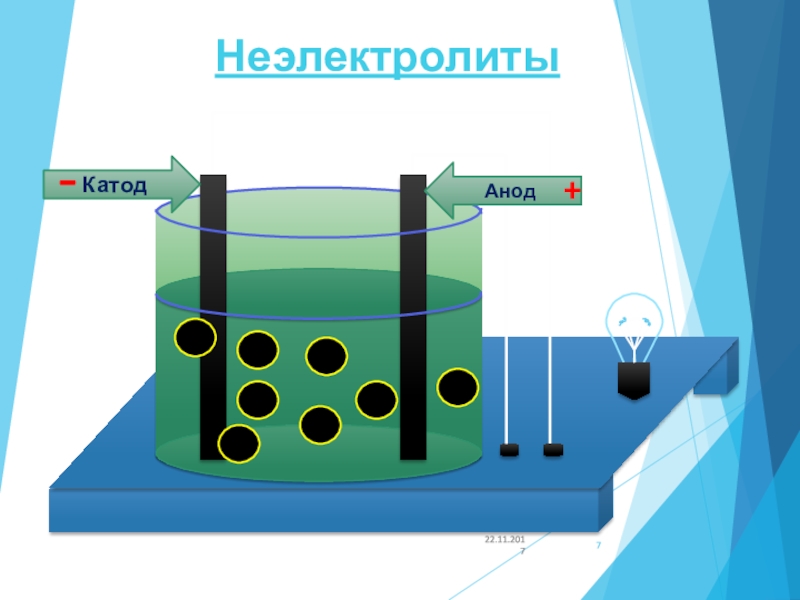
Неэлектролиты – вещества, растворы и расплавы которых не проводят
электрический ток.
Слайд 8 2.Электролитическая диссоциация
Аррениус Сванте
Август
Шведский ученый, академик.
В 1887 году
В 1903 г. награжден Нобелевской премией.
Проводил исследования во многих других областях науки.
С.Аррениус
(1859 – 1927)
Слайд 9Существенный вклад в развитие ТЭД внесли русские ученые И.А. Каблуков и
Кистяковский Владимир Александрович
Каблуков Иван Алексеевич
Слайд 10Электролитическая диссоциация – процесс распада электролита на ионы.
1. Все вещества по
2. Электролиты диссоциируют на ионы: положительные(катионы) и отрицательные(анионы). Суммарный заряд всех катионов равен суммарному заряду катионов, в целом раствор(расплав) нейтрален.
Слайд 113. Ионы непрерывно движутся. Происходит ассоциация - притяжение противоположно заряженных ионов с
4. Равновесное состояние водного раствора электролита характеризует степень электролитической диссоциации.
Слайд 12+
+
-
-
+
+
-
-
Раствор
Кристалл
-
+
+
+
-
-
+
+
-
-
-
+
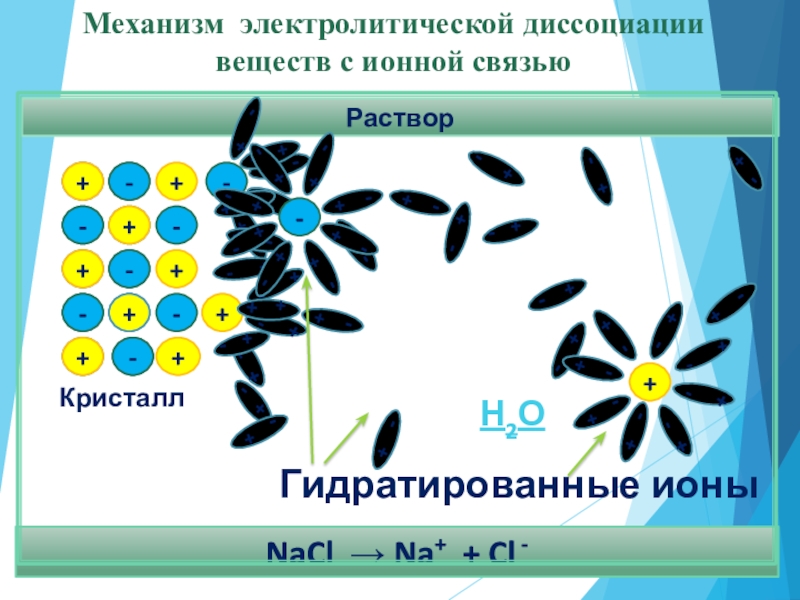
NaCl → Na+ + Cl -
Механизм электролитической диссоциации
веществ с
Гидратированные ионы
Н2О
Слайд 13
Раствор
НCl → Н+ + Cl -
Механизм электролитической диссоциации
веществ с
Н2О
Гидратированные ионы
Слайд 14Степень электролитической
диссоциации (α) - отношение числа частиц, распавшихся на ионы
α =
n
N
Сильные электролиты α > 30%
Средние электролиты
α = 2 – 30%
Слабые электролиты
α< 2%
Количественная оценка диссоциации
Слайд 15Константа диссоциации – отношение произведения концентрации продуктов диссоциации к концентрации недиссоциированных
Слайд 19 6. О значении электролитов для живых организмов
Электролитическая диссоциация
Электролиты – составная часть жидкостей и плотных тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; имеют большое значение для физиологических и биохимических процессов:
ионы H+; OH- играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0,85% раствор NaCl;
ионы I - влияют на работу щитовидной железы.
НCO3-