- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Кислоты
Содержание
- 1. Презентация по химии на тему: Кислоты
- 2. Яблочная кислота – в яблоках и ревенеВ природе существует множество различных кислот
- 3. Лимонная кислота – в лимонах
- 4. Кислый вкус листьев щавеля, шпината и томатов обусловлен щавелевой кислотой
- 5. Молочная кислота – в мышцах
- 6. Уксусная кислота – в уксусе
- 7. Винная кислота – в винограде
- 8. Муравьиная кислота – в яде муравьев и пчел
- 9. Твердые кислоты: лимонная кислота, пальмитиновая кислота, борная кислота и другие.
- 10. Кроме природных кислот, существуют и такие, которые
- 11. Хлороводородная (соляная) кислота HCl – бесцветная жидкость.
- 12. Химическая формула серной кислоты – H2SO4.Плотность серной
- 13. Концентрированная серная кислота разрушает ткани,
- 14. …обугливает бумагу,
- 15. …обугливает сахар.
- 16. При смешивании концентрированной серной кислоты с
- 17. При разбавлении концентрированной серной кислоты всегда соблюдайте
- 18. Хлороводородная кислота – едкое вещество, она повреждает
- 19. Слайд 19
- 20. Слайд 20
- 21. Кислоты – это соединения,
- 22. H2SO4
- 23. КЛАССИФИКАЦИЯ КИСЛОТ ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА
- 24. КЛАССИФИКАЦИЯ КИСЛОТ ПО СОДЕРЖАНИЮ АТОМОВ КИСЛОРОДА В
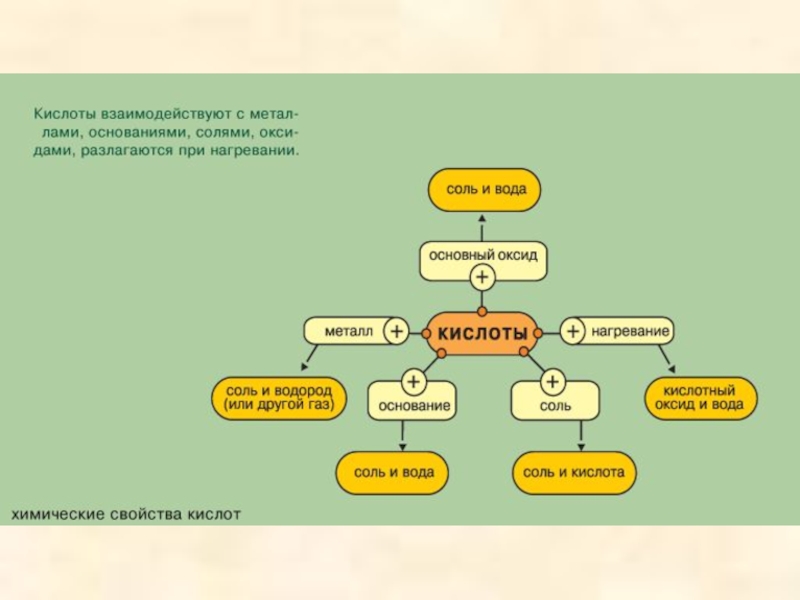
- 25. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ Урок 40 * год
- 26. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ ИЗМЕНЕНИЕ
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Вытеснительный ряд металлов Русский химик
- 31. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ2. КИСЛОТ А + МЕТАЛЛ
- 32. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ3. КИСЛОТА + ОСНОВНОЙ ОКСИД → СОЛЬ + ВОДАCuO +H2SO4 →
- 33. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4. КИСЛОТА + ОСНОВАНИЕ →СОЛЬ + ВОДА NaOH + HCl→ ф/ф
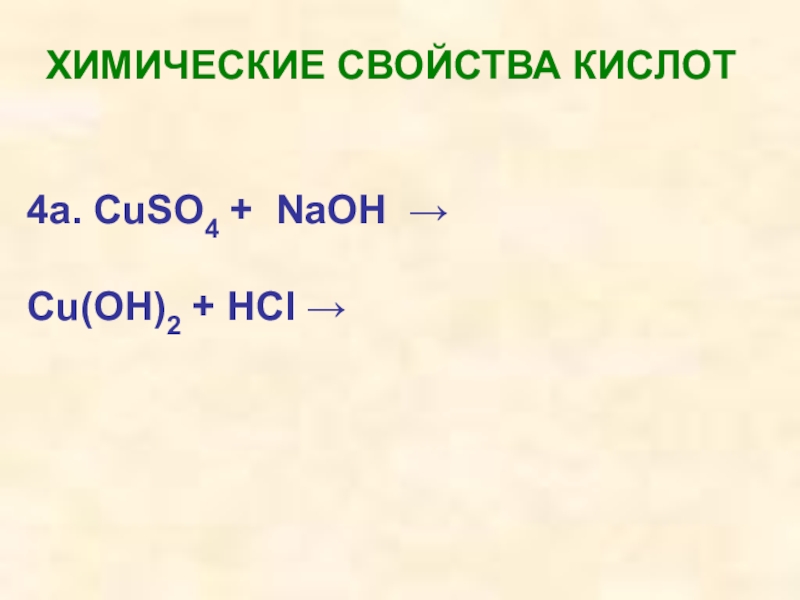
- 34. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4a. CuSO4 + NaOH → Cu(OH)2 + HCl →
- 35. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ5. КИСЛОТА + СОЛЬ →
- 36. H2SO4 + KOH→ Na2SiO3 + HCl →
- 37. Военное значение кислот.Взрывчатые вещества: бризантные а)повышенной мощности:
- 38. Применение кислот разнообразно –химическая и пищевая промышленность, лабораторные и медицинские исследования, получение энергии (аккумуляторы).
- 39. Кислоты в вашей аптечкеВ своей домашней аптечке
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Слайд 43
- 44. Кислотные дожди
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Слайд 48
- 49. Кислоты попадают на землю вместе с дождем,
- 50. Кислотная среда ускоряет рост грибков и бактерий,
- 51. Слайд 51
- 52. Кислотные дожди также разрушают здания, памятники и металлические конструкции.
- 53. Слайд 53
- 54. Слайд 54
- 55. Кислотные дожди воздействуют на пигменты, входящие в состав красок
Яблочная кислота – в яблоках и ревенеВ природе существует множество различных кислот
Слайд 10Кроме природных кислот, существуют и такие, которые получают промышленным путем для
использования их в производстве и в лабораториях (например, серная и соляная кислоты).
Кислоты могут быть как в жидком, так и в твердом агрегатном состоянии.
Жидкие кислоты:
серная кислота
азотная кислота
хлороводородная (соляная) кислота…
Кислоты могут быть как в жидком, так и в твердом агрегатном состоянии.
Жидкие кислоты:
серная кислота
азотная кислота
хлороводородная (соляная) кислота…
Слайд 11Хлороводородная (соляная) кислота HCl – бесцветная жидкость. Она имеет запах хлороводорода.
Соляная кислота ”дымит” на воздухе – это является её характерным свойством.
Слайд 12Химическая формула серной кислоты – H2SO4.
Плотность серной кислоты – 1,84 г
/см3,плотность воды – 1 г /см3.
Концентрированная серная кислота – это бесцветная маслянистая жидкость, без запаха, примерно в два раза тяжелее воды.
Концентрированная серная кислота – это бесцветная маслянистая жидкость, без запаха, примерно в два раза тяжелее воды.
Слайд 16 При смешивании концентрированной серной кислоты с водой выделяется большое количество
теплоты, и температура смеси повышается.
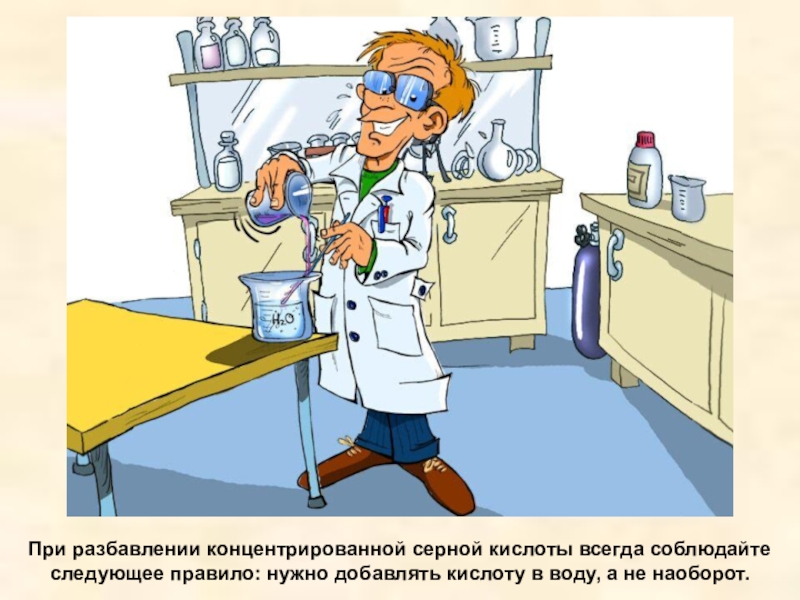
Слайд 17При разбавлении концентрированной серной кислоты всегда соблюдайте следующее правило: нужно добавлять
кислоту в воду, а не наоборот.
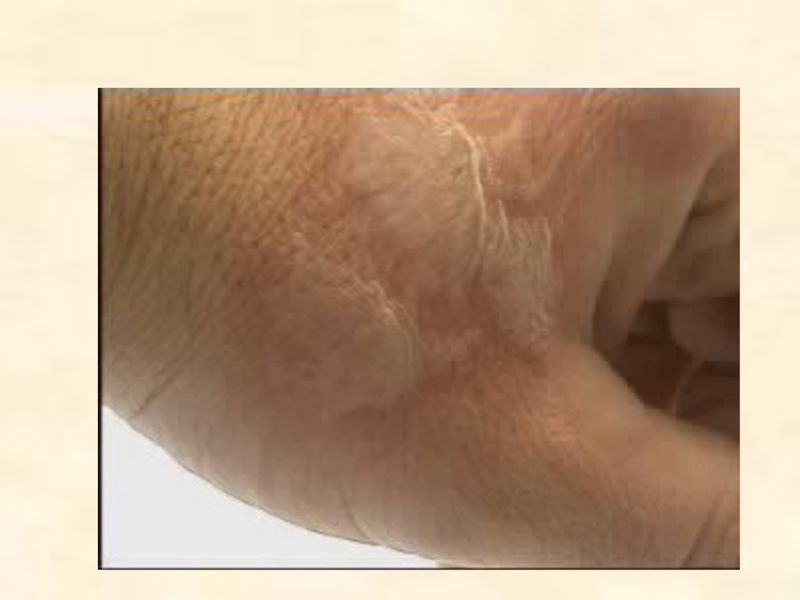
Слайд 18Хлороводородная кислота – едкое вещество, она повреждает ткань, бумагу и древесину.
При попадании на кожу вызывает ожоги.
Слайд 21 Кислоты – это соединения,
состоящие из кислотных остатков
и атомов водорода,
способных замещаться атомами металлов
с образованием солей.
Слайд 23КЛАССИФИКАЦИЯ КИСЛОТ
ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА В МОЛЕКУЛЕ
КИСЛОТЫ
ОДНООСНОВНЫЕ
МНОГООСНОВНЫЕ
HCl HNO3
ДВУХОСНОВНЫЕ H2S
HCl HNO3
ДВУХОСНОВНЫЕ H2S
H3PO4
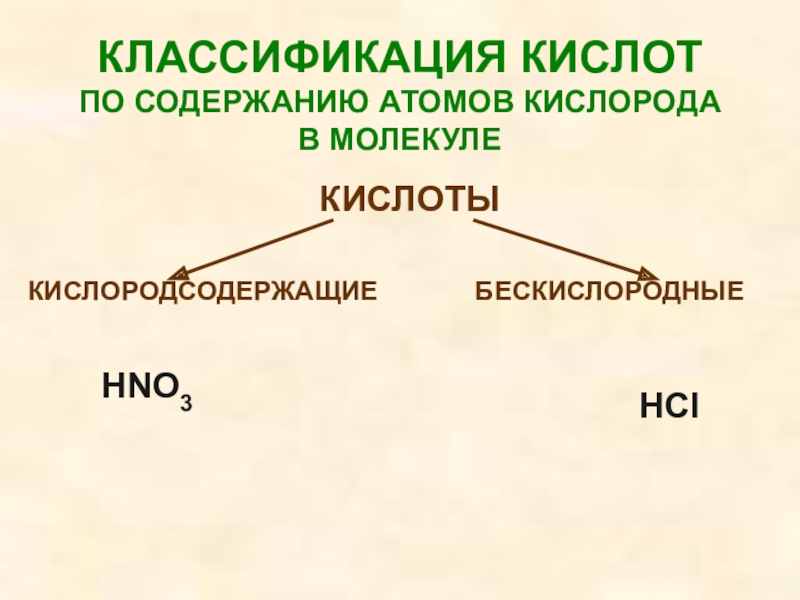
Слайд 24КЛАССИФИКАЦИЯ КИСЛОТ
ПО СОДЕРЖАНИЮ АТОМОВ КИСЛОРОДА В МОЛЕКУЛЕ
КИСЛОТЫ
КИСЛОРОДСОДЕРЖАЩИЕ
БЕСКИСЛОРОДНЫЕ
HNO3
HCl
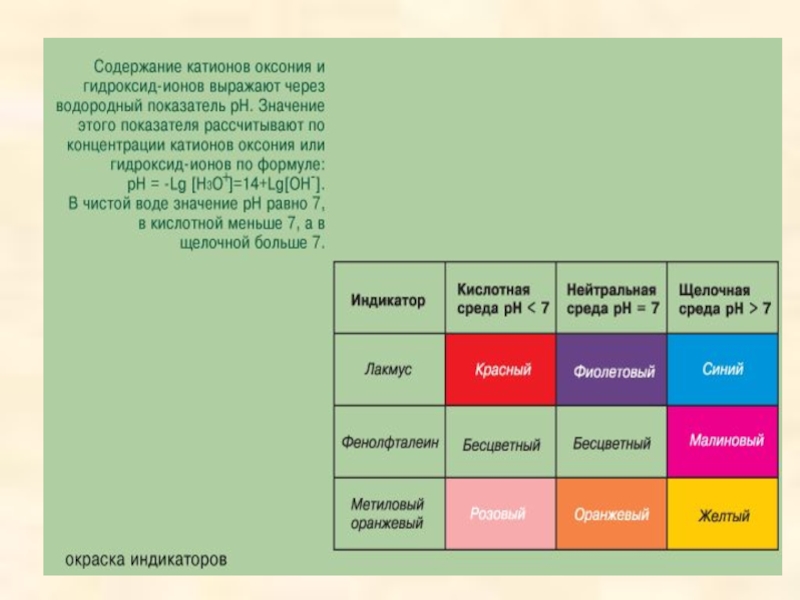
Слайд 26ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
ИЗМЕНЕНИЕ
ОКРАСКИ ИНДИКАТОРОВ
Лакмус –красный
Метилоранж –красный
УИБ – красный
Ф/ф -бесцветный
УИБ – красный
Ф/ф -бесцветный
Слайд 30Вытеснительный ряд металлов
Русский химик Н. Н. Бекетов исследовал
металлы и расположил их в вытеснительный ряд (ряд активности) в порядке уменьшения реакционной активности.
Металлы, стоящие слева от водорода, способны вытеснять его из кислот. А металлы, стоящие справа от водорода, не могут вытеснять его из кислот.
Металлы, стоящие слева от водорода, способны вытеснять его из кислот. А металлы, стоящие справа от водорода, не могут вытеснять его из кислот.
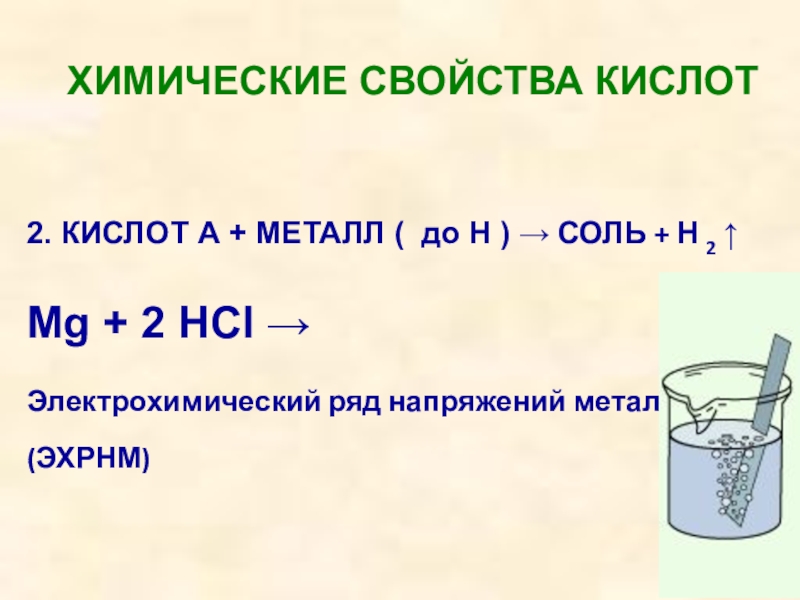
Слайд 31ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
2. КИСЛОТ А + МЕТАЛЛ ( до Н )
→ СОЛЬ + Н 2 ↑
Mg + 2 HCl →
Электрохимический ряд напряжений металлов
(ЭХРНМ)
Mg + 2 HCl →
Электрохимический ряд напряжений металлов
(ЭХРНМ)
Слайд 35ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
5. КИСЛОТА + СОЛЬ → НОВАЯ ↓↑ +
НОВАЯ ↓
КИСЛОТА СОЛЬ
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
ЗАПОМНИТЕ!!! H2SiO3 ↓
H2CO3 →H2O + CO2↑
H2SO3→ H2O + SO2↑
H2S↑
КИСЛОТА СОЛЬ
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
ЗАПОМНИТЕ!!! H2SiO3 ↓
H2CO3 →H2O + CO2↑
H2SO3→ H2O + SO2↑
H2S↑
Слайд 37Военное значение кислот.
Взрывчатые вещества: бризантные
а)повышенной мощности: гексоген, октоген, тетрил;
б) нормальной
мощности: пластит,
тротил;
в) пониженной мощности: аммоналы.
Дымный и бездымный порох.
тротил;
в) пониженной мощности: аммоналы.
Дымный и бездымный порох.
Слайд 38Применение кислот разнообразно –химическая и пищевая промышленность, лабораторные и медицинские исследования,
получение энергии (аккумуляторы).
Слайд 39Кислоты в вашей аптечке
В своей домашней аптечке вы также можете найти
некоторые кислоты, например:
Борная кислота H3BO3 – может быть использована в компрессах
благодаря своим антисептическим и противовоспалительным
действиям.
Ацетилсалициловая кислота (аспирин) – это жаропонижающее, противовоспалительное и обезболивающее средство.
Аскорбиновая кислота, или витамин С, – содержится в цитрусовых, боярышнике, шпинате, картофеле, сладком перце, томатах и некоторых других овощах. Недостаток аскорбиновой кислоты приводит к снижению сопротивляемости организма и в особенно тяжёлых случаях вызывает заболевание, называемое цингой.
Салициловая кислота – компонент смеси, состоящей из 2% салициловой кислоты, 28% воды и 70% спирта. Эта смесь обладает антисептическим действием и используется для дезинфекции.
Борная кислота H3BO3 – может быть использована в компрессах
благодаря своим антисептическим и противовоспалительным
действиям.
Ацетилсалициловая кислота (аспирин) – это жаропонижающее, противовоспалительное и обезболивающее средство.
Аскорбиновая кислота, или витамин С, – содержится в цитрусовых, боярышнике, шпинате, картофеле, сладком перце, томатах и некоторых других овощах. Недостаток аскорбиновой кислоты приводит к снижению сопротивляемости организма и в особенно тяжёлых случаях вызывает заболевание, называемое цингой.
Салициловая кислота – компонент смеси, состоящей из 2% салициловой кислоты, 28% воды и 70% спирта. Эта смесь обладает антисептическим действием и используется для дезинфекции.
Слайд 44Кислотные дожди
Загрязнение воздуха оксидами
неметаллов, особенно оксидами серы и азота, приводит к образованию кислотных дождей. Эти оксиды могут попадать в атмосферу из естественных источников – например, при извержении вулканов или при разложении органических веществ. Но кроме того, они образуются и при горении ископаемого горючего: угля, нефти и природного газа.
Слайд 49Кислоты попадают на землю вместе с дождем, снегом или градом (так
называемое «влажное осаждение»). Даже на большом расстоянии от источника загрязнения дождь имеет слабокислую реакцию.
Слайд 50Кислотная среда ускоряет рост грибков и бактерий, оказывая при этом вредное
влияние на растения. Некоторые растения способны преобразовывать оксид серы (IV) в другие соединения, которые скапливаются в кончиках листьев. Отравленные листья увядают и опадают.