- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты их классификация и получение (8 класс Издательство:Просвещение)
Содержание
- 1. Презентация по химии на тему Кислоты их классификация и получение (8 класс Издательство:Просвещение)
- 2. 5) Валентность хрома, входящего в состав соединения
- 3. 1) Ca(OH)2 Cu(OH)2
- 4. НАЙТИ СООТВЕТСТВИЕРеагенты1) KOH + H2SO4 → 2)
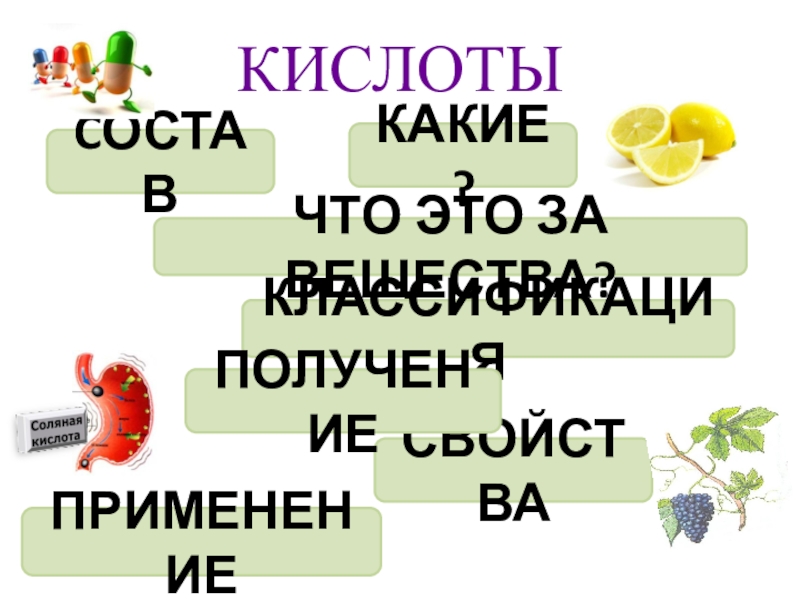
- 5. КИСЛОТЫCОСТАВ ЧТО ЭТО ЗА ВЕЩЕСТВА?СВОЙСТВАКЛАССИФИКАЦИЯКАКИЕ ?ПРИМЕНЕНИЕПОЛУЧЕНИЕ
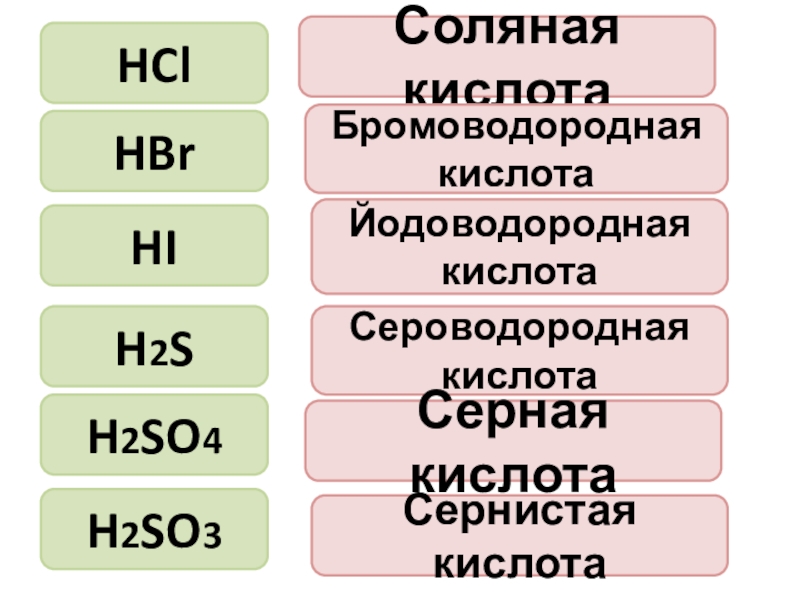
- 6. Соляная кислотаHClHBrHIH2SH2SO4H2SO3Бромоводородная кислотаЙодоводородная кислотаСероводородная кислотаСерная кислотаСернистая кислота
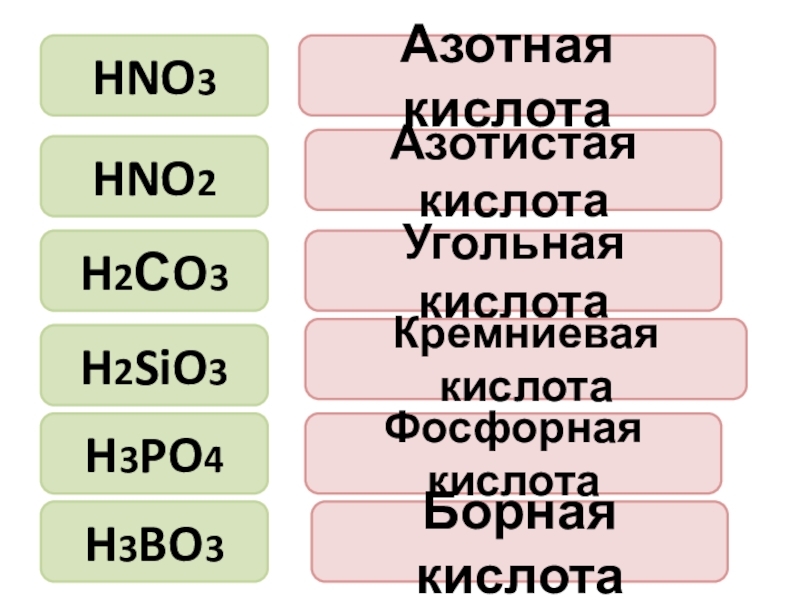
- 7. HNO3HNO2Азотная кислотаАзотистая кислотаУгольная кислотаКремниевая кислотаФосфорная кислотаБорная кислотаH2СO3H2SiO3H3PO4H3BO3
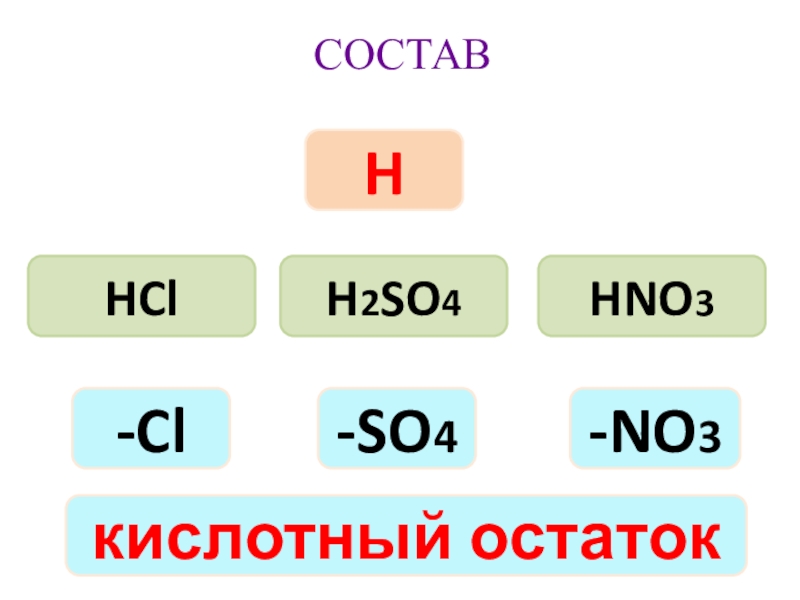
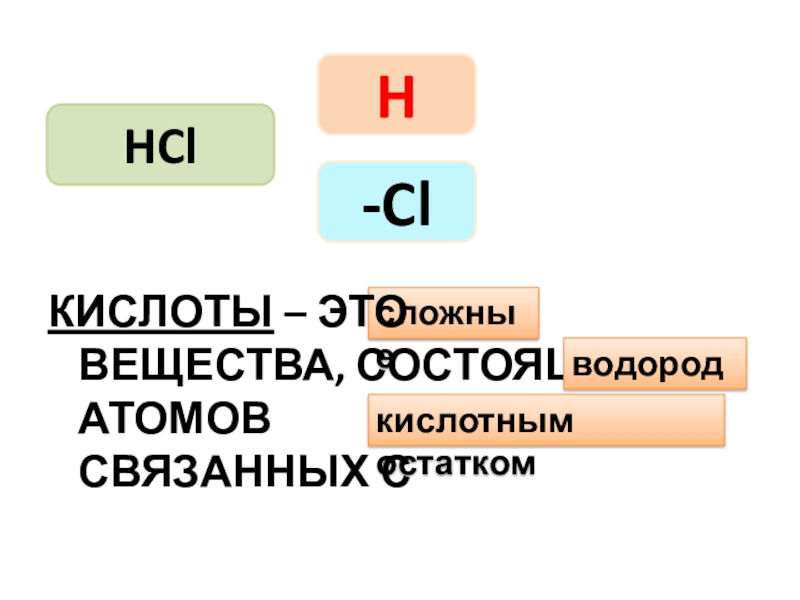
- 8. HClH2SO4HNO3H-Cl-NO3-SO4кислотный остатокСОСТАВ
- 9. HClH-Cl сложныеКИСЛОТЫ – ЭТО
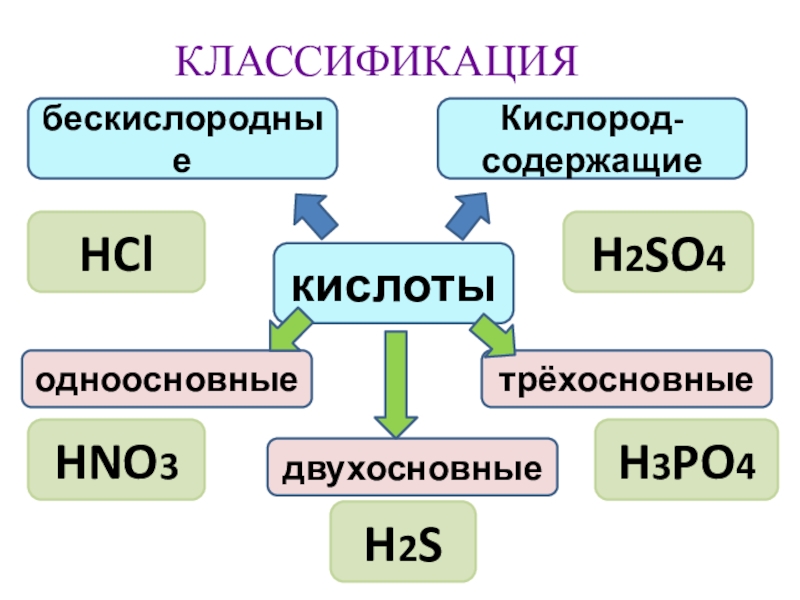
- 10. КЛАССИФИКАЦИЯкислотыбескислородныеКислород-содержащиеодноосновныедвухосновныетрёхосновныеHClH2SO4HNO3H2SH3PO4
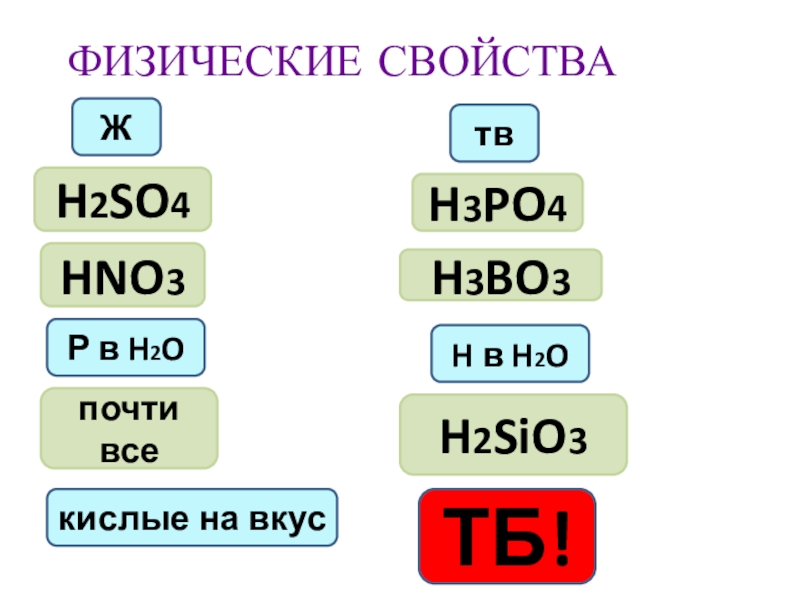
- 11. ФИЗИЧЕСКИЕ СВОЙСТВАЖтвH2SO4HNO3H3PO4H3BO3Р в H2O H в H2O H2SiO3почти всекислые на вкусТБ!
- 12. ТБ!Разъедают (разрушают): кожу, ткани, бумагу, древесину.При попадании
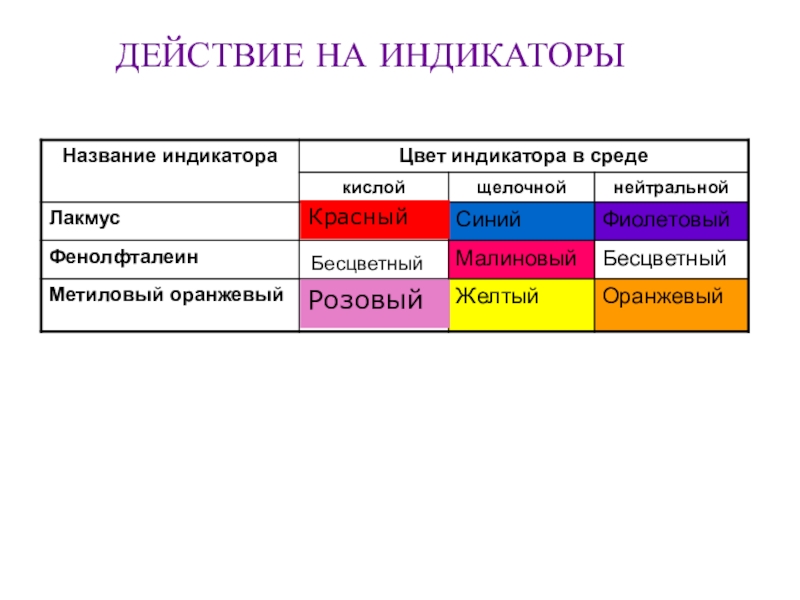
- 13. БесцветныйДЕЙСТВИЕ НА ИНДИКАТОРЫКрасныйРозовый
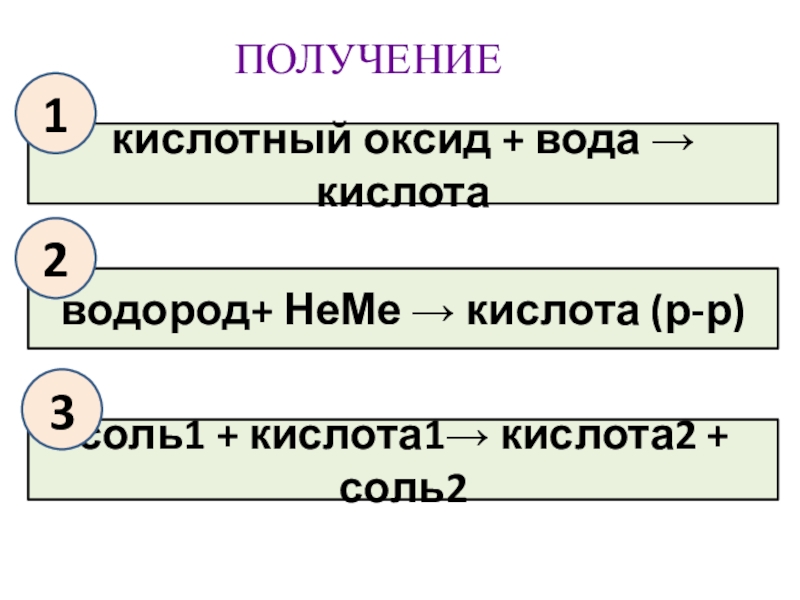
- 14. ПОЛУЧЕНИЕкислотный оксид + вода → кислотаводород+ НеМе → кислота (р-р)соль1 + кислота1→ кислота2 + соль2123
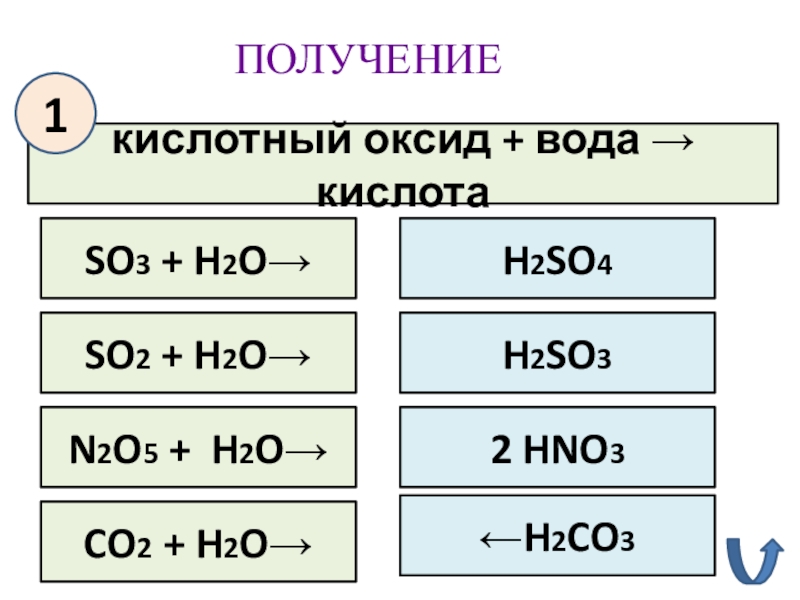
- 15. ПОЛУЧЕНИЕкислотный оксид + вода → кислотаSO3 + H2O→1SO2 + H2O→N2O5 + H2O→CO2 + H2O→H2SO4H2SO3 2 HNO3←H2CO3
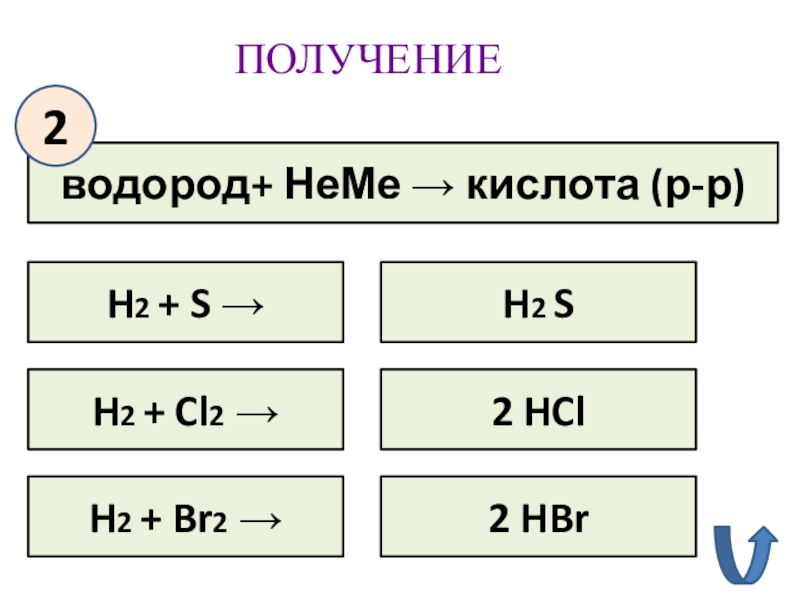
- 16. ПОЛУЧЕНИЕводород+ НеМе → кислота (р-р)2H2 + S
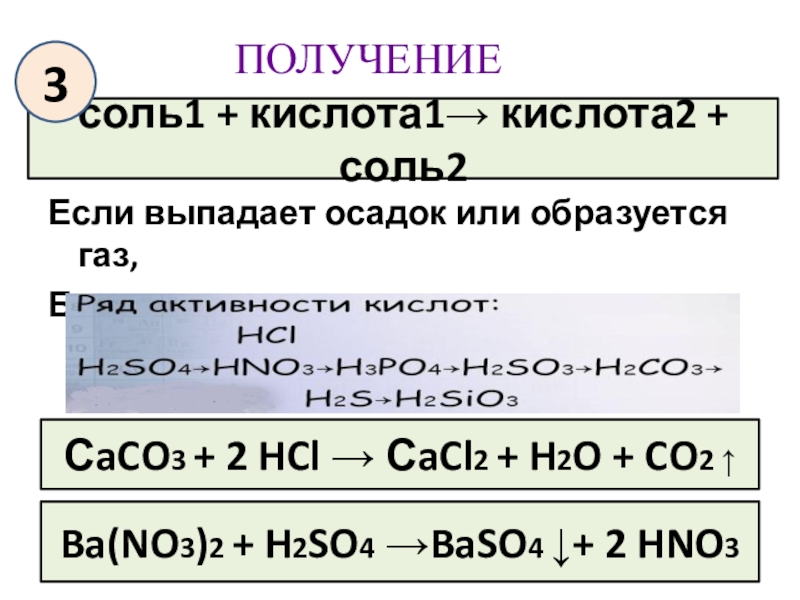
- 17. ПОЛУЧЕНИЕЕсли выпадает осадок или образуется газ,Более сильная
- 18. ● Что нового я узнал на уроке?●
Слайд 1ВЕРЮ НЕ ВЕРЮ
NaOH – это формула гидроксида натрия
2) Оксиду железа (II)
3) Все основания хорошо растворимы в воде
4) Щелочи взаимодействуют с растворами солей в том случае, если в результате образуется нерастворимое основание
Слайд 25) Валентность хрома, входящего в состав соединения Cr(OH)3
6) Cu(OH)2 это оксид меди (II)
7) Лакмус в щелочах малиновый
8) При взаимодействии оксида натрия с водой можно получить нерастворимое основание гидроксид натрия
Слайд 31) Ca(OH)2 Cu(OH)2
2) NaOH Ba(OH)2 Fe(OH)2
3) CuO K2O SO2
4) P2O5 SO3 Na2O
5) Al2O3 Zn(OH)2 ZnO
ТРЕТИЙ ЛИШНИЙ
Слайд 4НАЙТИ СООТВЕТСТВИЕ
Реагенты
1) KOH + H2SO4 →
2) Na2O + H2O →
3)
4) Fe(OH)3 + HCl →
5) KOH + CuCl2 →
Продукты реакции
А) FeO + H2O
Б) NaOH
В) Cu(OH)2 + KCl
Г) FeCl3 + H2O
Д) K2SO4 + H2O
Слайд 6Соляная кислота
HCl
HBr
HI
H2S
H2SO4
H2SO3
Бромоводородная кислота
Йодоводородная кислота
Сероводородная кислота
Серная кислота
Сернистая кислота
Слайд 7HNO3
HNO2
Азотная кислота
Азотистая кислота
Угольная кислота
Кремниевая кислота
Фосфорная кислота
Борная кислота
H2СO3
H2SiO3
H3PO4
H3BO3
Слайд 9HCl
H
-Cl
сложные
КИСЛОТЫ – ЭТО
водорода
кислотным остатком
Слайд 10КЛАССИФИКАЦИЯ
кислоты
бескислородные
Кислород-содержащие
одноосновные
двухосновные
трёхосновные
HCl
H2SO4
HNO3
H2S
H3PO4
Слайд 12ТБ!
Разъедают (разрушают):
кожу,
ткани,
бумагу,
древесину.
При попадании кислоты на
и обработать раствором 2% соды.
При разбавлении серной кислоты
приливают кислоту к воде, а не наоборот.
вода
H2SO4
Слайд 14ПОЛУЧЕНИЕ
кислотный оксид + вода → кислота
водород+ НеМе → кислота (р-р)
соль1 +
1
2
3
Слайд 15ПОЛУЧЕНИЕ
кислотный оксид + вода → кислота
SO3 + H2O→
1
SO2 + H2O→
N2O5 +
CO2 + H2O→
H2SO4
H2SO3
2 HNO3
←H2CO3
Слайд 17ПОЛУЧЕНИЕ
Если выпадает осадок или образуется газ,
Более сильная вытесняет менее сильную
соль1 +
3
СaCO3 + 2 HCl → СaCl2 + H2O + CO2 ↑
Ba(NO3)2 + H2SO4 →BaSO4 ↓+ 2 HNO3
Слайд 18● Что нового я узнал на уроке?
● Что понравилось?
● Что вызвало
● Где в жизни вы сможете применить полученные знания?