- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему КИСЛОТЫ (8 класс)
Содержание
- 1. Презентация по химии на тему КИСЛОТЫ (8 класс)
- 2. Из данных веществ выберите формулы оксидов и
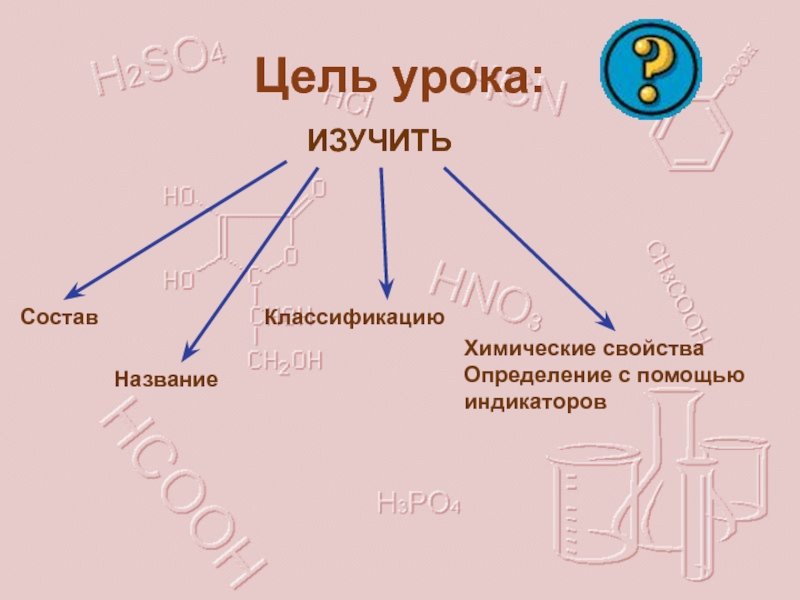
- 3. Цель урока:ИЗУЧИТЬСостав НазваниеКлассификациюХимические свойстваОпределение с помощью индикаторов
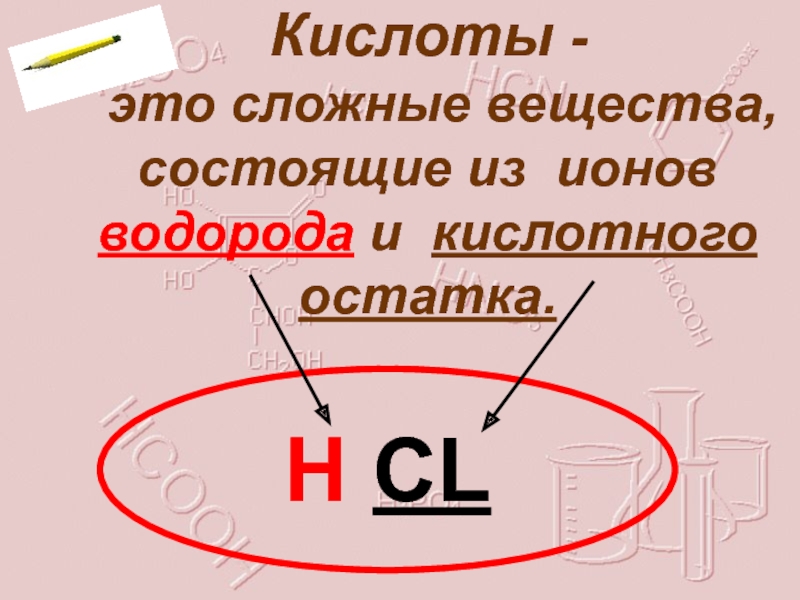
- 4. Кислоты - это сложные вещества, состоящие из ионов водорода и кислотного остатка.Н CL
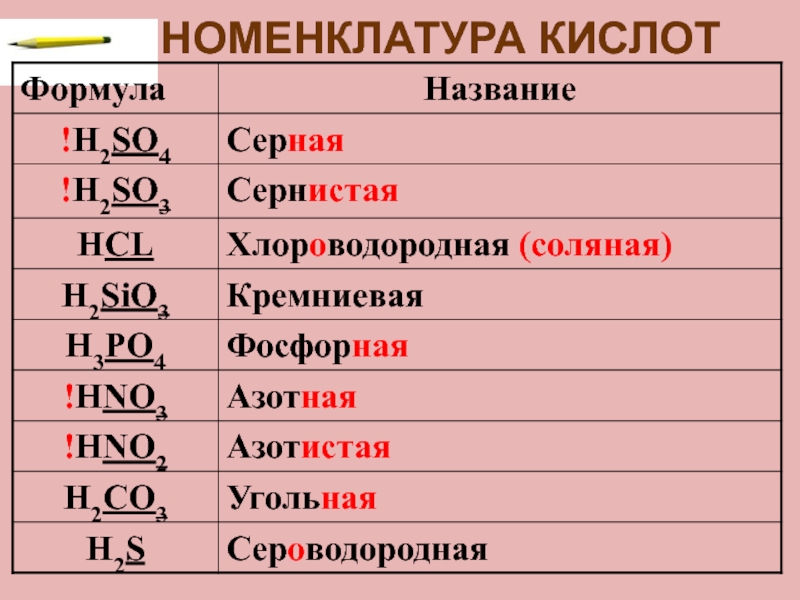
- 5. НОМЕНКЛАТУРА КИСЛОТ
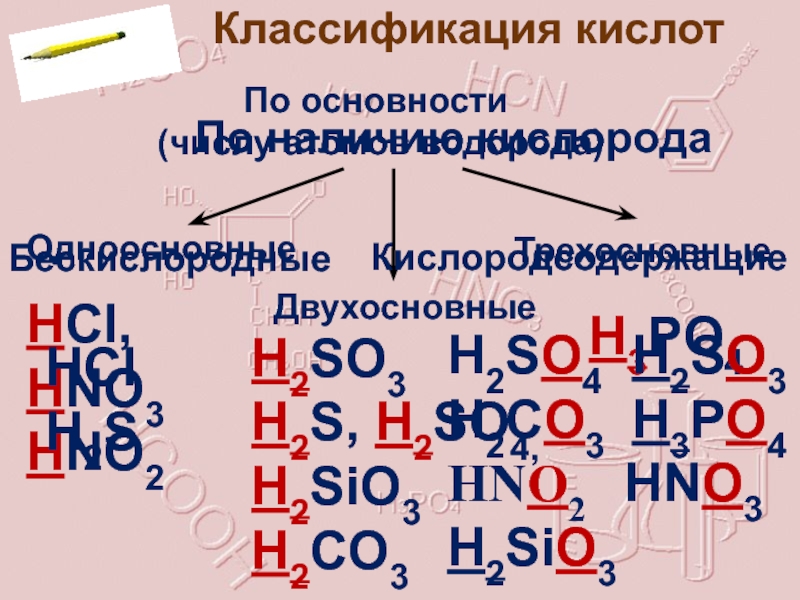
- 6. Классификация кислот По основности (числу атомов
- 7. Лабораторная работа №6Цель: изучить химические свойства кислот
- 8. Техника безопасностиПомните, что любое вещество может
- 9. Слайд 9
- 10. Лабораторный опыт 1« Взаимодействие кислот с щелочами
- 11. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ (РАБОТА В ГРУППАХ
- 12. ИНТЕРЕСНЫЕ ФАКТЫ О КИСЛОТЕ
- 13. Причины образования кислотных дождейКИСЛОТНЫЕ ОСАДКИ, дождь, снег
- 14. Кислотные осадки разрушают сооружения из мрамора и
- 15. Кислоты в нашей жизниЕсть в муравьях и
- 16. Какую пользу приносят кислоты?H2SO4
- 17. 1. Выберите бескислородные кислоты.2. Выберите двухосновные кислоты.3.
- 18. 1. HCl, H2S2. H2CO3 H2SiO3
- 19. «Ни один сосуд не вмещает больше своего
Слайд 2Из данных веществ выберите формулы оксидов и оснований
P2O5, Cu(OH)2, HCl HNO3,
H2SO4 HNO3 HCl
Слайд 3Цель урока:
ИЗУЧИТЬ
Состав
Название
Классификацию
Химические свойства
Определение с помощью индикаторов
Слайд 6Классификация кислот
По основности
(числу атомов водорода)
Одноосновные
Двухосновные
Трехосновные
H2SO3
H2S, H2SO4,
HCl, HNO3 HNO2
H3РO4
По наличию кислорода
Бескислородные
Кислородсодержащие
HCl
H2S
H2SO4 H2SO3
H2CO3 H3РO4
HNO2 HNO3
H2SiO3
Слайд 7Лабораторная работа №6
Цель: изучить химические свойства кислот
Оборудование: штатив с пробирками,
Тема: Химические свойства
кислот
Слайд 8 Техника безопасности
Помните, что любое вещество может быть
опасным, если
обращаться
Никогда не добавляйте воду в кислоту
Юные химики, помните:
кислоту добавляют в воду, а не наоборот
Слайд 10Лабораторный опыт 1
« Взаимодействие кислот с щелочами (основаниями)»
Порядок выполнения работы
В пробирку
К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете?
Составьте молекулярное и ионные уравнения проделанной реакции.
Лабораторный опыт 2
« Взаимодействие кислот с металлами»
Порядок выполнения работы
В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию.
Что вы наблюдаете?
Напишите молекулярное уравнение проделанной реакции.
Запишите вывод.
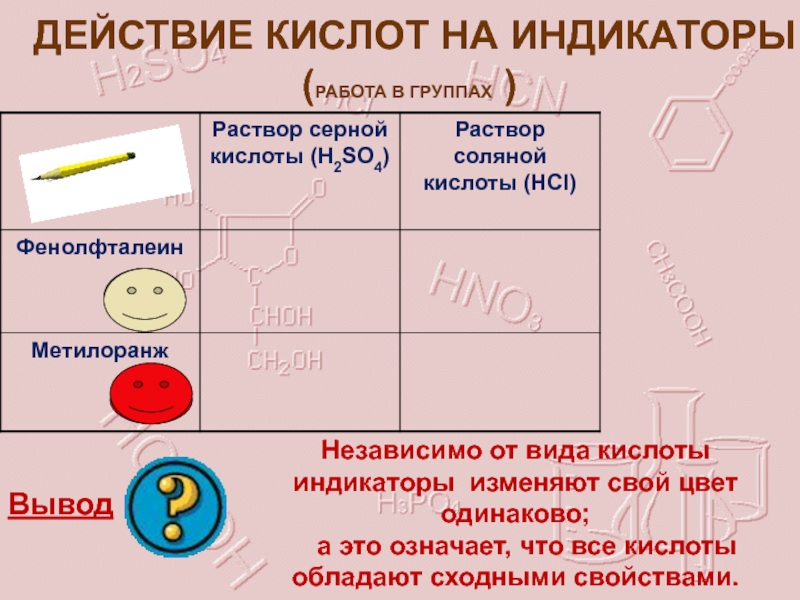
Слайд 11ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
(РАБОТА В ГРУППАХ )
Вывод
Независимо от вида кислоты индикаторы
а это означает, что все кислоты обладают сходными свойствами.
Слайд 13Причины образования кислотных дождей
КИСЛОТНЫЕ ОСАДКИ, дождь, снег или дождь со снегом,
Слайд 14Кислотные осадки разрушают сооружения из мрамора и известняка. Исторические памятники Греции
Такая же судьба грозит
и Тадж-Махалу –
шедевру индийской архитектуры
периода Великих моголов,
в Лондоне - Тауэру и
Вестминстерскому
аббатству…
Слайд 15Кислоты в нашей жизни
Есть в муравьях и крапиве невинная,
С пользой для
Жжет она кожу, но есть в ней и прок –
Ваш ревматизм она вылечит в срок.
Жуйте лимон, если горло болит
Сок чудотворный вас исцелит.
Думаю, чо не приукрашу,
Если хвалить буду я простоквашу.
Есть в ней молочная кисла –
Молодость ваша и красота.
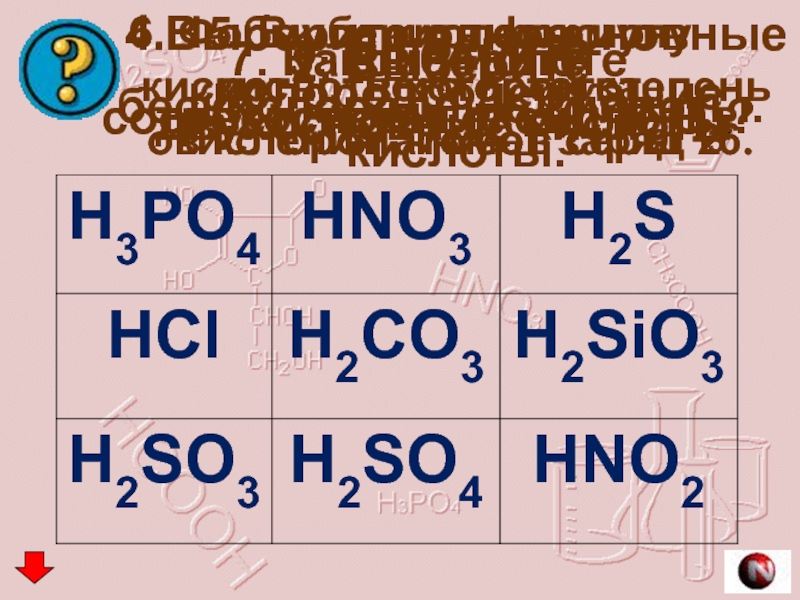
Слайд 171. Выберите бескислородные кислоты.
2. Выберите
двухосновные кислоты.
3. Выберите
трехосновные кислоты.
4.Выберите одноосновные
5. Выберите формулу кислоты, в которой степень окисления атомов серы +6.
6. Формула кислоты,ион кислотного остатка
в которой, имеет заряд 2-
7. Какой кислоте соответствует оксид N2O3?
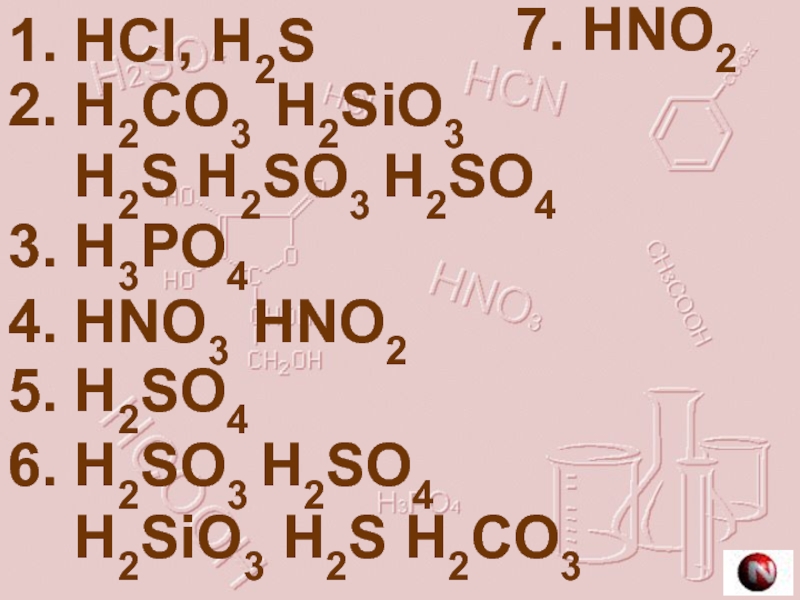
Слайд 181. HCl, H2S
2. H2CO3 H2SiO3
H2S H2SO3 H2SO4
3.
4. HNO3 HNO2
5. H2SO4
6. H2SO3 H2SO4
H2SiO3 H2S H2CO3
7. HNO2
Слайд 19«Ни один сосуд не вмещает больше своего объема, кроме сосуда знаний:
Домашнее задание:
§ 20,№ 1,3,4.