- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты ( 8 класс)
Содержание
- 1. Презентация по химии на тему Кислоты ( 8 класс)
- 2. Что нас объединяет?
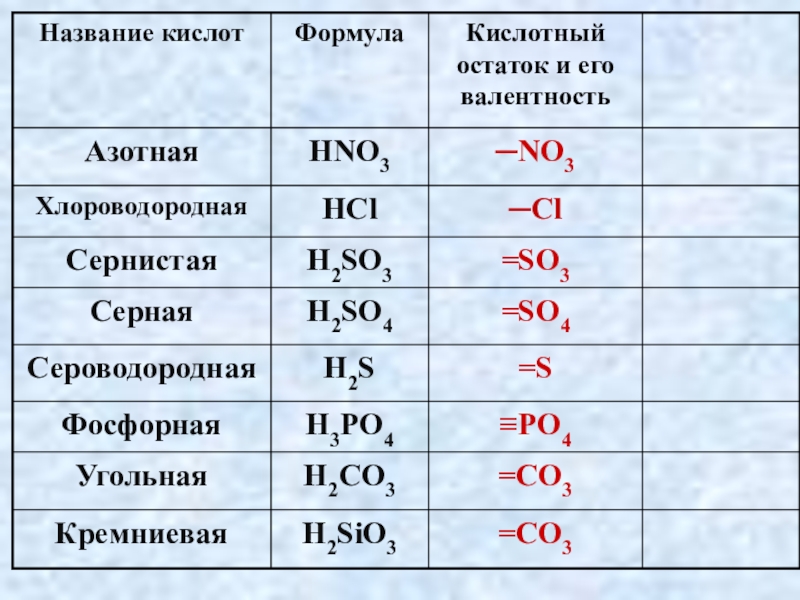
- 3. HNO3
- 4. Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка.
- 5. Формулы, каких веществ «лишние» и почему?1)HCI
- 6. КЛАССИФИКАЦИЯ КИСЛОТ. бескислородные
- 7. 2. По количеству атомов водорода.КИСЛОТЫодноосновныеHClHNO3двух-основныеH2SH2SO4трехосновныеH3PO4
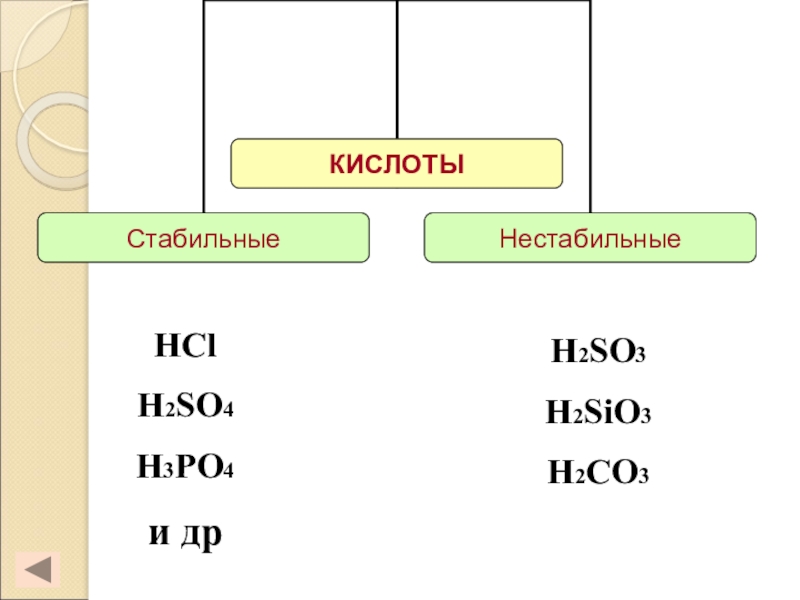
- 8. HClH2SO4H3PO4и дрH2SO3H2SiO3H2CO3
- 9. Слайд 9
- 10. Слайд 10
- 11. Физические свойства кислотПо агрегатному состоянию:Газообразные
- 12. Окраска растворов кислотНе имеют окраски: растворы HCl,
- 13. Кислый вкус лимону придает лимонная кислота, яблоку
- 14. Способы получения кислот:1. Кислотный оксид + Н2О
- 15. «Склеенное слово»Задание. Перед вами «текст», в котором
- 16. «Склеенное слово»Задание. Перед вами «текст», в котором
- 17. Алхимикам удалось получить серную кислоту
- 18. Самые важные кислотыHNO3 -азотная
- 19. Самые важные кислоты HCl – соляная (хлороводородная
- 20. Биологическая роль соляной кислотыСоляная кислота - сильный
- 21. Уксусная кислота - самая древняя . Упоминания
- 22. Кислоты в природе Кислоты постоянно присутствуют
- 23. Кислоты в организме человека Аскорбиновая, фолиевая, оротовая,
- 24. Кислоты нашей пищеНемало кислот в нашей пище.
- 25. Кислоты в животном мире Если вы
- 26. Кислоты в растительном мире Многие
- 27. Роль кислот в создании почвыСамая значительная функция
- 28. Польза кислот
- 29. Вред кислот
- 30. Домашнее задание §44 в. 3, Т стр. 152
Что нас объединяет?
Слайд 3HNO3
HNO2
H2SO4 H2SO3
H2S HCl
H2CO3 H2SiO3
H3PO4
Внимательно посмотрите на формулы кислот. Что в них общего?
Слайд 5Формулы, каких веществ «лишние» и почему?
1)HCI 2)CO2 3)NaOH
4) H2SO4
5) NaCI 6) H3PO4 7) HNO3 8) H2S
9) СаО 10) H2CO3 11)Н2О 12)Н2SiO4
5) NaCI 6) H3PO4 7) HNO3 8) H2S
9) СаО 10) H2CO3 11)Н2О 12)Н2SiO4
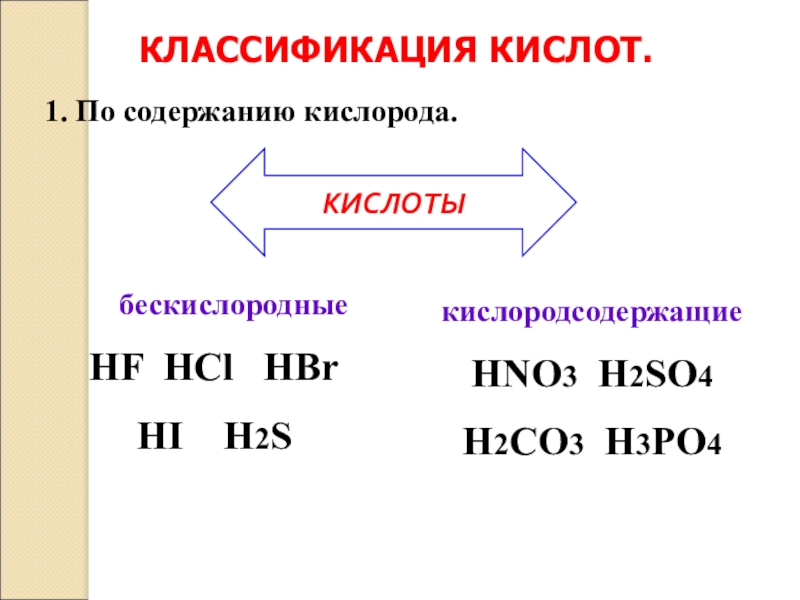
Слайд 6КЛАССИФИКАЦИЯ КИСЛОТ.
бескислородные
HF HCl
HBr
HI H2S
HI H2S
1. По содержанию кислорода.
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
КИСЛОТЫ
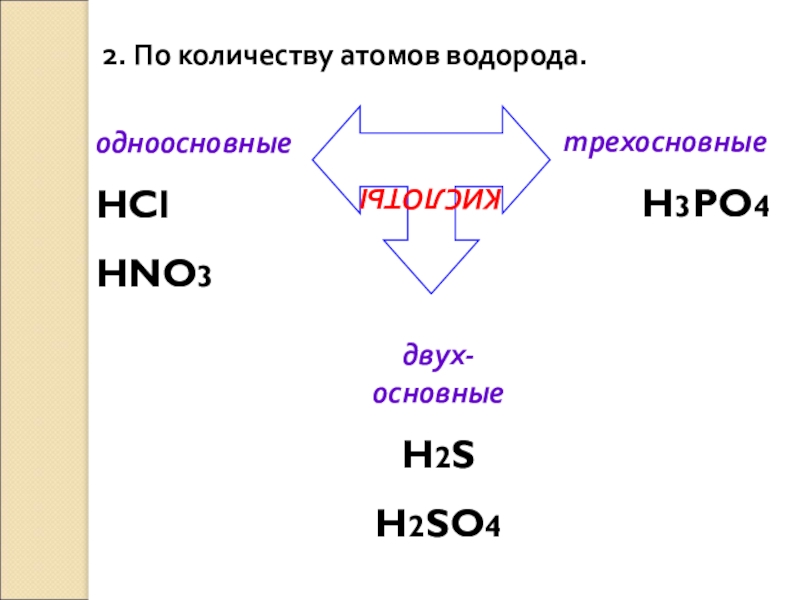
Слайд 72. По количеству атомов водорода.
КИСЛОТЫ
одноосновные
HCl
HNO3
двух-основные
H2S
H2SO4
трехосновные
H3PO4
Слайд 11Физические свойства кислот
По агрегатному
состоянию:
Газообразные (HCl, H2S)
Жидкие (HNO3, H2SO4)
Твердые
(H3PO4, H2SiO3)
Цвет кислот – ?
Запах – ?
Вкус – ?
Цвет кислот – ?
Запах – ?
Вкус – ?
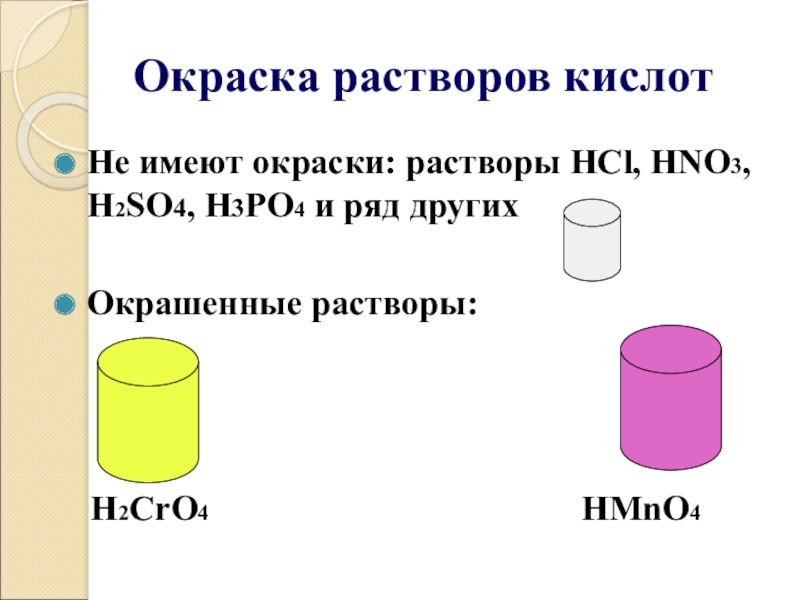
Слайд 12Окраска растворов кислот
Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и
ряд других
Окрашенные растворы:
H2CrO4 HMnO4
Окрашенные растворы:
H2CrO4 HMnO4
Слайд 13Кислый вкус лимону придает лимонная кислота, яблоку — яблочная кислота, скисшему
молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Слайд 14Способы получения кислот:
1. Кислотный оксид + Н2О → кислота
SO3 + H2O → H2SO4
2. Водород + НеМе → кислота
Н2 + Cl2 → 2 HCl
3. Кислота + соль → соль* + кислота*
t
2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑
2. Водород + НеМе → кислота
Н2 + Cl2 → 2 HCl
3. Кислота + соль → соль* + кислота*
t
2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑
Слайд 15«Склеенное слово»
Задание. Перед вами «текст», в котором «спрятаны» формулы кислот. Постарайтесь
как можно быстрее просмотреть этот текст, найти, подчеркнуть и назвать их.
H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2OH2SO4NH3Mg(OH)2Ba(OH)2 HNO2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3
H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2OH2SO4NH3Mg(OH)2Ba(OH)2 HNO2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3
Слайд 16«Склеенное слово»
Задание. Перед вами «текст», в котором «спрятаны» формулы кислот. Постарайтесь
как можно быстрее просмотреть этот текст, найти, подчеркнуть и назвать их.
H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2OH2SO4NH3Mg(OH)2Ba(OH)2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3
H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2OH2SO4NH3Mg(OH)2Ba(OH)2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3
Слайд 17 Алхимикам удалось получить серную кислоту еще в X веке
при прокаливании солей - сульфатов (купоросов).
Отсюда произошло историческое название серной кислоты – купоросное масло.
Отсюда произошло историческое название серной кислоты – купоросное масло.
Слайд 18 Самые важные кислоты
HNO3 -азотная кислота
Бесцветная летучая
жидкость с резким запахом, дымит на воздухе, сильный окислитель.
Её называют «царицей всех кислот»
Она необходима для взрывчатых веществ, для красителей, лаков, лекарств.
Фотопленка, целлулоид, полимеры, удобрения – вот ее применение.
Её называют «царицей всех кислот»
Она необходима для взрывчатых веществ, для красителей, лаков, лекарств.
Фотопленка, целлулоид, полимеры, удобрения – вот ее применение.
Слайд 19Самые важные кислоты
HCl – соляная (хлороводородная кислота)
Соляная кислота входит
в состав желудочного сока
В желудке она активирует фермент пепсиноген, разлагающий чужие белки, попавшие с пищей, на составные части.
В желудке она активирует фермент пепсиноген, разлагающий чужие белки, попавшие с пищей, на составные части.
Слайд 20Биологическая роль соляной кислоты
Соляная кислота - сильный бактерицид. Большинство бактерий, попавших
в желудок с пищей, погибают под ее действием. Так что врачи не случайно тревожатся, если у пациента пониженная кислотность желудочного сока.
Если воспалительные процессы в желудке больного человека проходят на фоне повышенной кислотности, раковых поражений, как правило, не бывает.
Интересно, что у птиц, питающихся падалью, кислотность желудочного сока огромна. И это помогает им расправляться с теми миллиардами микробов, которые буквально кишат в падали.
Если воспалительные процессы в желудке больного человека проходят на фоне повышенной кислотности, раковых поражений, как правило, не бывает.
Интересно, что у птиц, питающихся падалью, кислотность желудочного сока огромна. И это помогает им расправляться с теми миллиардами микробов, которые буквально кишат в падали.
Слайд 21Уксусная кислота - самая древняя . Упоминания о ней содержатся в
древнейших рукописях. Впервые она получена из виноградного сока.
Из всех кислот она конечно, прима
Присутствует везде и зримо и не зримо.
В животных и в растеньях есть она
Всем известный “аспирин” - он как добрый господин, жар больного понижает и здоровье возвращает!”
Из всех кислот она конечно, прима
Присутствует везде и зримо и не зримо.
В животных и в растеньях есть она
Всем известный “аспирин” - он как добрый господин, жар больного понижает и здоровье возвращает!”
Самые важные кислоты
Слайд 22 Кислоты в природе
Кислоты постоянно присутствуют вокруг нас. Например, дождевая
вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в дождевой воде оказывается еще и азотная кислота. Извержения вулканов и сгорание топлива способствуют появлению в дождевой и снеговой воде серной кислоты.
Слайд 23Кислоты в организме человека
Аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая и другие
кислоты являются витаминами.
Аминокислоты, соединяясь друг с другом в самых причудливых сочетаниях, образуют великое множество белков. А из них, в свою очередь, строятся почти все ткани нашего организма.
Фосфорная кислота в виде своих кальциевых, магниевых и стронциевых солей – основной «конструкционный материал» костей, зубов, ногтей.
Аминокислоты, соединяясь друг с другом в самых причудливых сочетаниях, образуют великое множество белков. А из них, в свою очередь, строятся почти все ткани нашего организма.
Фосфорная кислота в виде своих кальциевых, магниевых и стронциевых солей – основной «конструкционный материал» костей, зубов, ногтей.
Слайд 24Кислоты нашей пище
Немало кислот в нашей пище. Фрукты, овощи, молочные продукты,
лекарства поставляют целый букет кислот: яблочную, щавелевую, лимонную, миндальную, молочную, масляную, кофейную, уксусную, аскорбиновую и другие. Даже синильная кислота (сильнейший яд) знакома каждому, кто лакомился ядрышками косточек слив, вишен или миндаля. Количество ее мизерно, но ощутить вкус и запах можно. Так что ядрышками увлекаться не следует, особенно если они взяты из недозрелых плодов или прошлогодних компотов.
Слайд 25 Кислоты в животном мире
Если вы присядете вблизи муравейника, то
надолго запомните жгучие укусы его обитателей. Муравей впрыскивает в ранку от укусу яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы.
Тропический паук стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
Плоские тысяченожки используют пары синильной кислоты.
Некоторые жуки выстреливают струйкой разбавленной серной кислоты.
Тропический паук стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
Плоские тысяченожки используют пары синильной кислоты.
Некоторые жуки выстреливают струйкой разбавленной серной кислоты.
Слайд 26 Кислоты в растительном мире
Многие растения содержат кислоты и
используют их как «Химическое оружие»
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
Ботаникам известно более 800 видов растений, вырабатывающих синильную кислоту.
Многие растения выделяют кислоты, угнетая ими другие виды растений.
В волосках крапивы содержится жгучая муравьиная кислота
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
Ботаникам известно более 800 видов растений, вырабатывающих синильную кислоту.
Многие растения выделяют кислоты, угнетая ими другие виды растений.
В волосках крапивы содержится жгучая муравьиная кислота
Слайд 27Роль кислот в создании почвы
Самая значительная функция кислот в природе состоит
в разрушении горных пород и создании почвы. Ведь было время, когда вся земная суша представляла собой голые камни. Сотни миллионов лет потребовалось на то, чтобы солнце, ветер и слабый раствор кислот – дождевая вода – разрушили камни на песчинки. Появившиеся затем растения тут же подключились к процессу разрушения горных пород и созданию почвы.