- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты
Содержание
- 1. Презентация по химии на тему Кислоты
- 2. КИСЛОТЫ– ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, молекулы которых
- 3. КЛАССИФИКАЦИЯ КИСЛОТбескислородные
- 4. 2. По количеству атомов водородаКИСЛОТЫодноосновныеHClHNO3двухосновныеH2SH2SO4трехосновныеH3PO4
- 5. Химические свойства кислот 2NaOH + H2SO4
- 6. Химические свойства кислот 3. Взаимодействие с оксидами:H2SO4
- 7. Химические свойства кислот4. Взаимодействие с солями:Сильные кислоты
- 8. Химические свойства кислот5. Взаимодействие с металлами:Zn +
- 9. Способы получения кислотБЕСКИСЛОРОДНЫХКИСЛОРОДСОДЕРЖАЩИХВзаимодействие водорода с неметалломН2+Сl2=2НСlобщий способ
- 10. Соляная кислота, находящаяся в желудке, помогает переваривать
- 11. КИСЛОТЫ
- 12. КИСЛОТЫ ПРИМЕНЯЮТСЯ В КУЛИНАРИИ Уксусная кислота Лимонная кислота
Слайд 1кислоты
МАОУ «Гимназия №1г.Благовещенск»
Учитель химии Гасанова С.П.
ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Слайд 2 КИСЛОТЫ– ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, молекулы которых состоят из атомов водорода,
NО3
Н
Кислотный
остаток
Na
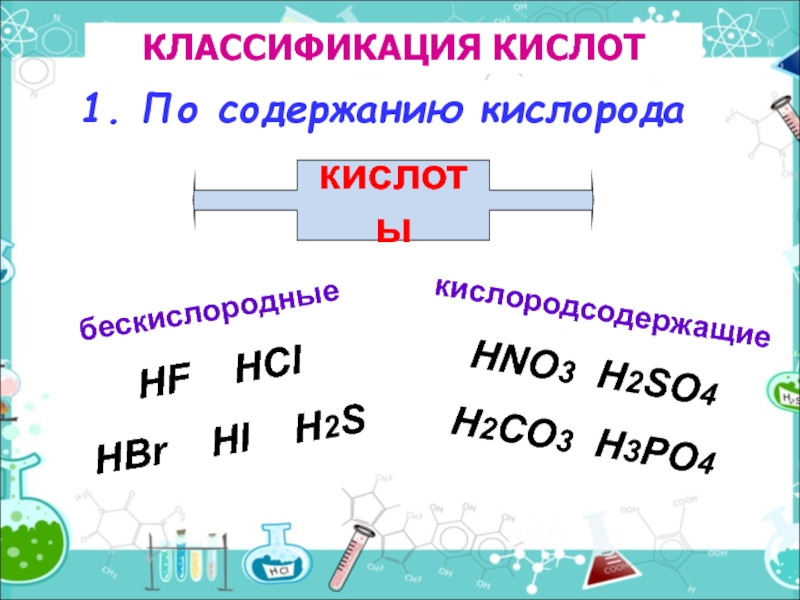
Слайд 3КЛАССИФИКАЦИЯ КИСЛОТ
бескислородные
HF
HBr HI H2S
1. По содержанию кислорода
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
кислоты
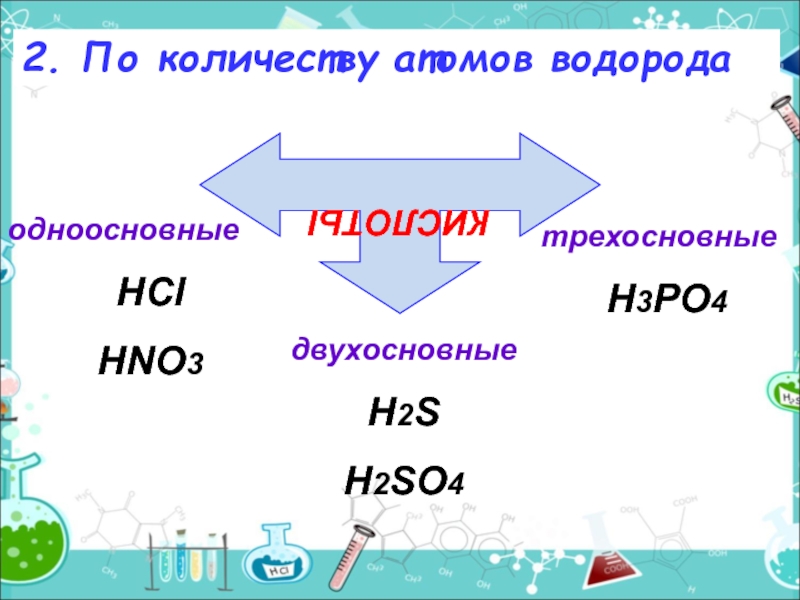
Слайд 42. По количеству атомов водорода
КИСЛОТЫ
одноосновные
HCl
HNO3
двухосновные
H2S
H2SO4
трехосновные
H3PO4
Слайд 5Химические свойства кислот
2NaOH + H2SO4 → Na2SO4 + 2H2O
Реакция нейтрализации, реакция обмена
2. Взаимодействие с основаниями
Действие на индикаторы
Лакмус +кислот а→ в-во красного цвета
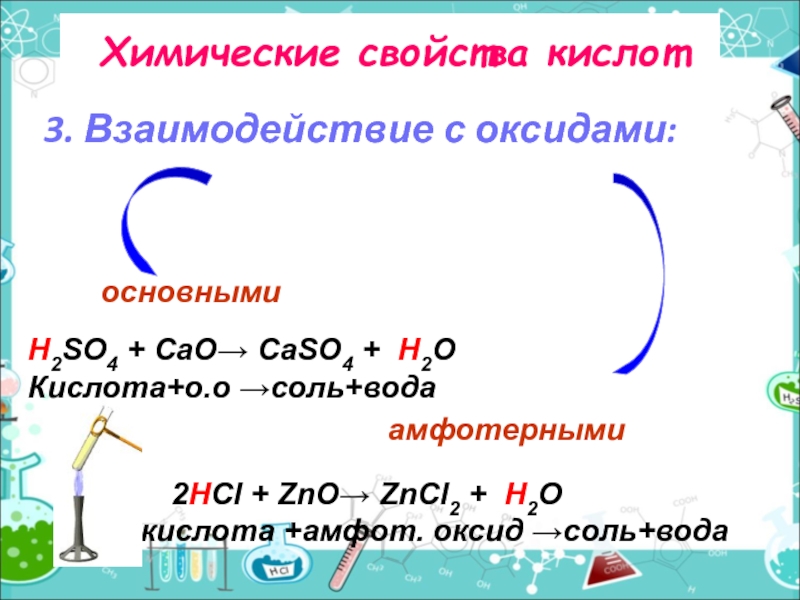
Слайд 6Химические свойства кислот
3. Взаимодействие с оксидами:
H2SO4 + CаO→ CаSO4 +
Кислота+о.о →соль+вода
2HCl + ZnO→ ZnCl2 + H2O
Ккислота +амфот. оксид →соль+вода
основными
амфотерными
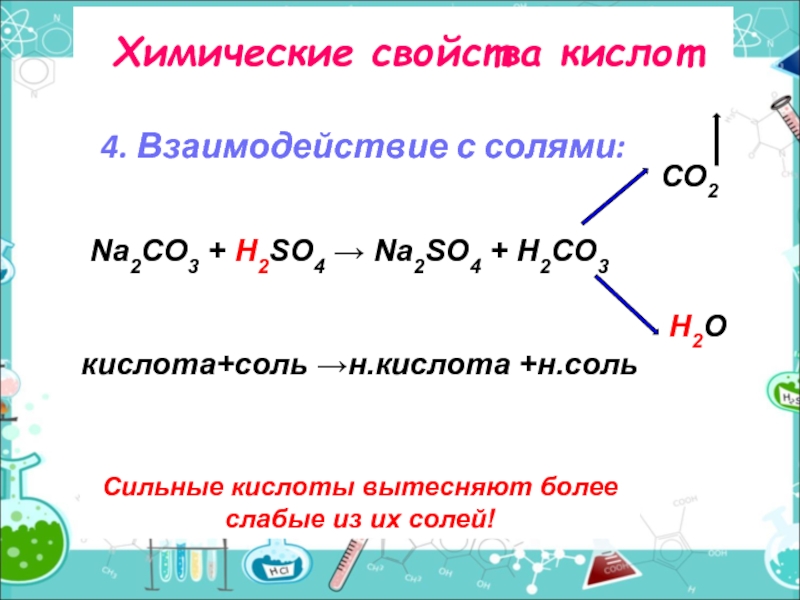
Слайд 7Химические свойства кислот
4. Взаимодействие с солями:
Сильные кислоты вытесняют более слабые из
CO2
Na2CO3 + H2SO4 → Na2SO4 + H2CO3
H2O
кислота+соль →н.кислота +н.соль
Слайд 8Химические свойства кислот
5. Взаимодействие с металлами:
Zn + 2HCl → ZnCl2 +
Cu + HCl →
Ме (до Н2) +кислота→соль +водород
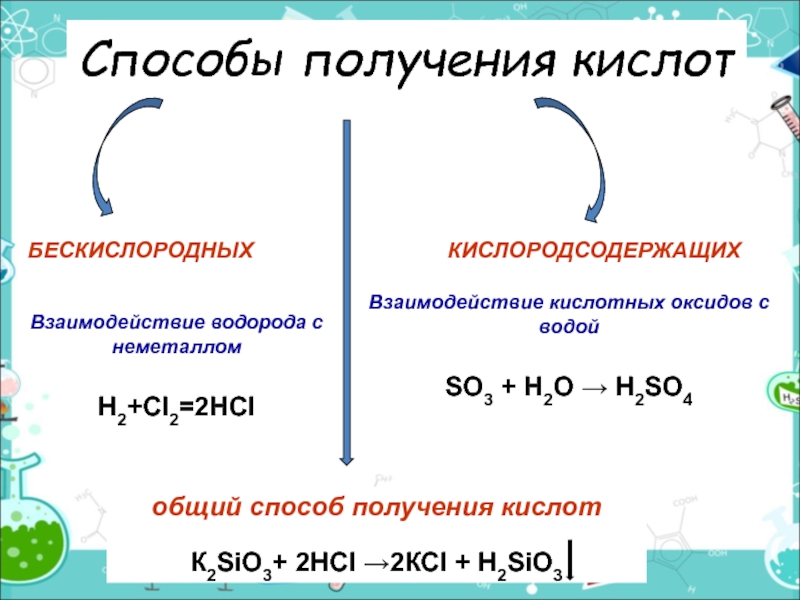
Слайд 9Способы получения кислот
БЕСКИСЛОРОДНЫХ
КИСЛОРОДСОДЕРЖАЩИХ
Взаимодействие водорода с неметаллом
Н2+Сl2=2НСl
общий способ получения кислот
К2SiO3+ 2НСl →2КСl
Взаимодействие кислотных оксидов с водой
SO3 + H2O → H2SO4
Слайд 10Соляная кислота, находящаяся в желудке, помогает переваривать пищу
Молочная кислота образуется в
КИСЛОТЫ СОДЕРЖАТСЯ В ЖИВЫХ ОРГАНИЗМАХ