- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислород (9 класс)
Содержание
- 1. Презентация по химии на тему Кислород (9 класс)
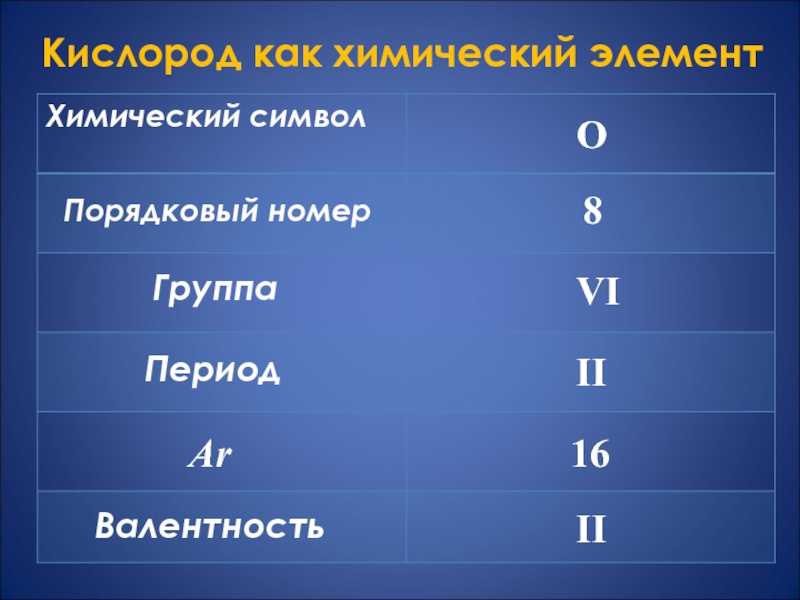
- 2. Кислород как химический элементХимический символГруппаПериодПорядковый номерArВалентностьОVIII 816II
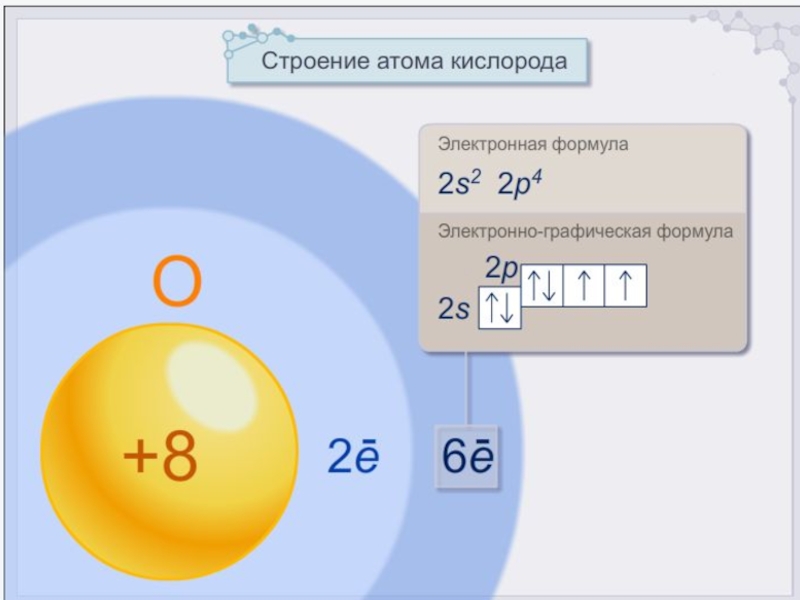
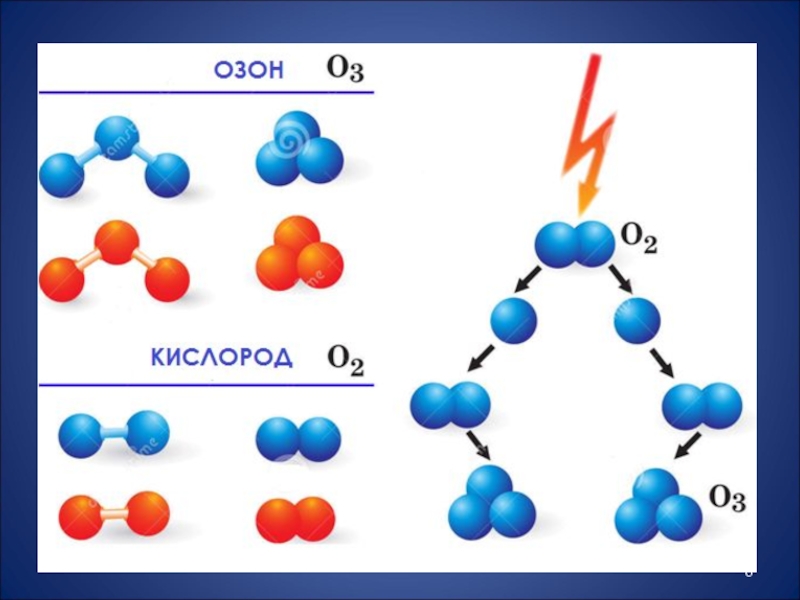
- 3. Слайд 3
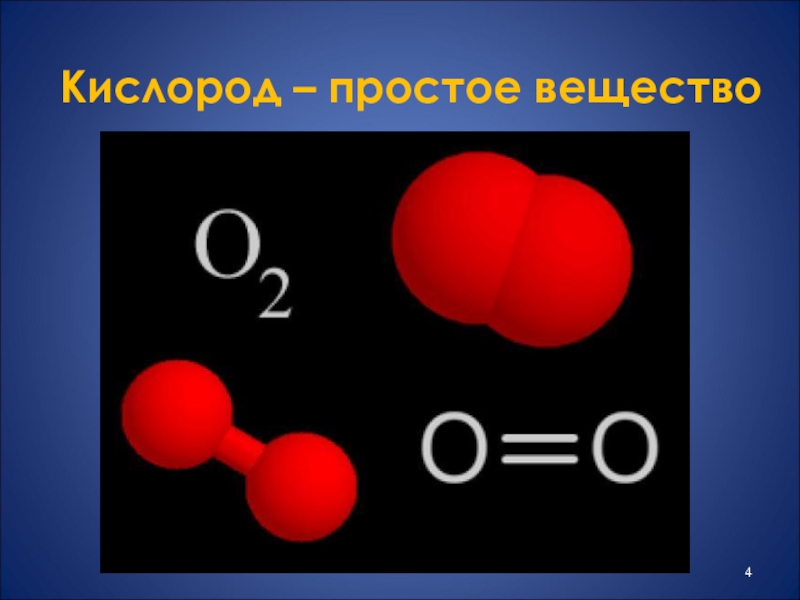
- 4. Кислород – простое вещество
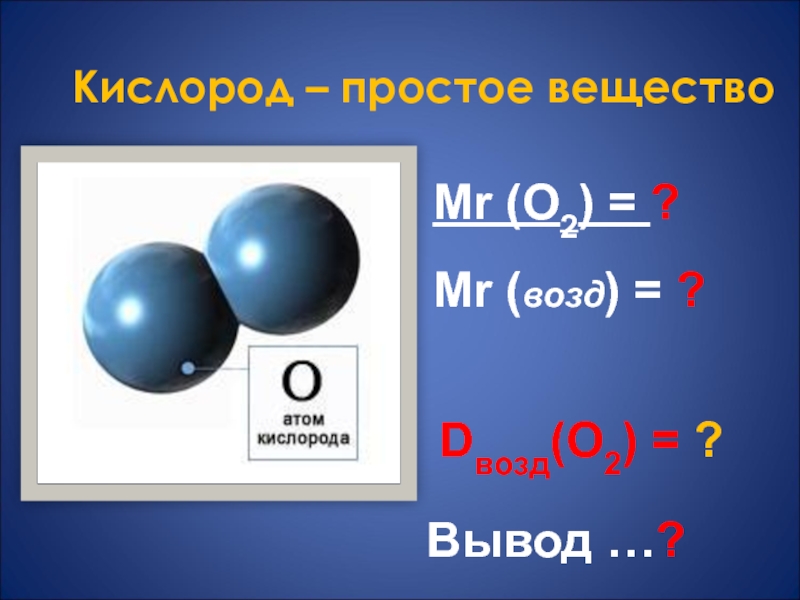
- 5. Кислород – простое веществоMr (O2) = ?Mr (возд) = ?Dвозд(O2) = ?Вывод …?
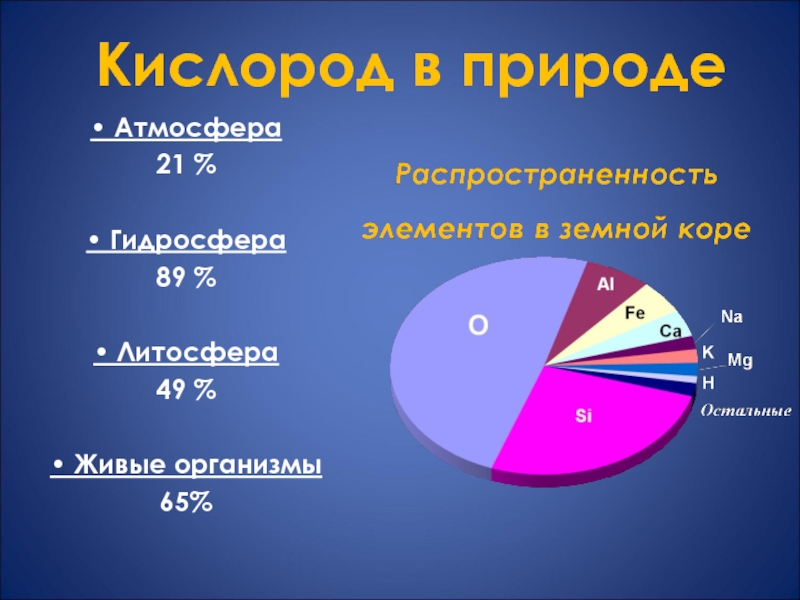
- 6. Слайд 6
- 7. • Атмосфера 21 %• Гидросфера
- 8. Физические свойства О2ЦГЗТв tпл= - 219оС Жtкип= - 183оС+ Н2Омало
- 9. Из жидкого воздухаПолучение кислорода (в промышленности)
- 10. В лаборатории кислород получают из кислородсодержащих веществ
- 11. б) разложение хлората калия2KClO3 =
- 12. Реакции взаимодействия веществ с кислородом называются
- 13. Обратите внимание как энергично сгорают в кислороде
- 14. Кислород взаимодействует почти со всеми простыми веществами,
- 15. 2. С неметалламиS + O2 → SO2,4P + 5O2 → 2P2O5,C + O2 → CO2.
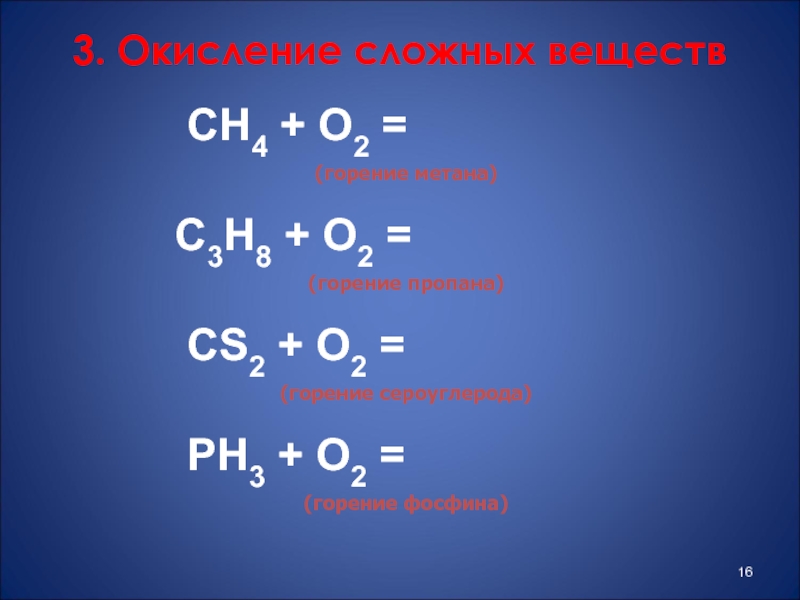
- 16. 3. Окисление сложных веществ
- 17. СН4 + 2О2 = СО2 + 2Н2О
- 18. Применение кислорода
- 19. Домашнее задание:§22, РТ: с. 122 – зад.
Слайд 2Кислород как химический элемент
Химический символ
Группа
Период
Порядковый номер
Ar
Валентность
О
VI
II
8
16
II
Слайд 10В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при
а) разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2↑
Слайд 11б) разложение хлората калия
2KClO3 = 2KCl +
в) разложение пероксида водорода
2H2O2 = 2H2O + O2↑
г) электролиз воды
2H2O = 2H2↑ + O2↑
Kt = MnO2
Kt = MnO2
видео
Слайд 12Реакции взаимодействия веществ с кислородом называются реакциями окисления Горение – процесс окисления,
Химические свойства
Слайд 13Обратите внимание как энергично сгорают в кислороде
уголь,
сера,
железо,
медь
Все реакции окисления –
Исключение:
N2 + O2 = 2NO – Q
Реакция протекает при температуре выше 1200оС или электрическом разряде
видео
Слайд 14Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов,
1. Энергично реагирует с металлами:
щелочными, образуя оксид с литием Li2O и пероксиды и надпероксиды (M2O2, MO2) с другими щелочными металлами
4Li + O2 → Li2O,
2Na + O2 → Na2O2;
с железом, образуя железную окалину
3Fe + 2O2 → Fe3O4;
с алюминием
4Al + 3O2 → 2Al2O3.
Слайд 163. Окисление сложных веществ
СН4 + О2
(горение метана)
С3Н8 + О2 =
(горение пропана)
СS2 + О2 =
(горение сероуглерода)
PН3 + О2 =
(горение фосфина)
Слайд 17СН4 + 2О2 = СО2 + 2Н2О
(горение метана)
С3Н8 + 5О2
(горение пропана)
СS2 + 3О2 = СО2 + 2SO2
(горение сероуглерода)
2PН3 + 4О2 = P2О5 + 3Н2О
(горение фосфина)
3. Окисление сложных веществ
Слайд 19Домашнее задание:
§22,
РТ: с. 122 – зад. 4,
с. 125 – зад.
с. 126 – зад. 6
По желанию – доклады на темы
«История открытия кислорода»
«Получение перегонкой воздуха и применение кислорода»