- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислдоты 8 класс
Содержание
- 1. Презентация по химии на тему Кислдоты 8 класс
- 2. Цель презентацииПознакомить учащихся с классификацией и химическими свойствами кислот.
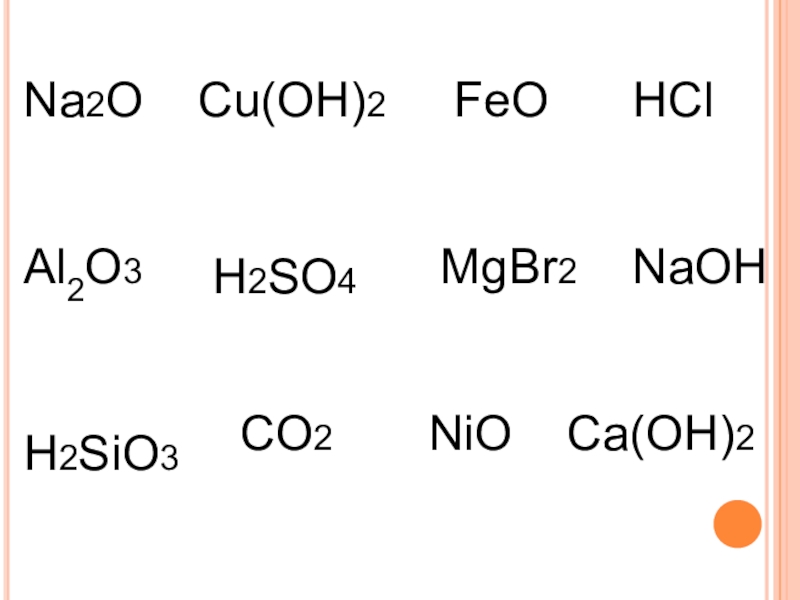
- 3. Na2O Cu(OH)2 FeOAl2О3
- 4. КИСЛОТЫТема урока
- 5. Цель урока: познакомиться с классификациями и общими химическими свойствами кислот.
- 6. ПЛАН УРОКАСпособы полученияХимические свойства кислот
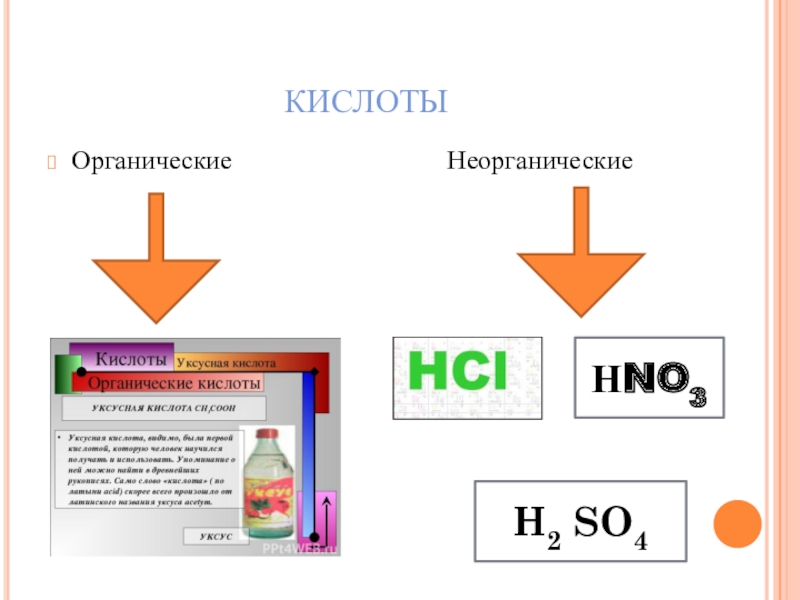
- 7. КИСЛОТЫОрганические
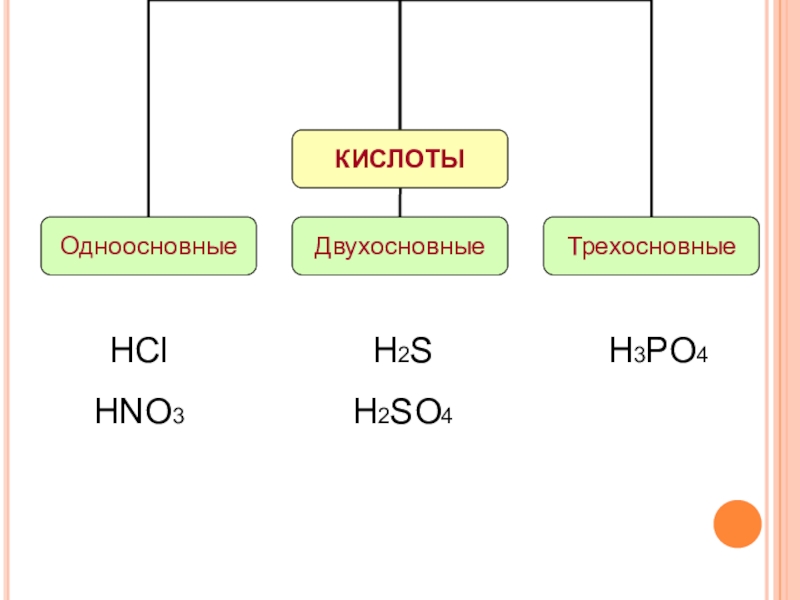
- 8. HFHClHBrHIH2SHNO3H2SO4H2SiO3H2CO3H3PO4
- 9. HClHNO3H3PO4H2SH2SO4
- 10. H2SiO3HNO3H2SO4H2SH2CO3Правила по технике безопасности
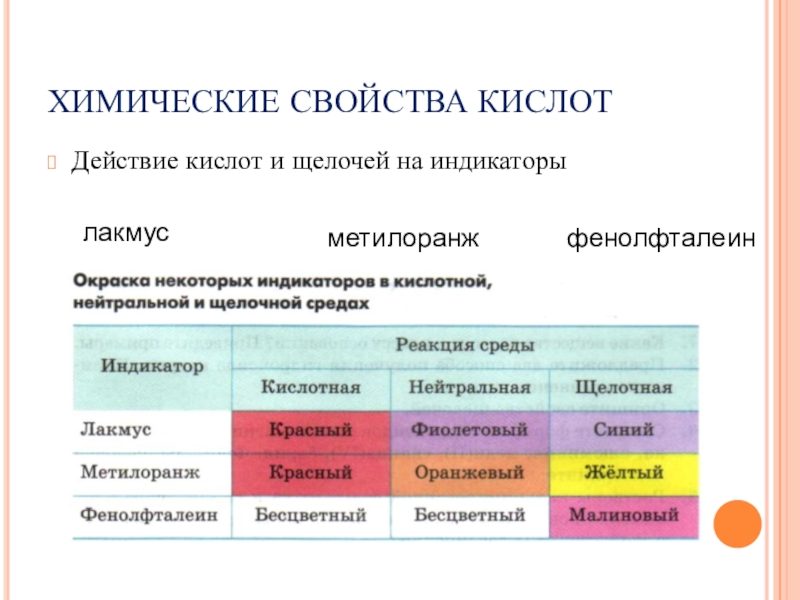
- 11. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТДействие кислот и щелочей на индикаторылакмусметилоранжфенолфталеин
- 12. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ SO2 + H2O = H2SO3H2
- 13. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ Получение хлороводородной кислотыСиликат натрияСоляная кислота=+NaCl
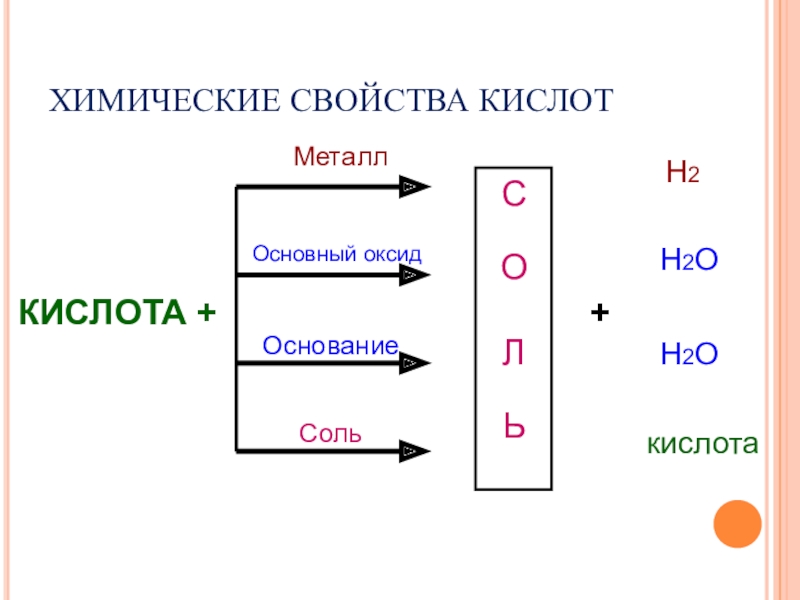
- 14. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ КИСЛОТА +СОЛЬМеталлОсновный оксидОснованиеСоль+Н2Н2ОН2Окислота
- 15. Химические свойства кислот Кислота + основный оксид
- 16. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТКислота + металл = соль
- 17. Допишите уравнения возможных реакций:Решение задач2HCl + Mg
- 18. Решение задач Соляная кислота реагирует с Hg?
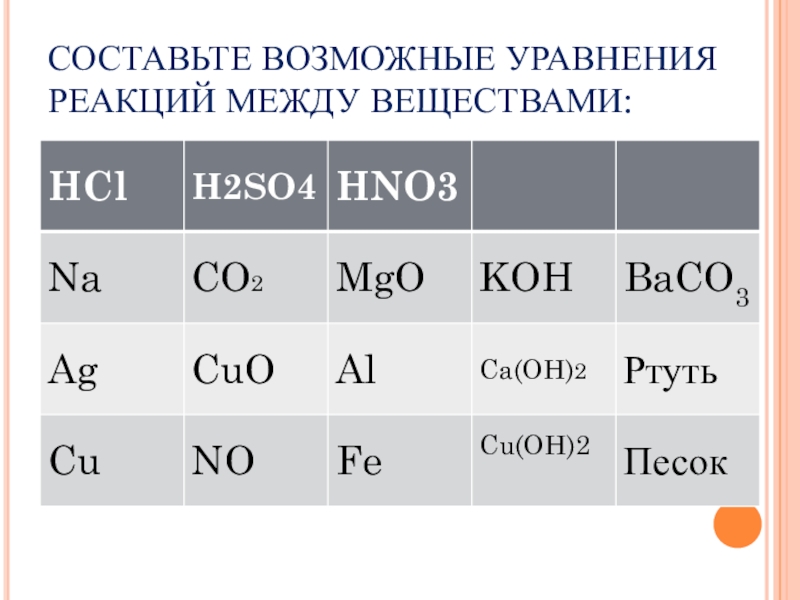
- 19. СОСТАВЬТЕ ВОЗМОЖНЫЕ УРАВНЕНИЯ РЕАКЦИЙ МЕЖДУ ВЕЩЕСТВАМИ:
- 20. ДОМАШНЕЕ ЗАДАНИЕПараграф 46.2 стр. 193-186Задание 4,5Выполнить тест №1
- 21. ИНФОРМАЦИОННЫЕ ИСТОЧНИКИ: Габриелян О.С. и др. Контрольные
Слайд 11ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Действие кислот и щелочей на индикаторы
лакмус
метилоранж
фенолфталеин
Слайд 12СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ
SO2 + H2O = H2SO3
H2 + Cl2 = 2HCl
Реакции
кислотный оксид
Кислота
Водород
+
Вода
=
Хлор
Кислота
=
+
HCl + CaCO3 =
CaCl2 + H2O + CO2
2
HCl + Na2S =
NaCl + H2S
2
2
Слайд 13СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ
Получение хлороводородной кислоты
Силикат натрия
Соляная кислота
=
+
NaCl + H2SO4 =
Na2SiO3+ HCl=
H2SiO3 +NaCl
2
2
Слайд 15Химические свойства кислот
Кислота + основный оксид = соль + вода
Взаимодействие
ZnO + HCl=
ZnCl2 + H2O
2
Слайд 16ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Кислота + металл = соль + водород
Ряд активности металлов:
Li
Вытесняют водород из кислот Н не вытесняют
В пробирки с кислотой опустите железную скрепку
В другую медную проволоку , запишите наблюдения, составьте уравнения реакций
Слайд 17Допишите уравнения возможных реакций:
Решение задач
2HCl + Mg =
H3PO4 + Zn =
MgCl2
Ag +HCl =
Zn + HCl =
Слайд 18Решение задач
Соляная кислота реагирует с
Hg? Ca? FeS?MgO?
Напишите уравнения
Са + НCl =
Н2 + СаCl2
MgO + HCl =
MgCl2 +H2O
2
2
FeS + 2 НCl =
Н2S + FeCl2
Слайд 21ИНФОРМАЦИОННЫЕ ИСТОЧНИКИ:
Габриелян О.С. и др. Контрольные и проверочные работы .
Правила техники безопасности
http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf
Получение хлороводородной кислоты
2. И.И.Новошинский, Н.С.Новошинская : учебник «Химия-8 класс 2006г. М.:ООО «Издательство Оникс»2006.-224с.