Емельяненко Т.Ю., учитель химии МОУ СОШ №1
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Карбоновые кислоты
Содержание
- 1. Презентация по химии на тему Карбоновые кислоты
- 2. Карбоновые кислотыЦель урока:•Знать строение одноосновных карбоновых кислот,
- 3. Карбоновые кислоты
- 4. Карбоновые кислоты
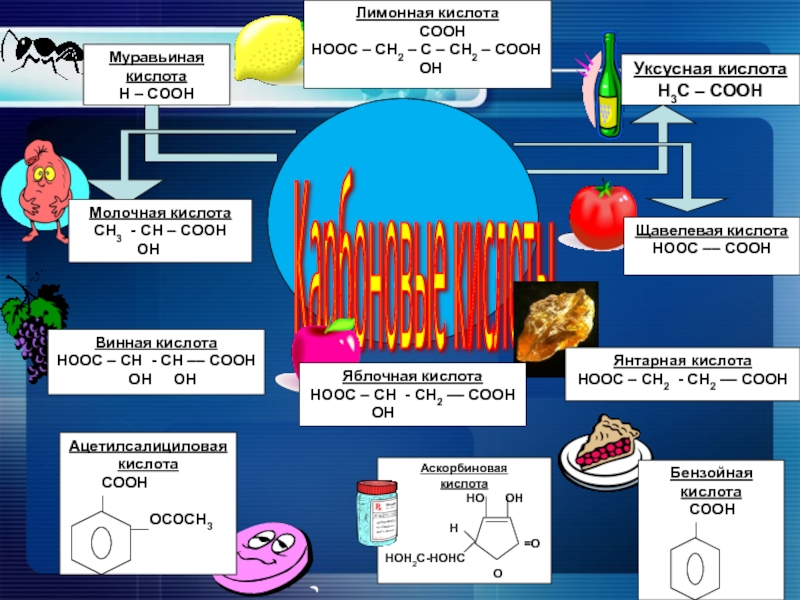
- 5. Карбоновые кислоты - производные углеводородов, в молекулах
- 6. Классификация карбоновых кислотПо числу карбоксильныхгруппнепредельныеароматическиеодноосновныедвухосновныемногоосновныепредельныеПо типу углеводородногорадикалаСН3
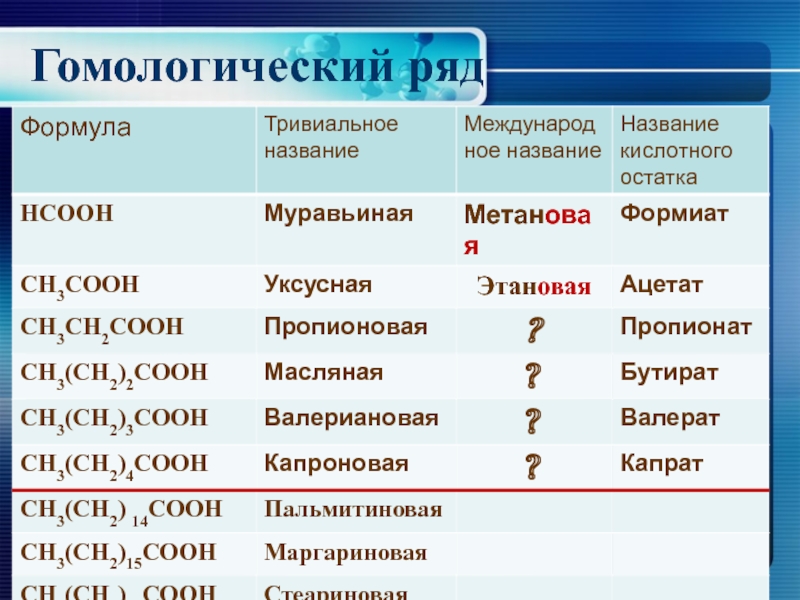
- 7. Гомологический ряд
- 8. Общая формулаСnH2n+1COOНгде n может быть равно нулю.
- 9. Физические свойстваС1 – С3 – легкоподвижные жидкости
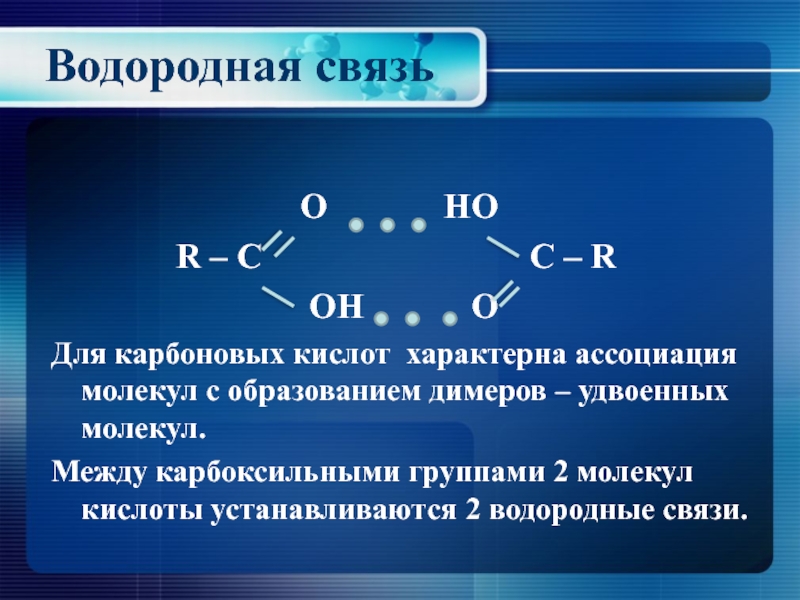
- 10. Водородная связь
- 11. Строение
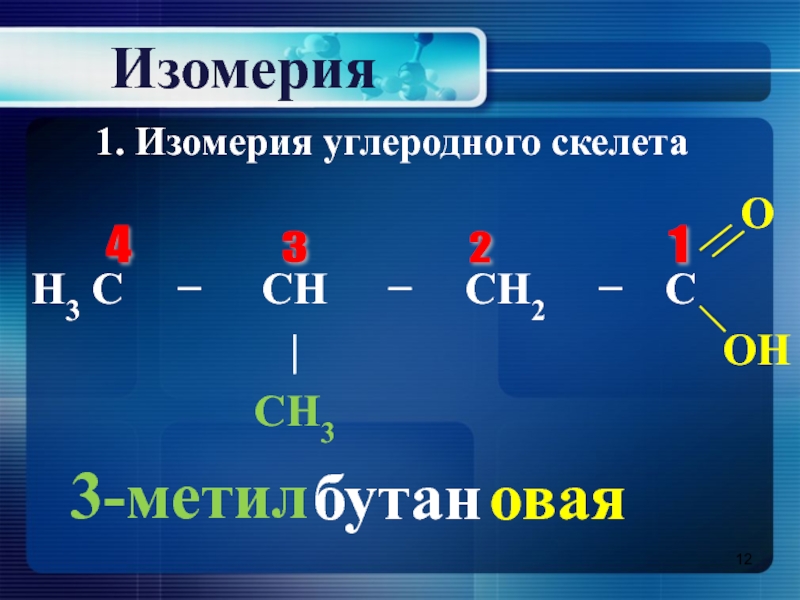
- 12. Изомерия1 4 3 2 3-метилбутановая1. Изомерия углеродного скелета
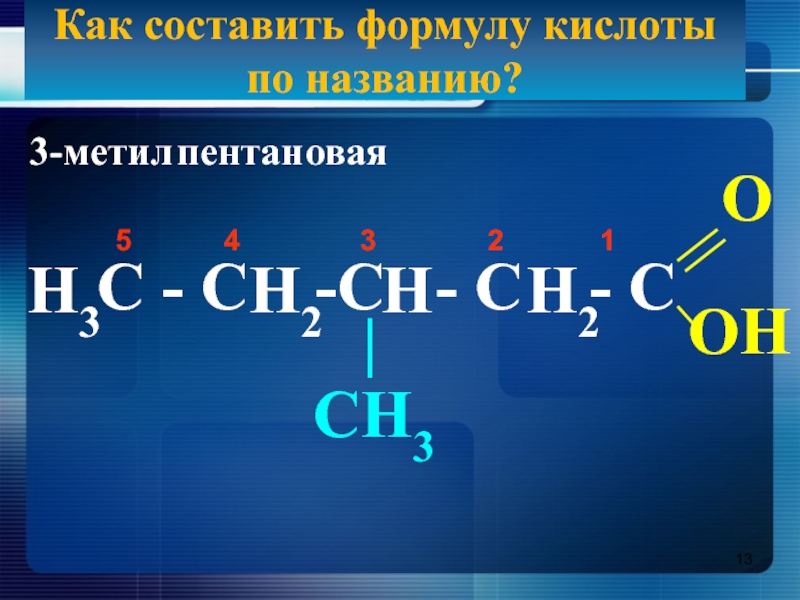
- 13. Как составить формулу кислоты по названию?3-метилпентановаяС -
- 14. Изомерия 2. Межклассовая – карбоновые кислоты изомерны
- 15. Химические свойстваДля карбоновых кислот характерны следующие реакции:Замещение
- 16. Замещение водорода в гидроксилеВ водных растворах КК
- 17. Замещение водорода в гидроксиле2. Изменяют цвет индикаторов.3.
- 18. Замещение всего гидроксилаЗамещение на галоген.Взаимодействуют со спиртами,
- 19. Реакции по месту карбонильной группыРеакция гидрирования. Идет
- 20. Замещение атомов водорода в радикалеЗамещение на галогены.
- 21. Выполни заданияКарбоновые кислоты содержат функциональную группу:
- 22. Проверь себяВ3, 4, 1, 2
Слайд 1КАРБОНОВЫЕ КИСЛОТЫ
Гомологический ряд предельных одноосновных кислот, их строение, физические и химические
Слайд 2Карбоновые кислоты
Цель урока:
•Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи,
•Уметь объяснять причины и следствия взаимного влияния атомов в молекулах карбоновых кислот.
•На примере муравьиной и уксусной кислот уметь составлять уравнения реакций, характеризующих химические свойства карбоновых кислот.
Слайд 5Карбоновые кислоты
- производные углеводородов, в молекулах которых один или несколько
О
- С - карбоксильная
ОН группа
Слайд 6Классификация карбоновых кислот
По числу карбоксильных
групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводородного
радикала
СН3 – СН2 – СН2
СН3 – СН2 – СН = СН – СООН
СООН
СН3 – СН2 – СН2 – СООН
СООН– СН2 – СН2 – СООН
СООН – СН2 – СН – СН2 –СООН
|
СООН
Слайд 9Физические свойства
С1 – С3 – легкоподвижные жидкости с острым запахом, хорошо
С4 – С10 – масляные жидкости, с неприятным запахом прогорклого масла, плохо растворимы в воде.
С11 и т.д. – твердые вещества, без запаха, нерастворимы в воде.
Все кислоты растворимы в спирте и эфире. С увеличением Мr понижается плотность кислот и увеличивается tкип
Слайд 10Водородная связь
R – C C – R
OH O
Для карбоновых кислот характерна ассоциация молекул с образованием димеров – удвоенных молекул.
Между карбоксильными группами 2 молекул кислоты устанавливаются 2 водородные связи.
Слайд 11Строение
O
R C
О H
σ+ Oσ-
R – C
О H
• •
• •
• •
• •
• •
• •
• •
• •
• •
• •
• •
σ +
Электронная плотность в карбонильной группе (особенно π-связи) смещена в сторону кислорода, как более ЭО элемента. Атом углерода приобретает частичный положи -тельный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома кислорода гидроксильной группы. Атом кислорода смещает в свою сторону электронную плотность связи О – Н => водород становится подвижнее и отщепляет- ся в виде протона Н+, что обуславливает общие свойства карбоновых кислот.
Слайд 13Как составить формулу кислоты по названию?
3-метил
пентан
овая
С - С -С
5 4 3 2 1
O
ОH
|
CH3
H3
H2
H
H2
Слайд 14Изомерия
2. Межклассовая – карбоновые кислоты изомерны сложным эфирам.
С4Н9СООН
Пентановая к-та
Метил
бутират
СН3
С3Н7 – СО – О –
Слайд 15Химические свойства
Для карбоновых кислот характерны следующие реакции:
Замещение водорода в гидроксиле.
Замещение всего
Реакции по месту карбонильной группы.
Замещение атомов водорода в радикале.
О
– С
Н
С
Н3
О
Некоторые лекарственные препараты нельзя запивать целым рядом напитков, а также кислые фрукты и соки, маринады, блюда с уксусом нельзя употреблять в пищу наряду с антибиотиками пенициллинового ряда и эритромицином.
Как вы думаете, чем вызван данный запрет?
Слайд 16Замещение водорода в гидроксиле
В водных растворах КК диссоциируют с отщеплением катиона
R – СООН → R – СОО– + Н+
КК – слабые электролиты, лишь муравьиная к-та – электролит средней силы. С увеличением Mr сила кислот убывает.
O
R – C
О H
σ +
σ +
σ –
• •
• •
Чем больше радикал, тем большую электронную плотность он подает на атом углерода карбоксильной группы, снижая его σ+ => снижается степень смещения эл-ной плотности от кислорода к углероду => уменьшается полярность связи О – Н => водород прочнее удерживается и отщепляется труднее => уменьшаются кислотные свойства.
Слайд 17Замещение водорода в гидроксиле
2. Изменяют цвет индикаторов.
3. Взаимодействуют с металлами.
4. Взаимодействуют
5. Взаимодействуют с основаниями.
6. С солями более слабых кислот.
Слайд 18Замещение всего гидроксила
Замещение на галоген.
Взаимодействуют со спиртами, образуя сложные эфиры.
Межмолекулярная дегидратация
Слайд 19Реакции по месту карбонильной группы
Реакция гидрирования. Идет труднее, чем у альдегидов.
СН3-СООН
+ Н2
- Н2О
+ Н2
t, k
t, k
Уксусная кислота
Уксусный
альдегид
Этиловый спирт
Слайд 20Замещение атомов водорода в радикале
Замещение на галогены. Идет по стадиям и
СН3-СООН + Cl2 → СН2-СООН + HCl
׀
Cl
Уксусная кислота
Хлоруксусная кислота
O
Сl СН2 C
О H
Это объясняется высокой ЭО атома галогена, который смещает эл-ную плотность на себя, обуславливая большую подвижность атома водорода группы -ОН
Галогенокислоты более сильные, чем соответствующие им КК.
Слайд 21Выполни задания
Карбоновые кислоты содержат функциональную группу: а) –ОН
2. Установите соответствие между формулой кислоты и ее названием:
А) СН3СООН 1) бутановая кислота
Б) НСООН 2) пентановая кислота
В) С3Н7СООН 3) этановая кислота
Г) С4Н9СООН 4) метановая кислота
3. Составьте формулу 2-метил-3-этил-пентановой кислоты.
4. Напишите уравнения химических реакций взаимодействия муравьиной кислоты с цинком, оксидом цинка и гидроксидом меди.
Слайд 22Проверь себя
В
3, 4, 1, 2
5
3. СН3 – СН2 – СН – СН – СООН
2НСООН + Zn → (HCOO)2Zn + H2 ↑
2НСООН + ZnO → (HCOO)2Zn + H2 O
2НСООН + Cu(OH)2 → (HCOO)2Cu + 2H2 O
׀
CН3
׀
C2Н5
Формиат цинка
Формиат цинка
Формиат меди