- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему : Карбоновые кислоты
Содержание
- 1. Презентация по химии на тему : Карбоновые кислоты
- 2. Благодаря работам известного шведского химика Карла Вильгельма
- 3. Карбоновые кислоты-Это органические вещества, в молекулах которых
- 4. Одноосновные карбоновые кислоты можно представить как:R- COOH-СООН
- 5. В зависимости от числа карбоксильных групп: одноосновные:
- 6. В зависимости от природы радикала: предельные
- 7. CH3COOH Уксусная кислота широко распространена в природе
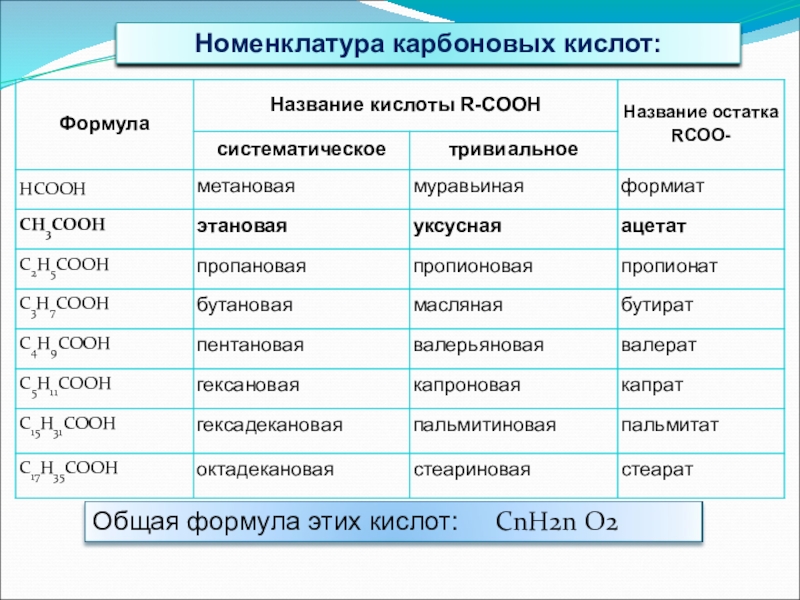
- 8. Номенклатура карбоновых кислот:
- 9. Слайд 9
- 10. Алгоритм названия карбоновых кислот:Находим главную цепь атомов
- 11. Алгоритм записи формул карбоновых кислот:Выделить корень слова
- 12. Виды изомерии.Изомерия углеродного скелета.Изомерия кратной связи.Изомерия положения функциональной группы.Межклассовая изомерия.
- 13. Изомерия карбоновых кислот Изомерия углеродного скелетаCH3-CH2-CH2-COOH
- 14. Давайте сравним:HCOOH –муравьиная
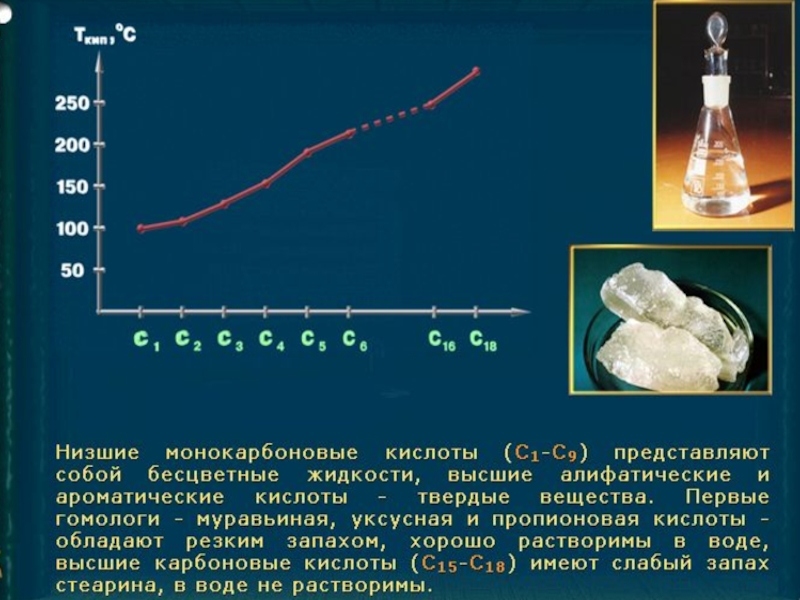
- 15. Физические свойства карбоновых кислот. Почему среди
- 16. Слайд 16
- 17. Слайд 17
- 18. Общие свойства карбоновых кислот аналогичны соответствующим свойствам
- 19. Дополнительные свойства: Реакция этерификации – образование
- 20. Выводы:Карбоновыми кислотами называются органические вещества, молекулы которых
- 21. Дифференцированная самостоятельная работа.Задание на оценку «3»Закончите уравнение
Слайд 2Благодаря работам известного шведского химика Карла Вильгельма Шееле к концу 18
Открытие кислот:
Слайд 3Карбоновые кислоты-
Это органические вещества, в молекулах которых имеется одна или несколько
Предельные одноосновные карбоновые кислоты
– можно рассматривать как производные алканов, в молекулах которых один атом водорода заменен на функциональную группу - СООН (карбоксильная группа).
Слайд 4Одноосновные карбоновые кислоты можно представить как:
R- COOH
-СООН функциональная группа
где R – углеводородный радикал
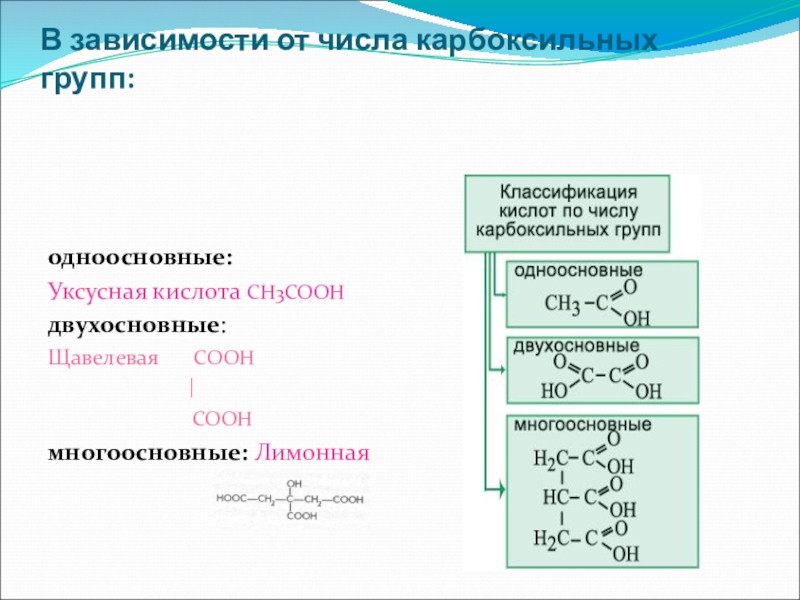
Слайд 5В зависимости от числа карбоксильных групп:
одноосновные:
Уксусная кислота CH3COOH
двухосновные:
Щавелевая
|
COOH
многоосновные: Лимонная
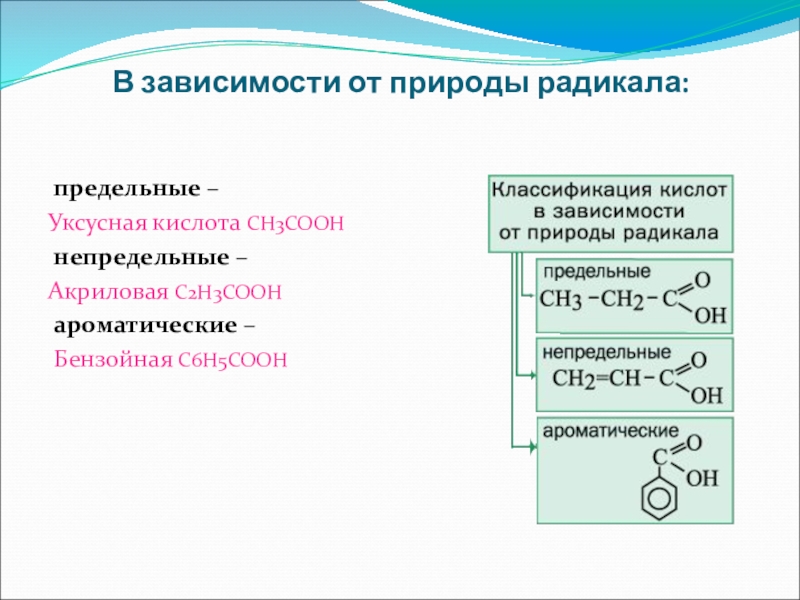
Слайд 6В зависимости от природы радикала:
предельные –
Уксусная кислота CH3COOH
непредельные
Акриловая C2H3COOH
ароматические –
Бензойная С6H5COOH
Слайд 7CH3COOH
Уксусная кислота широко распространена в природе – содержится в выделениях
Карбоновые кислоты в природе:
Слайд 10Алгоритм названия карбоновых кислот:
Находим главную цепь атомов углерода и нумеруем её,
Указываем положение заместителей и их название (названия).
После корня, указывающего число атомов углерода в цепи, идет суффикс «-овая» кислота.
Если карбоксильных групп несколько, то перед «- овая» ставится числительное ( -ди, - три…)
3- метилбутан + -овая = 3-метилбутановая кислота
Пример:
Слайд 11Алгоритм записи формул карбоновых кислот:
Выделить корень слова на основании, которого записать
Нумеруем атомы углерода, начиная с карбоксильной группы.
Указываем заместители согласно нумерации.
Необходимо дописать недостающие атомы водорода (углерод четырёхвалентен).
Проверить правильность записи формулы.
Пример:
2-метилбутановая кислота.
Слайд 12Виды изомерии.
Изомерия углеродного скелета.
Изомерия кратной связи.
Изомерия положения функциональной группы.
Межклассовая изомерия.
Слайд 13Изомерия карбоновых кислот
Изомерия углеродного скелета
CH3-CH2-CH2-COOH
CH3-CH-COOH
CH3
2метилпропановая кислота
Межклассовая изомерия
O
//
CH3-CH2-CH2-C
\
OH
O
//
CH3- CH2-C
\
O- CH3
Метиловый эфир пропановой кислоты
Слайд 14Давайте сравним:
HCOOH –муравьиная
Mr=46
При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость, хорошо растворима в воде.
C4H10-бутан
Mr=58
При нормальных условиях бесцветный горючий газ, без запаха.
Слайд 15Физические свойства карбоновых кислот.
Почему среди кислот отсутствуют газообразные вещества?
Это связано с ассоциацией молекул посредством водородных связей.
Слайд 18Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот:
1.Диссоциация
2. Взаимодействие с активными металлами.
2 HCl+ Мg = МgCl2+ Н2 .
3. Взаимодействие с основаниями – реакция нейтрализации.
2 HCl + Сu(ОН) 2 = Сu Cl2 + 2Н2О,
4. Взаимодействие с основными оксидами.
2 HCl + МgО = МgCl2 + Н2О,
5. Взаимодействие с солями более слабых кислот
2 HCl + СaСО3 = Са Cl2 + Н2О + СО2 .
1.Диссоциация
СН3 СООН = СН3СОО- + Н+
2. Взаимодействие с активными металлами.
2СН3 СООН + Мg = (СН3 СОО)2Мg + Н2 .
3. Взаимодействие с основаниями – реакция нейтрализации.
2СН3 СООН + Сu(ОН) 2 = (СН3 СОО)2Сu + 2Н2О,
4. Взаимодействие с основными оксидами.
2СН3 СООН + МgО = (СН3 СОО)2Мg + Н2О,
5. Взаимодействие с солями более слабых кислот
2СН3 СООН + СaСО3 = (СН3 СОО)2 Са + Н2О + СО2 .
Слайд 19Дополнительные свойства:
Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых
Особые свойства кислот, обусловленных наличием в их
молекулах радикалов. Реакция с галогенами.
Слайд 20Выводы:
Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько
Для карбоновых кислот характерна изомерия углеродного скелета и межклассовая.
Молекулы карбоновых кислот образуют димеры.
Общие свойства, характерные для класса карбоновых кислот, обусловлены наличием в молекулах гидроксильной группы, которая содержит резко полярную связь между атомами водорода и кислорода. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только для органических кислот.
Слайд 21Дифференцированная самостоятельная работа.
Задание на оценку «3»
Закончите уравнение химических реакций
I Вариант
C2H5COOH+ Ca= C3H7COOH+ Na=
HCOOH+ NaOH= C2H5COOH+K2CO3=
Задание на оценку «4»
С какими из перечисленных веществ H2O, Zn, KOH, HCl, будет реагировать карбоновая кислота:
С4Н9СOOH HCOOH
Задание на оценку «5»
Осуществите химические превращения:
I Вариант
Метан → хлорметан → метанол → метаналь → муравьиная кислота
II Вариант
Этан → хлорэтан → этанол → этаналь → уксусная кислота