- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Карбоновые кислоты 10 класс
Содержание
- 1. Презентация по химии на тему Карбоновые кислоты 10 класс
- 2. СтроениеКарбоновые кислоты – это вещества, содержащие в
- 3. Органические кислоты, содержащие в молекуле одну карбоксильную
- 4. В зависимости от природы углеводородного радикала карбоновые
- 5. Номенклатура и изомерияНазвание карбоновой кислоты образуется от
- 6. Физические свойства предельных одноосновных карбоновых кислотНизшие кислоты,
- 7. Молекулы предельных одноосновных карбоновых кислот содержат полярную
- 8. Химические свойстваДиссоциация с образованием катионов водорода и
- 9. Взаимодействие карбоновых кислот со спиртами с образованием
- 10. Взаимодействие с основными оксидами:2RCOOH + СаО =
- 11. Способы полученияКарбоновые кислоты могут быть получены окислением
- 12. ПрименениеМуравьиная кислота обладает дезинфицирующим свойством и поэтому
- 13. Уксусная кислота – хороший растворитель многих органических
- 14. Соли пальмитиновой и стеариновой кислот – стеараты
СтроениеКарбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа – группа атомовСостав этих кислот будет отражаться общей формулой CnH2nO2, или CnH2n+1COOH, или RCOOH.
Слайд 2Строение
Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько
карбоксильных групп.
Карбоксильная группа – группа атомов
Состав этих кислот будет отражаться общей формулой CnH2nO2, или CnH2n+1COOH, или RCOOH.
Карбоксильная группа – группа атомов
Состав этих кислот будет отражаться общей формулой CnH2nO2, или CnH2n+1COOH, или RCOOH.
Слайд 3Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными. Общая
формула этих кислот RCOOH.
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относится, например, щавелевая кислота:
Существуют и многоосновные
карбоновые кислоты, содержащие
более двух карбоксильных групп.
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относится, например, щавелевая кислота:
Существуют и многоосновные
карбоновые кислоты, содержащие
более двух карбоксильных групп.
щавелевая кислота
Слайд 4В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные,
непредельные, ароматические. Предельные (или насыщенные) карбоновые кислоты не содержат π-связей в углеводородном радикале. Например, пропановая кислота:
CH3 – CH2 – C
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом. Например, акриловая кислота: CH2 = CH – COOH
Ароматические кислоты содержат в молекуле ароматическое (бензольное) кольцо. Например, бензойная кислота:
CH3 – CH2 – C
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом. Например, акриловая кислота: CH2 = CH – COOH
Ароматические кислоты содержат в молекуле ароматическое (бензольное) кольцо. Например, бензойная кислота:
O
OH
- C
O
OH
Слайд 5Номенклатура и изомерия
Название карбоновой кислоты образуется от названия соответствующего алкана с
добавлением суффикса –ов, окончания –ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например: H – C
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
C – C
Многие кислоты имеют исторически сложившиеся, или тривиальные, названия.
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
C – C
Многие кислоты имеют исторически сложившиеся, или тривиальные, названия.
H
OH
метановая (муравьиная) кислота
O
O
OH
HO
этандионовая (щавелевая) кислота
Слайд 6Физические свойства предельных одноосновных карбоновых кислот
Низшие кислоты, содержащие в молекуле до
4 атомов углерода – жидкости с характерным резким запахом. Кислоты, содержащие от 4 до 9 атомов углерода – вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода в молекуле – твердые вещества, которые не растворяются в воде.
Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и с ростом относительной молекулярной массы.
Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и с ростом относительной молекулярной массы.
Слайд 7Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов – карбоксил
и практически неполярный углеводородный радикал.
Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи. С увеличением числа атомов в углеводородном радикале растворимость в воде карбоновых кислот снижается.
Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи. С увеличением числа атомов в углеводородном радикале растворимость в воде карбоновых кислот снижается.
Слайд 8Химические свойства
Диссоциация с образованием катионов водорода и анионов кислотного остатка:
CH3 –
COOH CH3 – COO- + H+
Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты: 2CH3 – COOH + Fe (CH3COO)2Fe + H2
Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
2R – COOH + Ca(OH)2 (R - COO)2Ca + 2H2O
Взаимодействие с солями слабых кислот с образованием последних:
CH3COOH + C17H35COONa CH3COONa + C17H35COOH
Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты: 2CH3 – COOH + Fe (CH3COO)2Fe + H2
Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
2R – COOH + Ca(OH)2 (R - COO)2Ca + 2H2O
Взаимодействие с солями слабых кислот с образованием последних:
CH3COOH + C17H35COONa CH3COONa + C17H35COOH
Слайд 9Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров – реакция
этерификации:
CH3 – C – OH + C2H5 – OH CH3 – C – OC2H5 + H2O
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода. Реакция этерификации обратима.
Реакции присоединения по кратной связи – в них вступают непредельные карбоновые кислоты. Для кислоты, содержащей в радикале одну π-связь, можно записать уравнение в общем виде:
CnH2n-1COOH + H2 CnH2n+1COOH
CH3 – C – OH + C2H5 – OH CH3 – C – OC2H5 + H2O
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода. Реакция этерификации обратима.
Реакции присоединения по кратной связи – в них вступают непредельные карбоновые кислоты. Для кислоты, содержащей в радикале одну π-связь, можно записать уравнение в общем виде:
CnH2n-1COOH + H2 CnH2n+1COOH
O
O
катализатор
Слайд 10
Взаимодействие с основными оксидами:
2RCOOH + СаО = (RCOO)2Ca + Н2О
Окисление муравьиной
кислоты (эта реакция свойственна только данной кислоте):
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + +5CO2↑ + 8H2O
Реакции замещения (с галогенами) – в нее способны вступать предельные карбоновые кислоты. Например, взаимодействие уксусной кислоты с хлором:
CH3 – COOH + Cl2 CH2Cl – COOH + HCl
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + +5CO2↑ + 8H2O
Реакции замещения (с галогенами) – в нее способны вступать предельные карбоновые кислоты. Например, взаимодействие уксусной кислоты с хлором:
CH3 – COOH + Cl2 CH2Cl – COOH + HCl
P (красный)
хлоруксусная кислота
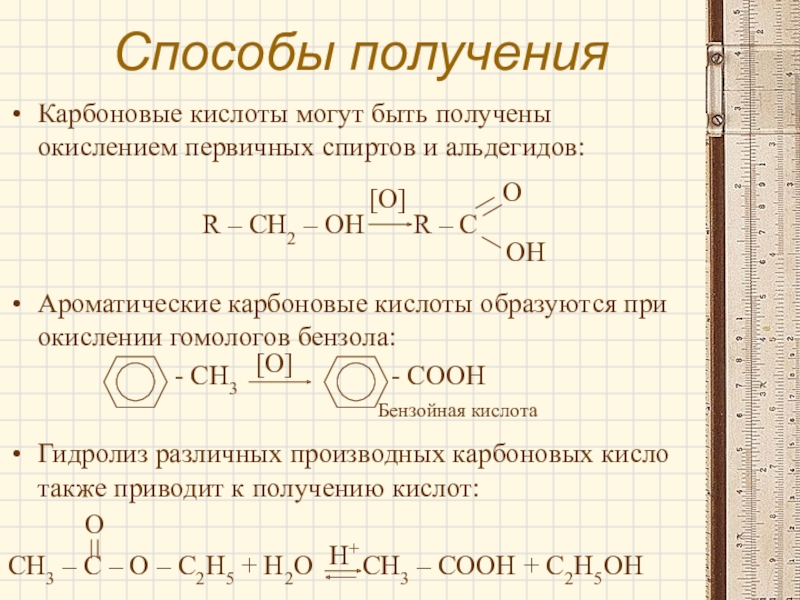
Слайд 11Способы получения
Карбоновые кислоты могут быть получены окислением первичных спиртов и альдегидов:
R
– CH2 – OH R – C
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
- CH3 - COOH
Гидролиз различных производных карбоновых кисло также приводит к получению кислот:
CH3 – C – O – C2H5 + H2O CH3 – COOH + C2H5OH
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
- CH3 - COOH
Гидролиз различных производных карбоновых кисло также приводит к получению кислот:
CH3 – C – O – C2H5 + H2O CH3 – COOH + C2H5OH
[O]
O
OH
Бензойная кислота
[O]
H+
O
Слайд 12Применение
Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в
пищевой, кожевенной и фармацевтической промышленности, медицине. Она также используется при
крашении тканей и бумаги.
крашении тканей и бумаги.
Слайд 13Уксусная кислота – хороший растворитель многих органических веществ. Используется при крашении,
в кожевенном производстве, в лакокрасочной промышленности. Уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества,
используемые для борьбы с
сорняками, - гербициды.
Уксусная кислота является
основным компонентом
винного уксуса.
используемые для борьбы с
сорняками, - гербициды.
Уксусная кислота является
основным компонентом
винного уксуса.
Слайд 14
Соли пальмитиновой и стеариновой кислот – стеараты и пальмитаты – обладают
моющим действием, поэтому их еще называют мылами.
Широкое применение в технике находят соли олеиновой кислоты.
Щавелевая кислота применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Широкое применение в технике находят соли олеиновой кислоты.
Щавелевая кислота применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.