- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Кальций
Содержание
- 1. Презентация по химии на тему: Кальций
- 2. СодержаниеСтроение атома.Происхождение названия.Нахождение в природе.Природные минералы.Физические свойства.Химические свойства.Получение.Применение.Это интересно.Кальций в организме человека.Список литературы.
- 3. Строение атомаCa40201s2 2s2 2p6 3s2 3p6 4s2
- 4. Происхождение названияНазвание кальция происходит от латинского слова «кальс» - что означает «известь, мягкий камень».
- 5. Нахождение в природеКальций обладает большой химической активностью, поэтому в природе встречается только в виде соединений.
- 6. МраморСостав, свойстваМрамор (греч.— «сияющий камень») — метаморфическая
- 7. кальцитСостав, свойстваКальци́т, известковый шпат — минерал CaCO3
- 8. ДоломитСостав, свойстваДвойная соль СаСО3-МgСО3; окись кальция (СаО)
- 9. ГипсСостав, свойстваГипс (роза пустыни)Химический состав гипса —
- 10. ФосфоритСостав, свойстваосадочные горные породы, основным компонентом которых
- 11. ИзвестнякСостав, свойствасостоит преимущественно из кальцита СаСО3 (редко
- 12. Физические свойстваКальций легкий, серебристо – белый металл,
- 13. Химические свойстваПодобно щелочным металлам кальций является сильным
- 14. ПолучениеИз-за активности, получают кальций путем электролиза расплава
- 15. ПрименениеБлагодаря большой химической активности металлический кальций применяют
- 16. Это интересноВ результате круговорота солей кальция в
- 17. На долю кальция приходится 1,5% массы человека,
- 18. Список литературыФельдман Ф.Г., Рудзитис Г.Е. Химия 9
Слайд 2Содержание
Строение атома.
Происхождение названия.
Нахождение в природе.
Природные минералы.
Физические свойства.
Химические свойства.
Получение.
Применение.
Это интересно.
Кальций в организме
Список литературы.
Слайд 3Строение атома
Ca
40
20
1s2 2s2 2p6 3s2 3p6 4s2
Расположен во II А
Степень окисления +2
упражнение
Слайд 4Происхождение названия
Название кальция происходит от латинского слова «кальс» - что означает
Слайд 5Нахождение в природе
Кальций обладает большой химической активностью, поэтому в природе встречается
Слайд 6Мрамор
Состав, свойства
Мрамор (греч.— «сияющий камень») — метаморфическая горная порода, состоящая только
Окраска мрамора также зависит от примесей. Большинство цветных мраморов имеет пёструю окраску.
Природные минералы
Слайд 7кальцит
Состав, свойства
Кальци́т, известковый шпат — минерал CaCO3 из группы карбонатов, одна
Природные минералы
Слайд 8Доломит
Состав, свойства
Двойная соль СаСО3-МgСО3; окись кальция (СаО) 30,4%, окись магния (MgO)
примеси: железо, марганец (до нескольких процентов).
Доломит встречается бесцветный или белый, окрашенный примесями (желтый, бурый, черный).
Природные минералы
Слайд 9Гипс
Состав, свойства
Гипс (роза пустыни)
Химический состав гипса — CaSO4 + 2Н2O, водный
бесцветный и прозрачный сорт гипса, который имеет жемчужный блеск.
Природные минералы
Слайд 10Фосфорит
Состав, свойства
осадочные горные породы, основным компонентом которых являются фосфаты кальция из
Природные минералы
Слайд 11Известняк
Состав, свойства
состоит преимущественно из кальцита СаСО3 (редко из арагонита).
Наиболее частыми
Природные минералы
Слайд 12Физические свойства
Кальций легкий, серебристо – белый металл, с металлическим блеском, который
ρ = 1,55 г/см3 тверже чем щелочные металлы, tпл = 8510 С
Слайд 13Химические свойства
Подобно щелочным металлам кальций является сильным восстановителем.
С простыми веществами:
Ca +
Ca + S = CaS
Ca + H2 = CaH2
2Ca + O2 = 2CaO
Со сложными веществами:
Ca + 2HCl = CaCl2 + H2 ↑
Ca + 2H2O = Ca(OH)2 + H2 ↑
5Ca + V2O5 = 5CaO + 2V
Слайд 14Получение
Из-за активности, получают кальций путем электролиза расплава хлорида кальция:
CaCl2 = Ca
Или при восстановлении из оксидов при высоких температурах:
3CaO + 2Al = 3Ca + Al2O3
Слайд 15Применение
Благодаря большой химической активности металлический кальций применяют для:
Восстановления некоторых тугоплавких металлов
В производстве стали и чугуна – для очистки от кислорода и серы;
Для получения свинцово – кальциевых сплавов для подшипников и оболочек кабелей;
Слайд 16Это интересно
В результате круговорота солей кальция в природе образуются карстовые пещеры,
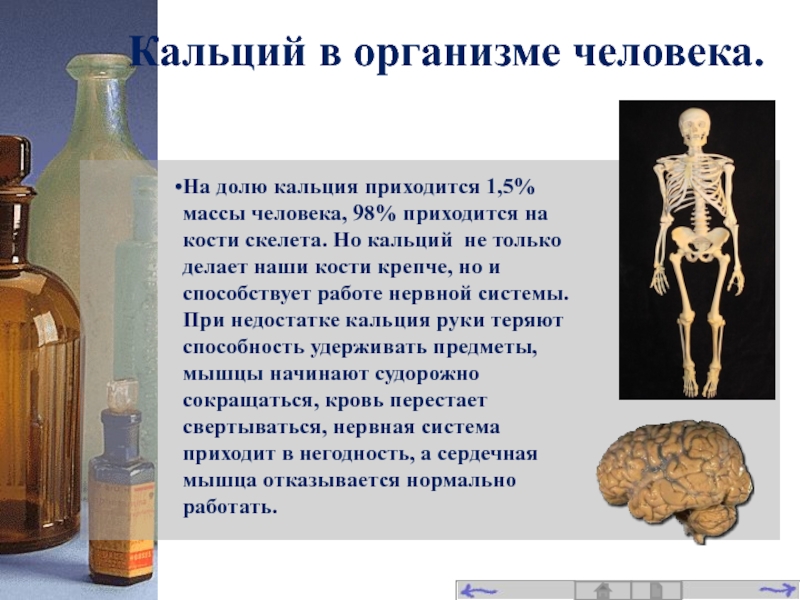
Слайд 17На долю кальция приходится 1,5% массы человека, 98% приходится на кости
Кальций в организме человека.
Слайд 18Список литературы
Фельдман Ф.Г., Рудзитис Г.Е. Химия 9 класс. Учебник для общеобразовательных
Габриелян О.С. Химия 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2008.
Горковенко М.Ю. Поурочные разработки по химии 9 класс. М.: ВАКО, 2008.
Князев Д.А. Неорганическая химия: учебник для ВУЗов. М. Дрофа, 2004.
Энциклопедический справочник юного химика.